肝細胞肝癌治療前后MRI-PWI參數、sFas、miR-224含量變化及對短期生存狀況的預測價值
朱 宏 鄭雪麗 黃寶生 王穎超 燕麗紅
(1.河西學院附屬張掖人民醫院;2.河西學院臨床醫學院,甘肅 張掖 734000)
據統計,肝細胞肝癌(Hepatocellular carcnoma,HCC)病死率居所有癌癥相關死亡的第2 位,嚴重威脅患者生命安全,給予HCC 患者及時有效治療尤為重要[1-2]. 目前經皮肝動脈化療栓塞術(Transcatheter hepatic arterial chemoembolization,TACE)在HCC 患者中應用價值受到臨床醫師廣泛認可,但對其療效評估方面存在一定爭議[3].磁共振成像(Magnetic resonance imaging,MRI)是評估TACE療效的影像學手段之一,但其多依賴于腫瘤形態學改變評估療效,具有一定局限性.而磁共振灌注成像(MRI-perfusion weighted imaging,MRI-PWI)通過灌注參數值進行定量分析,能有效彌補MRI不足.可溶性Fas(Soluble Fas,sFas)是腫瘤壞死因子受體超家族成員之一,在HCC患者中呈過表達[4].新近研究表明,微小RNA-224(microRNA-224,miR-224)可促進肝癌細胞增殖、遷移、侵襲,并抑制其凋亡[5],但關于其與HCC患者療效、生存狀況關系尚需進一步探究.鑒于此,本研究選取89例HCC患者,觀察MRI-PWI參數、sFas、miR-224含量變化,分析其與療效、短期生存狀況關系,以期為臨床確定治療措施提供依據.
1 資料與方法
1.1 臨床資料
選取2018 年1 月~2019 年10 月我院89 例HCC 患者作為研究對象,(1)納入標準:符合《內科學》HCC診斷標準[6],結合病理檢查確診;年齡18~80歲;Child-Puch分級B級、C級;均成功施行TACE;生存周期>12周;患者及家屬知曉并簽署同意書;(2)排除標準:其他惡性腫瘤者;心腦血管疾病者;入組前4周接受免疫制劑治療者;MRI-PWI不耐受者.其中男48例,女41例;年齡18~80歲,平均(49.11±13.89)歲;體質量指數(BMI)18~25 kg/m2,平均(21.56±1.38)kg/m2;腫瘤數目:38例≥2個,51例<2個;腫瘤直徑:35例≥5cm,54例<5cm;分化程度:37例中高分化,52例低分化;Child-Puch 分級:49 例B 級,40 例C 級;微血管浸潤:37 例有,52 例無;淋巴結轉移:35例有,54例無.本研究經醫院倫理委員會審核批準.
1.2 方法
1.2.1 MRI-PWI 檢測 檢查前,禁食12h,仰臥位,叮囑受檢者胸式呼吸,應用GE Discovery MR 750 3.0 T MR掃描儀及8通道體部相控陣線圈,先行常規軸位T1WI、T2WI掃描,隨后經高壓注射液于肘前靜脈團注對比劑扎噴酸葡胺注射液,劑量0.2mmol/kg,速度4ml/s,同時追加20ml生理鹽水,更換至PWI模式,定位像為屏氣冠狀位T1WI,使用body線圈,快速擾相GRE序列,TE1.3ms,TR5.3ms,矩陣256×256,FOV34×26,層厚8.0mm,NEX1.0,間隔2.0mm,掃描時間3min,每3s進行1 次全肝采集.所得原始圖像上傳至AW4.3 工作站,以相關軟件處理,選取病灶橫截面積最大、信號最強的層面繪制感興趣區(ROI),獲得容積轉運常數(Ktrans)、血管外細胞外間隙容積比(Vc),所有數據連續測量3次,取均值.由2名高年資醫師盲法判斷,意見不統一時,請教上級醫師,得出統一結論.
1.2.2 血清指標檢測 (1)標本采集:清晨8:30~9:30,抽取4ml 外周靜脈血,分為兩份(各2 ml),靜置20min,以2500r/min速度離心15min,取上清液,-70℃保存備用.(2)sFas:應用全自動生化分析儀(日本日立公司,HITACHI7180型),以雙抗體酶聯免疫法測定血清sFas水平.由我院檢驗科醫師完全參照試劑盒說明書操作.(2)miR-224:取2ml 血清標本,參照德國Qiagen 公司提供miRNeasy 血清試劑盒提取總RNA,RNA 質量以分光光度計評估,所有洗脫RNA 樣品經DNA 酶Ⅰ(Sigma)處理;以miScriptⅡRT 試劑盒(Aiagen)逆轉錄成熟miRNA,參照Applied Biosystem 7500 實時RCP系統進行實時定量聚合酶鏈式反應(QRT-PCR),反應體系20 μl,反應條件:94℃預變性2min,94℃20s,60℃30s,60℃34s,共35~40 個循環反應,miR-224 引物:s:5,-GTCGTATC?CAGTGCAGGGTCCGAGGTATTCGCACTGGATACGACTAAACG-3,as:5,-CGCAAGTCCTAGTG?GTTCCG-3,;U6引物:s:5,-CTCGCTTCGGCAGCACA-3,,as:5,-AACGCTTCACGAATTTGC?GT-3,,上述引物均由上海生工生物工程有限公司合成,每個miRNA的相對表達量用2-△△Ct表示,△△Ct=(CtHCC-miR224-CtHCC-u6)-(CtNC-miR224-ctNC-u6),每個樣本重復3次試驗.
1.2.3 治療方法 所有患者均行TACE,利多卡因(濃度2%)局麻,Terumo股動脈專用套管針進行一次性穿刺,置入5F動脈鞘管,先行腹腔動脈、肝總動脈及腸系膜上動脈常規造影,確定腫瘤大小、部位、血供,自腫瘤供血血管注入25mg吡柔比星+700mg氟尿嘧啶,同時將10mg吡柔比星與2 ml碘化油混合液與一定量明膠海綿顆粒栓塞靶動脈,每月1次,連用2次,術后常規給予保肝、抗生素、止痛等藥物.
1.3 療效評價
參照實體瘤療效評價標準評估,完全緩解(CR):目標病灶動脈期增強顯影消失;部分緩解(PR):目標病灶直徑總和縮小30%及以上;疾病穩定(SD):目標病灶直徑總和縮小29%及以下;疾病進展(PD):目標病灶直徑總和增大20%及以上,或出現新病灶.將CR、PR、SD 歸入穩定,PD歸入進展.
1.4 觀察指標
(1)HCC患者治療前、治療后4周MRI-PWI參數、血清sFas、miR-224水平.(2)不同療效患者治療前、治療后4周MRI-PWI參數、血清sFas、miR-224水平.(3)不同生存狀況治療前、治療后4周患者MRI-PWI 參數、血清sFas、miR-224水平.(4)MRI-PWI參數、血清sFas、miR-224水平單一或聯合預測HCC死亡價值.(5)MRI-PWI參數、血清sFas、miR-224水平與HCC患者死亡關系.
1.5 統計學處理
2 結果
2.1 治療前后各指標
89例HCC患者治療后4周miR-224、sFas、Vc、Ktrans低于治療前(P<0.05).見表1.
表1 治療前后各指標(±s)
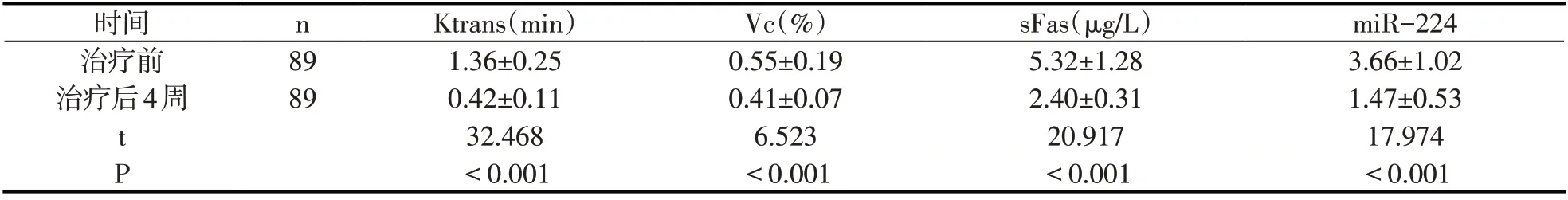
表1 治療前后各指標(±s)
時間治療前治療后4周n 89 89 t P Ktrans(min)1.36±0.25 0.42±0.11 32.468<0.001 Vc(%)0.55±0.19 0.41±0.07 6.523<0.001 sFas(μg/L)5.32±1.28 2.40±0.31 20.917<0.001 miR-224 3.66±1.02 1.47±0.53 17.974<0.001
2.2 進展及穩定患者治療前后各指標
治療前進展及穩定患者sFas、miR-224、Vc、Ktrans比較,無顯著差異(P>0.05),治療后4周穩定患者miR-224、sFas、Vc、Ktrans低于進展患者(P<0.05).見表2.
表2 進展及穩定患者治療前后各指標(±s)
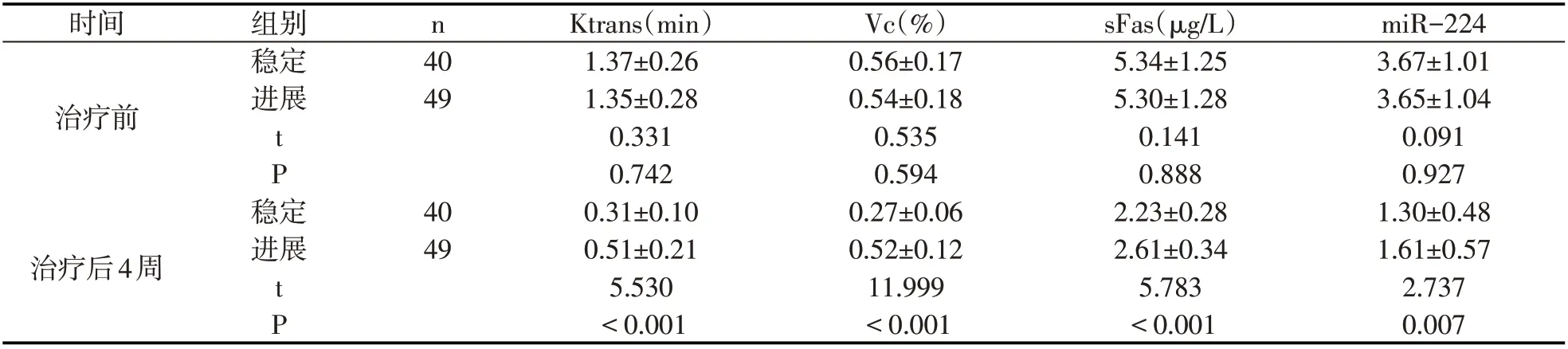
表2 進展及穩定患者治療前后各指標(±s)
時間n治療前組別穩定進展40 49 tP穩定治療后4周進展40 49 tP Ktrans(min)1.37±0.26 1.35±0.28 0.331 0.742 0.31±0.10 0.51±0.21 5.530<0.001 Vc(%)0.56±0.17 0.54±0.18 0.535 0.594 0.27±0.06 0.52±0.12 11.999<0.001 sFas(μg/L)5.34±1.25 5.30±1.28 0.141 0.888 2.23±0.28 2.61±0.34 5.783<0.001 miR-224 3.67±1.01 3.65±1.04 0.091 0.927 1.30±0.48 1.61±0.57 2.737 0.007
2.3 生存及死亡患者各指標
治療后隨訪12 周,發現12 例死亡,77 例生存.治療前生存及死亡患者sFas、miR-224、Vc、Ktrans比較,無顯著差異(P>0.05),治療后4周生存患者miR-224、sFas、Vc、Ktrans低于死亡患者(P<0.05).見表3.
表3 生存及死亡患者治療前后各指標(±s)

表3 生存及死亡患者治療前后各指標(±s)
時間n治療前組別生存死亡77 12 t P生存治療后4周死亡77 12 t P Ktrans(min)1.35±0.29 1.42±0.22 0.799 0.426 0.33±0.10 1.00±0.31 14.938<0.001 Vc(%)0.54±0.21 0.61±0.14 11.114 0.268 0.30±0.09 1.12±0.35 2.830 0.006 sFas(μg/L)5.31±1.58 5.38±1.54 0.143 0.886 2.21±0.66 3.62±1.08 6.252<0.001 miR-224 3.65±1.13 3.72±1.01 0.202 0.840 1.32±0.40 2.43±0.73 7.858<0.001
2.4 單一及聯合預測HCC患者死亡價值
ROC 顯示,聯合預測HCC 患者死亡價值的AUC 為0.881(95%CI:0.795~0.940),診斷敏感度及特異度分別為83.33%、89.61%,其次為Ktrans 0.827(0.733~0.899)、Vc 0.811(0.714~0.886)、miR-224 0.805(0.708~0.882)、sFas 0.797(0.699~0.875).見表4,圖1~2.
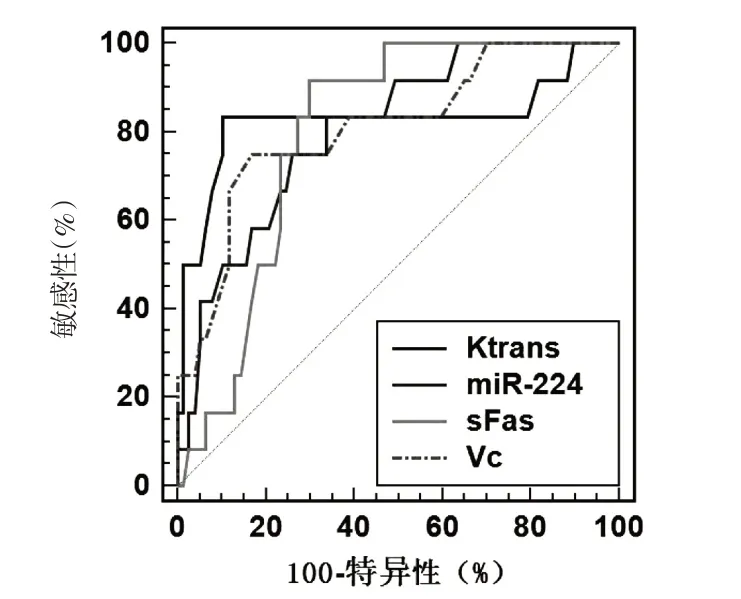
圖1 單一預測HCC患者死亡價值

表4 單一及聯合預測HCC患者死亡價值
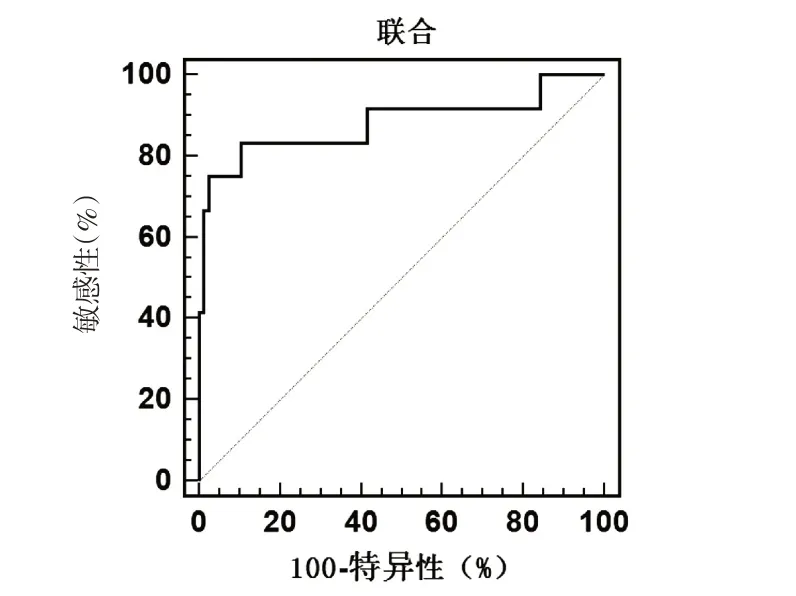
圖2 聯合預測HCC患者死亡價值
2.5 各指標與生存狀況關系
根據ROC分析sFas、miR-224、Vc、Ktrans最佳截斷值分為高危組和低危組.KM曲線顯示,sFas、miR-224、Vc、Ktrans 高危組生存率低于低危組(χ2分別為8.667、6.489、4.680、6.782,P<0.05).見圖3~6.
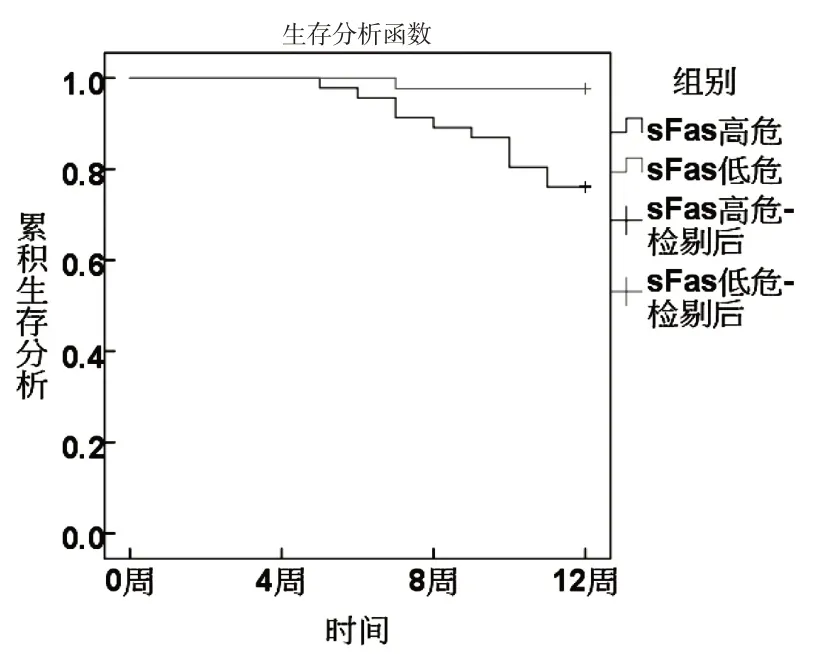
圖3 sFas與生存狀況關系
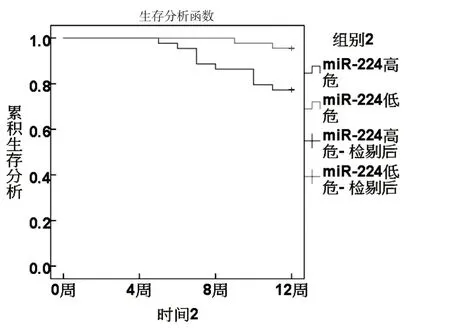
圖4 miR-224與生存狀況關系
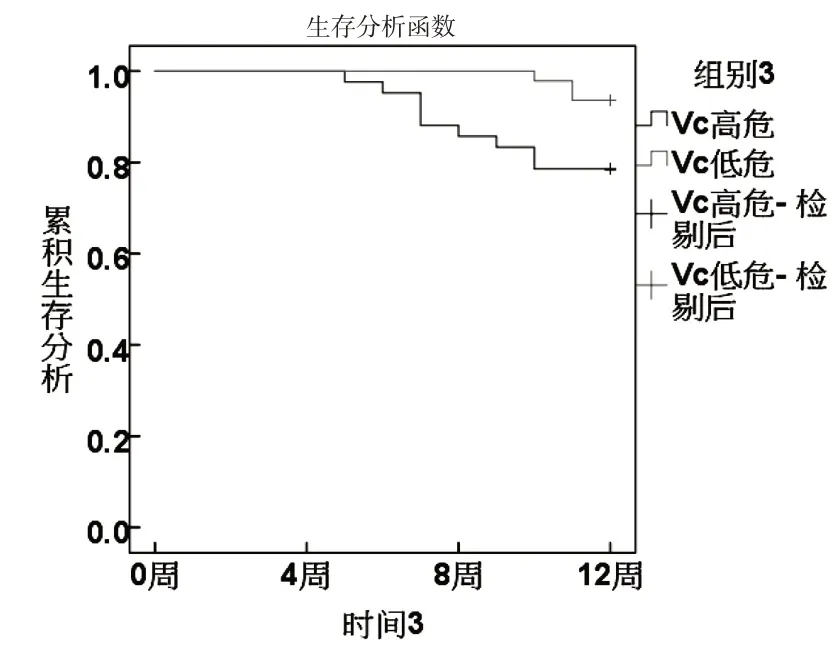
圖5 Vc與生存狀況關系
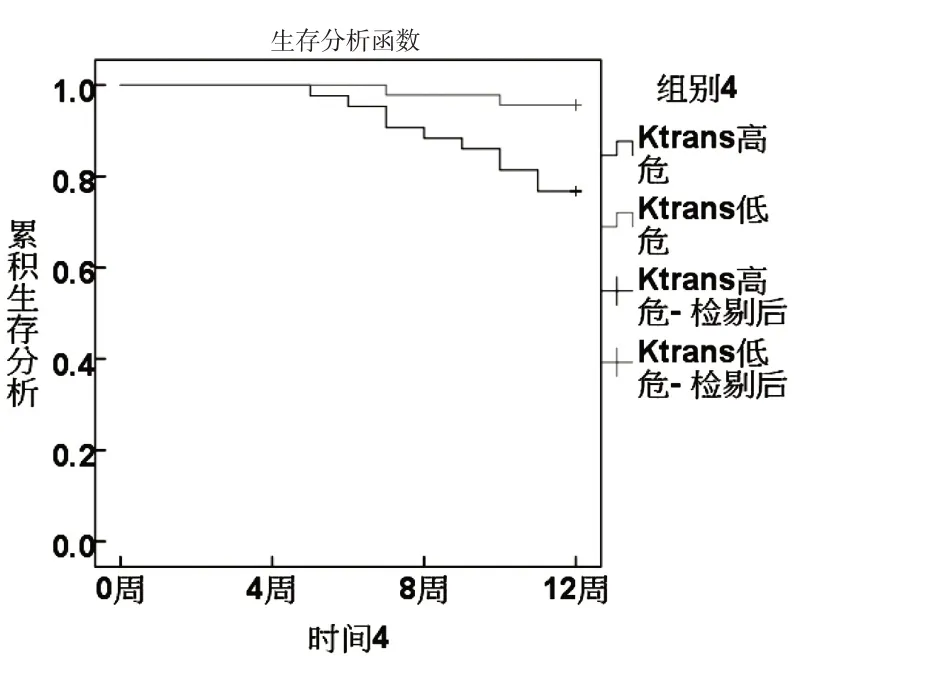
圖6 Ktrans與生存狀況關系
2.6 logistic回歸分析影響HCC患者死亡因素
以HCC患者是否死亡作為因變量,分化程度、腫瘤直徑、Child-Pugh 分級、腫瘤數目、微血管侵犯、淋巴結轉移、sFas、miR-224、Vc、Ktrans 作為自變量納入logistic 回歸模型,結果顯示,低分化程度、腫瘤直徑≥5cm、腫瘤數目≥2個、Child-Pugh 分級C級、微血管侵犯、淋巴結轉移、sFas≤2.50μg/L、miR-224>2.06、Vc>0.82%、Ktrans>1.01min是影響HCC患者死亡危險因素(P<0.05).見表5.
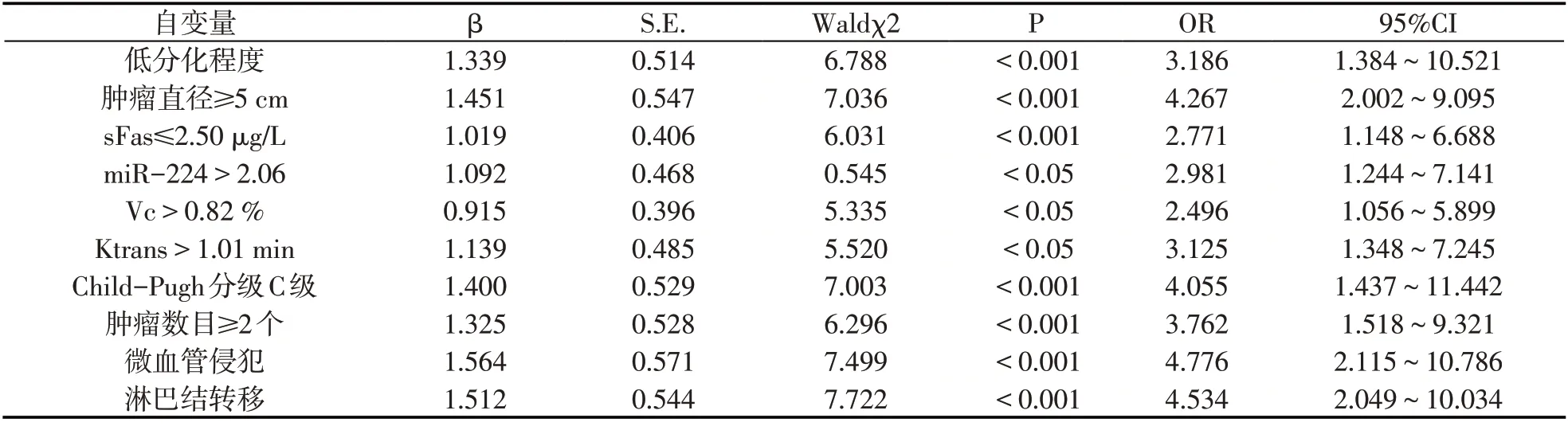
表5 logistic回歸分析影響HCC患者死亡因素
3 討論
HCC是惡性程度最高腫瘤性疾病,易于復發和遠處轉移,因而臨床治療效果差,病死率高[7].發病初期,HCC 患者無特異性臨床表現,確診時已屬中晚期,需采取TACE 等介入治療.TACE 作用機制是將抗癌藥物直接作用于病變部位,殺傷腫瘤細胞,結合栓塞可影響腫瘤細胞血供,導致腫瘤細胞死亡,但其無法完全殺傷腫瘤細胞,需行多次TACE,特別是瘤體巨大者[8-9].如何客觀評價TACE療效,了解TACE介入術后腫瘤壞死程度,對臨床調整治療方案具有積極意義.
目前,TACE的療效判斷主要依賴于MRI,但常規肝臟MRI檢查序列多局限于形態學,隨醫學技術快速發展,影像醫學正從單純形態學逐步向形態學結合反映細胞、分子水平生理生化改變的功能學檢查發展[10-11].PWI可無創性反映組織血管化程度及血流灌注情況,量化分析組織及腫瘤血管動力學方面信息,現已廣泛應用于神經系統、肌肉骨關節系統.傳統觀念認為,PWI易受脈搏、呼吸、腸道蠕動等因素影響,難以在肝臟、胃等腹部臟器廣泛應用[12].近年隨磁共振快速及超快速成像序列開發及應用,成像時間、信噪比得到明顯改善,腹部磁共振灌注成像質量得到明顯提高,對實現磁共振肝臟灌注成像提供有利依據.本研究給予89例接受TACE 的HCC患者MRI-PWI檢查,結果發現,治療后4周Ktrans低于治療前,且穩定患者Ktrans低于進展患者(P<0.05),與朱正[13]研究結果相符,提示Ktrans值越低,HCC患者TACE療效越好.Vc是對比劑在組織血管外細胞外間隙所占容積比,資料顯示,惡性腫瘤Vc值高于正常組織,并指出對TACE治療有效的腫瘤組織Vc值會降低[14],究其原因在于,TACE 治療后,腫瘤血供受化療藥物、碘油填充破壞較大,壞死較徹底,腫瘤體積縮小更為明顯,Ktrans 及Vc值下降越明顯.本研究隨訪12周發現,生存患者Vc、Ktrans 低于死亡患者(P<0.05),說明Vc、Ktrans 升高可能與HCC 患者生存狀況有關.ROC 顯示,Vc、Ktrans 升高可作為HCC 患者死亡預測指標之一. logistic 回歸分析顯示,Vc>0.82%、Ktrans>1.01min為患者死亡的獨立危險因素,提示MRI-PWI 參數升高會增加HCC 患者死亡風險,需及時給予相應治療.
HCC發生發展與細胞凋亡密切相關,而sFas可能是肝癌細胞凋亡途徑之一[15].sFas可結合sFas配體,刺激半胱天冬蛋白酶,導致細胞發生蛋白水解,誘導肝癌細胞凋亡.亦有研究表明,原發性肝癌患者血中sFas水平高于健康體檢者[16].sFas可抑制FasL誘導的淋巴細胞凋亡,增加體內激活淋巴細胞數量,參與原發性肝癌病理過程.魯玉娟等[17]研究指出,香菇多糖聯合TACE可降低原發性肝癌患者sFas水平.但目前關于HCC患者經TACE治療后sFas水平變化研究較少,故本研究對此進行分析,發現治療4周后血清sFas水平低于治療前,且穩定患者低于進展患者,可能與TACE治療后腫瘤病灶肝動脈及門靜脈供血得到治療有關,亦從側面反映高sFas 可能與HCC 患者TACE 治療療效有關.本研究還發現,治療4 周后生存患者sFas 低于死亡患者(P<0.05),說明HCC 患者sFas持續升高會導致淋巴細胞凋亡延遲,加劇肝組織損傷,進而導致患者死亡.ROC 顯示,sFas 預測HCC 患者死亡價值的AUC 為0.797.logistic 回歸分析顯示,sFas 是HCC 患者死亡的獨立危險因素.上述結果均說明sFas水平越高,HCC患者死亡風險越大,建議臨床及時采取治療措施,以降低死亡率.
近年miR-224與腫瘤形成、復發轉移關系成為當前生物醫學研究熱點領域.相關研究指出,血清miR-224 在HCC 患者中平均表達量約為健康人的10 倍,推測是由于肝癌組織中高表達的miR-224 以一定方式釋放入外周血所致[18].亦有學者發現,血清miR-224 濃度與肝癌組織濃度呈正相關,手術切除腫瘤組織后,其濃度明顯下降[19-20].上述結果提示HCC患者血清miR-224濃度升高可能與腫瘤組織有關,但其釋放機制尚未清晰.本研究結果顯示,89例HCC患者治療后4周miR-224低于治療前,且穩定患者低于進展患者(P<0.05),可能與TACE能縮小腫瘤體積,降低血清miR-224 水平有關,同時說明miR-224 有望成為評估TACE 療效的生物學標志物之一.另有研究報道,血清miR-224 與HCC 患者臨床分期、病理分化程度密切相關,可增加腫瘤侵襲性,引起腫瘤轉移,加劇病情進展,降低患者生存率[21].本研究還發現,治療后4周生存患者miR-224低于死亡患者(P<0.05),說明miR-224對HCC患者死亡具有一定預測價值.同時多因素回歸分析顯示,miR-224 是HCC 患者死亡獨立危險因素,有助于臨床醫師早期預測死亡風險,確定合理治療方案.此外,ROC 曲線顯示,聯合預測HCC 患者死亡價值的AUC 為0.881,提示臨床應重視MRI-PWI 參數、sFas、miR-224聯合預測HCC死亡價值,及時調整治療方案,降低HCC患者死亡風險.
綜上可知,HCC患者TACE治療后MRI-PWI參數、sFas、miR-224較治療前減低,聯合檢測能較好預測HCC患者生存狀況,為臨床診治提供科學依據.

