血清D-二聚體、白細胞介素-1β與B型主動脈夾層患者覆膜支架腔內修復術治療預后的關系
魏玉鑫
(南陽市第一人民醫院 心臟大血管外科,河南 南陽 473000)
覆膜支架腔內修復術(endovascular aortic repair,EVAR)將覆膜支架導入主動脈夾層真腔內,利用支架的彈性擴張和支架裸端錨定,封堵主動脈夾層破口,隔絕真腔血流進入假腔,從而達到重建主動脈管壁、恢復主動脈血流等目的,是目前治療B型主動脈夾層(type B aortic dissection,TBAD)較為有效的術式[1]。但支架覆膜覆蓋部分脊髓重要供血動脈,可導致血栓形成,患者預后較差。因此,尋找可有效預測TBAD患者接受EVAR治療預后情況的相關指標具有必要性。臨床研究發現,血流動力學異常、動脈損傷破裂和斑塊破裂脫落與TBAD發生、發展密切相關[2]。血清D-二聚體(D-dimer,D-D)可反映循環系統血液高凝程度及血栓形成情況,加劇血流動力學障礙[3]。白細胞介素-1β(interleukin-1β,IL-1β)為炎癥因子,炎癥反應可產生蛋白類或減少抗蛋白酶,降解細胞外基質,加重動脈損傷及主動脈破裂的風險[4]。由此推測,血清D-D、IL-1β水平與TBAD患者預后可能具有一定的聯系。本研究旨在觀察血清D-D、IL-1β水平在TBAD患者中表達,并分析二者與患者接受EVAR治療預后的關系,現報告如下。
1 資料與方法
1.1 一般資料本研究經南陽市第一人民醫院醫學倫理委員會審核批準。選取2019年4月至2021年4月南陽市第一人民醫院收治的102例TBAD患者為研究對象。102例TBAD患者中,男74例,女28例;年齡42~69歲,平均(51.93±2.30)歲;夾層累及主動脈弓區域S1為1例,S2為8例,S3為88例,S4為5例;原破口遠端夾層累及區Ⅰ區19例,Ⅱ區24例,Ⅲ區28例,Ⅳ區31例。
1.2 選取標準(1)納入標準:①TBAD符合《主動脈夾層診斷與治療規范中國專家共識》[5]中相關診斷標準,且經超聲心動圖、主動脈CT血管造影等檢查確診;②累及左鎖骨下動脈遠端主動脈至股動脈;③于本院接受EVAR治療,且獲得術后6個月的隨訪結果;④發病時間≤14 d;⑤患者及家屬簽署知情同意書。(2)排除標準:①A型主動脈夾層;②主動脈間壁存在血腫;③主動脈透壁存在潰瘍;④TBAD復發;⑤術中或隨訪期間死亡;⑥合并其他感染性疾病、慢性消耗性疾病;⑦入院時存在肝、腎功能不全。
1.3 預后評估及分組方法術后,隨訪3個月。隨訪3個月時,采用主動脈CT血管造影進行檢查:儀器為西門子800排螺旋CT機,掃描范圍從胸廓上口止于恥骨聯合平面,經外周靜脈注入90~100 mL碘海醇(GE Healthcare AS,國藥準字HJ20160025),注射速率為2.5~3 mL·s-1,觀察患者覆膜支架、真腔等情況,參考《主動脈夾層診斷與治療規范中國專家共識》[5]評估預后情況,若覆膜支架完全封閉胸主動脈破口,真腔正常,血流正常,且無明顯近端內漏,無需外科手術或介入處理的嚴重并發癥則表示預后良好,并納入預后良好組,其余納入預后不良組。
1.4 血清D-D、IL-1β水平檢測方法術前采集患者清晨7:00—9:00空腹>8 h外周肘靜脈血3 mL,以3 500 r·min-1速率離心15 min,取上清液。采用膠體金法檢測患者血清D-D水平,試劑盒選自深圳市晉百慧生物有限公司。采用雙抗體夾心酶聯免疫吸附試驗檢測血清IL-1β水平,試劑盒選自上海康朗生物科技有限公司。相關操作需嚴格遵照試劑盒說明書進行。
1.5 基線資料設計基線資料填寫表,統計患者性別(男、女)、年齡、夾層累及主動脈弓區域(S1、S2、S3、S4)、原破口遠端夾層累及區(Ⅰ、Ⅱ、Ⅲ、Ⅳ區)、基礎疾病(合并高血壓、糖尿病)等資料。
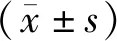
2 結果
2.1 102例TBAD患者預后情況102例TBAD患者經評估,18例預后不良,占17.65%(18/102)。
2.2 預后不良與預后良好的TBAD患者術前血清D-D、IL-1β水平及基線資料預后不良組術前血清D-D、IL-1β水平高于預后良好組,差異有統計學意義(P<0.05);組間其他基線資料比較,差異無統計學意義(P>0.05)。見表1。

表1 預后不良與預后良好的TBAD患者術前血清D-D、IL-1β水平及基線資料比較
2.3 logistic回歸分析結果將TBAD患者術前血清D-D、IL-1β水平作為自變量(均為連續變量),將TBAD患者接受EVAR治療預后情況作為因變量(預后不良=1,預后良好=0),經logistic回歸分析,結果顯示,術前血清D-D、IL-1β過表達與TBAD患者接受EVAR治療預后不良有關(P<0.05)。見表2。

表2 血清D-D、IL-1β水平與TBAD患者接受EVAR治療預后關系的logistic回歸分析結果
3 討論
EVAR可修補夾層部位,降低夾層破裂的風險,但支架置入后可引起置入段血管的血流動力學改變,增加術后再狹窄的風險,且手術具有一定的創傷性,可引起術后一系列并發癥,進而影響預后。因而,尋找可評估、預測TBAD患者接受EVAR治療預后的指標具有重要意義。
TBAD的發病機制尚不明確,但主動脈破口處血管內膜的暴露,可釋放血管內皮細胞相關因子,激活外源性凝血級聯反應,纖溶系統被激活,導致纖溶酶原激活物和纖溶酶的活性增高[6]。因而纖溶系統的激活參與TBAD的發生、發展過程。D-D是纖溶酶降解生成的一種特異性產物,可直接反映機體纖溶活性和凝血功能。此外,免疫炎癥細胞的浸潤,可導致中層破壞、動脈狹窄與閉塞等,可誘發TBAD[7]。IL-1β可促使中性粒細胞產生大量炎癥介質,導致炎癥瀑布效應,引起主動脈損傷及血管壁薄弱,易于管壁薄弱處形成瘤樣擴張或出現撕裂。由此推測,血清D-D、IL-1β水平可能與TBAD患者接受EVAR治療預后有一定聯系。
本研究結果顯示,預后不良組術前血清D-D、IL-1β水平高于預后良好組,進一步經logistic回歸分析發現,術前血清D-D、IL-1β過表達與TBAD患者接受EVAR治療預后不良有關,證實術前血清D-D、IL-1β過表達與TBAD患者接受EVAR治療預后存在一定的聯系。分析其原因可能是,血清D-D過表達提示外源性凝血途徑被激活,凝血相關物質被大量消耗,繼發性纖溶系統的激活導致凝血/纖溶系統失衡,大量微血栓形成,可引起肺部毛細血管堵塞,降低肺部有效循環血液量,可導致TBAD患者接受EVAR術后低氧血癥的發生,損傷其他器官功能,導致預后不良[8]。IL-1β過表達提示細胞應激活動(如炎癥、氧化應激)可破壞主動脈壁彈性和平滑肌,促使中層組織壞死,引起主動脈壁硬化,血管壁壓力增加,加重病情,進而增加預后不良的風險[9]。同時炎癥因子的釋放可刺激血管活性物質的釋放,導致血栓形成,增加動脈粥樣硬化斑塊破裂的風險,導致患者預后不良[10]。
綜上所述,血清D-D、IL-1β過表達與TBAD患者接受EVAR治療預后有關,血清D-D、IL-1β過表達可提示TBAD患者接受EVAR治療預后不良風險較高,未來臨床可考慮監測血清D-D、IL-1β水平,可能對評估TBAD患者接受EVAR治療預后有一定作用。

