血清脂蛋白相關磷脂酶A2及可溶性凝集素樣氧化型低密度脂蛋白受體-1與急性心肌梗死患者Gensini積分的相關性
李帥,榮守華
(1.焦作市人民醫院 檢驗科,河南 焦作 454000;2.鄭州大學第三附屬醫院 檢驗科,河南 鄭州 450000)
急性心肌梗死(acute myocardial infarction,AMI)屬于臨床常見病,其病理基礎為冠狀動脈粥樣硬化斑塊破潰引發完全或者不完全的閉塞性血栓,繼而引起心肌缺血性壞死臨床綜合征,分為急性ST段抬高型心肌梗死(acute ST segment elevated myocardial infarction,ASTEMI)、急性非ST段抬高型心肌梗死(acute non-ST segment elevation myocardial infarction,ANSTEMI)[1]。AMI的發病機制為炎癥反應及血脂代謝紊亂[2]。脂蛋白相關磷脂酶A2(lipoprotein-related phospholipase A2,Lp-PLA2)屬于新型炎癥標志物,具備較強的血管炎癥特異性。有研究顯示,Lp-PLA2屬于動脈粥樣硬化性病變的危險因素[3]。可溶性凝集素樣氧化型低密度脂蛋白受體-1(soluble lectin-like oxidized low-density lipoprotein receptor-l,sLOX-1)水平升高可誘發氧化應激反應,加重高脂血癥對血管內皮細胞的損傷,促進惡性心血管結局[4]。目前臨床關于Lp-PLA2、sLOX-1和AMI冠狀動脈病變程度的相關研究較少。鑒于此,本研究選取117例AMI患者作為研究對象,旨在分析血清Lp-PLA2、sLOX-1水平變化與Gensini積分的關聯性,現報告如下。
1 資料和方法
1.1 一般資料選取2020年3月至2021年7月焦作市人民醫院收治的117例AMI患者作為研究組,另選同期126名健康體檢者作為對照組。研究組:男55例,女62例;年齡45~73歲,平均(58.93±6.75)歲;體質量指數19.1~24.3 kg·m-2,平均(22.68±1.29)kg·m-2;ASTEMI 70例,ANSTEMI 47例。對照組:男60例,女66例;年齡46~72歲,平均(59.10±6.32)歲;體質量指數18.2~24.9 kg·m-2,平均(22.54±1.10)kg·m-2。兩組性別、年齡、體質量指數比較,差異無統計學意義(P>0.05)。
1.2 選取標準(1)納入標準:①接受冠狀動脈造影檢查;②通過心電圖、體格檢查、超聲心動圖、心肌壞死標志物等診斷為AMI;③自愿參與本研究,并簽署知情同意書。(2)排除標準:①惡性腫瘤;②合并腎、肝等器官功能嚴重不全;③合并免疫系統疾病;④伴血液系統疾病;⑤合并心肌病以及心臟瓣膜病;⑥近期存在急性與慢性感染性疾病;⑦妊娠期、哺乳期女性。
1.3 檢測方法收集全部研究對象清晨空腹靜脈血6 mL,以3 500 r·min-1離心速率離心10 min,離心半徑12 cm,離心結束后取上清液,存于-80 ℃冰箱內待測。采用酶動力學方式測血清Lp-PLA2水平,試劑盒購自南京諾爾曼生物技術有限公司;采用酶聯免疫吸附試驗檢測血清sLOX-1水平,試劑盒購自上海滬尚生物技術有限公司。上述操作步驟均依據試劑盒說明書實施。
1.4 觀察指標(1)血清Lp-PLA2、sLOX-1水平。(2)不同冠狀動脈病變支數患者血清Lp-PLA2、sLOX-1水平。(3)不同Gensini積分患者血清Lp-PLA2、sLOX-1水平。Gensini積分評價標準[5]:Gensini積分是冠狀動脈狹窄度積分和病變部位積分的總和。①狹窄程度積分:狹窄度<25%為1分,狹窄程度25%~50%為2分,狹窄程度51%~75%為 4分,狹窄程度76%~90%為8分,狹窄程度91%~99%為16分,狹窄程度100%為32分。②病變部位積分為單處病變×不同系數。左主干:得分×5。回旋支開口處:得分×3.5。前降支中段:得分×1.5。主動脈和第一對角支:得分×1.0。回旋支遠端:得分×1.0。左側支:得分×0.5。其余分支:得分×1.0。Gensini積分≤30分為輕度,31~60分為中度,>60分為重度。(4)血清Lp-PLA2、sLOX-1水平與Gensini積分的相關性。
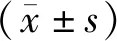
2 結果
2.1 血清Lp-PLA2、sLOX-1水平研究組血清Lp-PLA2、sLOX-1水平高于對照組(P<0.05)。見表1。

表1 兩組血清Lp-PLA2、sLOX-1水平比較
2.2 不同冠狀動脈病變支數患者血清Lp-PLA2、sLOX-1水平隨著冠狀動脈病變支數的增加,Lp-PLA2、sLOX-1水平持續升高,單支病變患者血清Lp-PLA2、sLOX-1水平低于雙支、多支病變患者,雙支病變患者血清Lp-PLA2、sLOX-1水平低于多支病變患者(P<0.05)。見表2。

表2 不同冠狀動脈病變支數患者血清Lp-PLA2、sLOX-1水平比較
2.3 不同Gensini積分患者血清Lp-PLA2、sLOX-1水平隨著Gensini積分的升高,血清Lp-PLA2、sLOX-1水平持續升高,輕度患者血清Lp-PLA2、sLOX-1水平低于中度及重度患者,中度患者血清Lp-PLA2、sLOX-1水平低于重度患者(P<0.05)。見表3。

表3 不同Gensini積分患者血清Lp-PLA2、sLOX-1水平比較
2.4 血清Lp-PLA2、sLOX-1水平與Gensini積分相關性經Pearson分析顯示,血清Lp-PLA2、sLOX-1水平與Gensini積分呈正相關(r=0.506、0.457,P<0.001)。
3 討論
動脈粥樣硬化屬于血管壁慢性炎癥性病變,炎癥在其發生和發展中發揮重要作用,貫穿血管內皮損傷、斑塊形成至破裂以及血栓形成過程,在多個危險因素刺激下,動脈內膜增厚形成泡沫細胞,產生動脈粥樣硬化斑塊,而斑塊凸入管腔內引起狹窄,在急性應激下會出現斑塊破裂,從而引起急性臨床事件[6]。AMI的根本原因是動脈粥樣硬化斑塊,該病病情兇險,病死率高,并發癥較多。盡早評估AMI病情嚴重程度與預后具有積極意義。
Lp-PLA2由441個氨基端殘基組成,是參加脂蛋白代謝與炎癥通路的磷脂酶,主要由巨噬細胞與單核細胞等炎癥細胞分泌,而單核細胞與巨噬細胞均為動脈粥樣斑塊形成的重要炎癥細胞,此外Lp-PLA2可促進低密度脂蛋白(low density lipoprotein,LDL)氧化與酶解,加快巨噬細胞分泌炎癥細胞因子,還能氧化自由脂肪酸,促進易損斑塊形成與繼發性血栓形成[7]。本研究結果顯示,研究組血清Lp-PLA2水平高于對照組,且冠狀動脈病變支數增加、Gensini積分升高,其水平持續升高,說明AMI患者體內Lp-PLA2水平呈高表達狀態,且隨病情加劇,其水平持續升高。經Pearson分析結果指出,血清Lp-PLA2水平與Gensini積分呈正相關,進一步說明血清Lp-PLA2水平可以作為早期評估病情的指標。
LOX-1為Ⅱ型單鏈跨膜蛋白,屬于C型選擇素家族,是氧化型低密度脂蛋白特異性受體,在內皮細胞、單核細胞、平滑肌細胞、動脈粥樣硬化斑塊及血小板中表達,可結合、吞并、降解氧化型低密度脂蛋白。此外LOX-1能被血管緊張素Ⅱ、血液流變壓力、各類炎癥因子及C反應蛋白等激活,并可激活下游P38MAPK、PKB及NF-κB等信號通路,引發斑塊局部內皮細胞功能失調、巨噬細胞脂質堆積、斑塊局部血管平滑肌細胞凋亡以及斑塊細胞外基質增加,以上病理過程與粥樣硬化斑塊產生、進展及破裂相關[8]。LOX-1可被蛋白酶水解成可溶性sLOX-1,故sLOX-1可作為評估AMI病情及預后的生物學標志物。本研究結果發現,研究組血清sLOX-1水平高于對照組,且隨冠狀動脈病變支數增加、Gensini積分升高其水平持續增加。此外,Pearson分析結果顯示,sLOX-1血清水平與Gensini積分呈正相關,說明AMI患者體內sLOX-1水平呈高表達狀態,且其水平隨病情加重而升高,可作為臨床評估病情的指標。
綜上,AMI患者體內血清Lp-PLA2、sLOX-1水平呈高表達狀態,且隨冠狀動脈病變支數增多以及Gensini積分升高而升高,可作為臨床評估病情的首選指標。但本研究不足之處在于未對二者的相關性進行分析,下一步研究可將此作為重點。

