2種鹽酸二甲雙胍緩釋片在中國健康受試者空腹單次口服給藥條件下的生物等效性和安全性
孫明利,漆 璐,羅向東,劉慧娟,王 瑜,張 薇,王興河
(1.首都醫科大學附屬北京世紀壇醫院,藥物Ⅰ期臨床試驗研究室,北京 100038;2.廣東賽康藥業有限公司研發部,廣東 廣州 510070)
二甲雙胍是一種雙胍類降糖藥,主要用于>10歲的2型糖尿病患者的血糖控制[1-2],是糖尿病治療指南推薦的一線治療藥物[3-4]。二甲雙胍普通片有血藥濃度波動大、服藥次數多和用藥依從性差等缺點,緩釋片則可克服以上缺點[5]。2型糖尿病發病率高[6-8],二甲雙胍緩釋片市場需求大,目前我國上市的鹽酸二甲雙胍緩釋片仿制藥有22種,由不同廠商研制。元唐(每片500 mg)是廣東賽康制藥公司為滿足市場需求研發的仿制新藥。本研究旨在比較元唐與英國Merck Serono Limited生產的原研藥格華止緩釋片在健康受試者中空腹單次口服給藥條件下的生物等效性和安全性。
1 受試者、材料與方法
1.1 受試者
本研究由首都醫科大學附屬北京世紀壇醫院藥物Ⅰ期臨床試驗研究室完成,獲得北京世紀壇醫院倫理委員會批準(批件號2017Y123)。受試者均自愿簽署知情同意書。
入選標準:年齡>18歲的中國健康受試者,男性體重>50 kg,女性體重>45 kg,身體質量指數在19.0~28.0 kg·m-2。排除標準:有嚴重疾病史、有煙酒嗜好和藥物濫用史、有二甲雙胍及其輔料成分過敏史,生命體征、心電圖、體格檢查、實驗室檢查結果異常有臨床意義,傳染性疾病血清學檢查結果陽性。
按照入選和排除標準,入組36例健康受試者,男性23例(63.9%,23/36),年齡(29.0±9.2)歲,漢族31例(86.1%,31/36),體重(65.3±9.3)kg,身高(166.3±7.9)cm,身體質量指數(23.6±2.4)kg·m-2。
試驗中有1例受試者因個人原因在服用試驗藥物前退出試驗,不納入安全分析集和藥動學分析集;1例受試者在第一周期服用參比制劑后因發生不良事件退出試驗,納入安全分析集,而不納入藥動學分析集。故安全性分析集共35例受試者,藥動學分析集34例。
1.2 藥物和儀器
受試制劑為廣東賽康制藥廠有限公司生產的元唐,為仿制鹽酸二甲雙胍緩釋片,規格每片500 mg,批號1171115010,二甲雙胍純度96.5%;參比制劑為英國Merck Serono Limited生產的鹽酸二甲雙胍緩釋片(格華止緩釋片Glucophage XR),規格每片500 mg,批號Y02494,二甲雙胍純度98.9%。
高效液相色譜儀,包括液相泵(LC-20ADXR)、柱溫箱(CTO-20AC)、控制器(CBM-20Alite)、脫氣機(DGU-20A5R)和自動進樣器(SIL-30AC),日本島津公司;質譜檢測器(API 4000)和電噴霧離子化離子源,美國Applied Biosystems/Sciex公司;色譜柱Poroshell 120 EC-CN(2.1 mm×50 mm,2.7 μm),美國Agilent公司;預柱Security Guard Cartridges C18(4.0 mm×2.0 mm),美國Phenomenex公司;離心機(Heraeus Muitifuge X1R),美國ThermoFisher公司;天平(CPA225D和MSA6.6S-OCE-DM),德國Sartorius公司;振蕩器(QB-9001),美國QILINBEIER公司;振蕩器(LPD 2500),萊普特科學儀器(北京)有限公司;振蕩器(MIX-1500),杭州米歐儀器有限公司(MIULAB公司);純水儀(Milli-Q),美國Merck公司;數據采集軟件(Analyst 1.6.2和Analyst 1.6.3),美國Applied Biosystems/Sciex公司;數據處理軟件(Microsoft Office 2007和2013),美國微軟公司。
1.3 給藥和血漿樣品采集
試驗為單中心、開放、隨機、單劑量、兩周期、兩序列、雙交叉設計,在空腹狀態下進行生物等效性試驗。36例入選受試者隨機分成2組,每組分別給藥前隔夜空腹至少10 h,給藥日早晨空腹狀態下,用240 mL溫水分別送服500 mg受試制劑或參比制劑,7 d清洗期后,進行第2周期交叉給藥。每周期給藥0 h(給藥前30 min內)和給藥后第1,2,3,4,4.5,5,5.5,6,6.5,7,7.5,8,9,10,12,15,24 和36 h靜脈采血4 mL至含K2-EDTA抗凝劑的真空采血管中,離心后血漿樣品分為待測樣品和備份樣品。分裝結束后1.0 h內將血漿樣品置于-20℃冰箱中暫存,72 h內移至-70℃冰箱中長期儲存。
1.4 血藥濃度測定和血漿樣品處理
二甲雙胍血藥濃度由南京科利泰醫藥科技有限公司采用已建立的液相色譜-串聯質譜法檢測[9-10]。色譜條件:色譜柱Poroshell 120 EC-CN(2.1 mm×50 mm,2.7 μm);流動相:A 為含 0.1% 甲酸的5.0 mmol·L-1醋酸銨的水溶液,B為乙腈;流速:0.4 mL·min-1;梯度洗脫程序(0.0~1.9 min,10%A;1.9~2.0 min,10%A→50%A;2.0~3.0 min,50%A;3.0~3.1 min,50%A→10%A;3.1~5.0 min,10%A);進樣體積6.0 μL;柱溫40℃;自動進樣器溫度8℃;運行時間:5.00 min。
質譜條件:離子噴霧電壓1700 V;氣簾氣310 kPa;霧化氣 379 kPa;輔助氣 379 kPa;源溫650℃;碰撞氣10 Unit,碰撞激發裂解;電噴霧離子化,正離子模式,多反應監測模式;二甲雙胍和內標二甲雙胍-d6碰撞電壓分別為29和20 V,定量離子對(m/z)分別為 130.1/71.1和136.1/60.1。
血漿樣品處理:向96孔板中加入待測樣品50.0 μL和內標工作溶液30.0 μL(終濃度80.0 μg·L-1),充分振搖3 min后加入乙腈450 μL,再劇烈振搖10 min后,25℃,4000×g離心10 min,取上清液30.0 μL至干凈96孔板中,用90%乙腈水溶液570 μL稀釋,將96孔板密封,充分振搖10 min后進行液相色譜-串聯質譜分析。
1.5 藥物安全性評價
藥物安全性評價指標包括不良事件、嚴重不良事件、伴隨用藥、臨床癥狀、實驗室檢查、生命體征測定、心電圖和體格檢查等結果異常且有臨床意義。通過比較2種藥物的安全性指標是否有差異,判斷受試制劑的安全性。
1.6 藥動學和統計學分析
由北京大學臨床研究所進行統計學分析。設定最大血藥濃度(Cmax)、藥時曲線下面積(AUC0→t和AUC0→∞)為主要檢測參數,采用Phoenix WinNonlin 7.0(Certara,US)軟件中非房室模型計算各受試者的藥動學參數,繪制平均血藥濃度-時間曲線,將主要指標經對數轉換后進行方差分析;其他統計學分析采用SAS 9.4軟件(SAS INSTITUTE INC,US)進行。計量資料:非正態分布的數值用中位數(最小值,最大值)表示,采用Wilcoxon秩和檢驗;正態分布的數值用±s表示,差異分析采用t檢驗。計數資料:以例數和百分數(n,%)表示,兩組間比較采用χ2檢驗,如期望值<5,則采用Fisher精確檢驗。藥動學主要參數指標的幾何均值受試制劑/參比制劑90%置信區間在等效區間(80.0%~125.0%)之內,則判定2種制劑生物等效。
2 結果
2.1 藥物分析方法驗證
專屬性:二甲雙胍和內標保留時間的變異系數(CV)均≤2.1%,二者峰面積比的CV≤7.8%。6個不同個體來源的血漿基質對二甲雙胍或內標的測定不存在干擾,且二甲雙胍和內標之間也不存在相互干擾(圖1)。
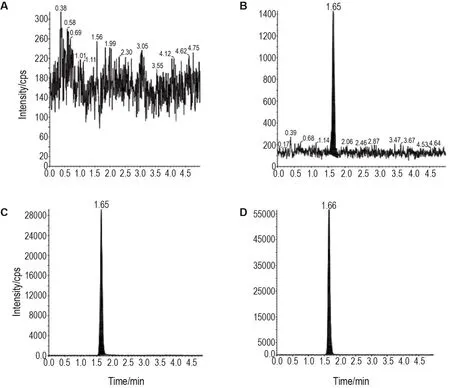
Fig.1 Representative chromatograms of metformin in human plasma.A:blank plasma;B:blank plasma spiked with a lower limit of quantitation of metformin(3.00 μg·L-1);C:blank plasma spiked with the intern standard metformin-d6(80.00 μg·L-1);D:a real sample at 7.5 h after oral administration of the test preparation Yuantang.Ion-pairs(m/z)used to test metformin and metformin-d6 were 130.1/71.1 and 136.1/60.1,respectively.
標準曲線和定量下限:以待測物(二甲雙胍)與內標(二甲雙胍-d6)的色譜峰面積的比值為縱坐標(y),以血漿中待測物的質量濃度為橫坐標(x),用加權(1/x2)最小二乘法進行線性回歸運算,二甲雙胍回歸方程為y=0.0171x-0.0016(r=0.9991)。結果表明,二甲雙胍血藥濃度在3.00~1200.00 μg·L-1線性關系好,定量下限為3.00 μg·L-1。
準確度、精密度和回收率:制備4個濃度的二甲雙胍質控樣品(3.00,8.00,300.00和900.00 μg·L-1),每濃度6個平行樣品,評估批內準確度和精密度;通過3批質控樣品(每批包括以上4個濃度,每濃度6個平行樣品)評估批間準確度和精密度。結果表明,質控樣品批內和批間準確度(RE)和精密度(RSD)均<15%。通過比較單個質控樣品中待測物或內標響應值與空白血漿提取后加入待測物、內標的響應值,評價回收率。各濃度樣品回收率的(CV)均<15.0%(表1)。
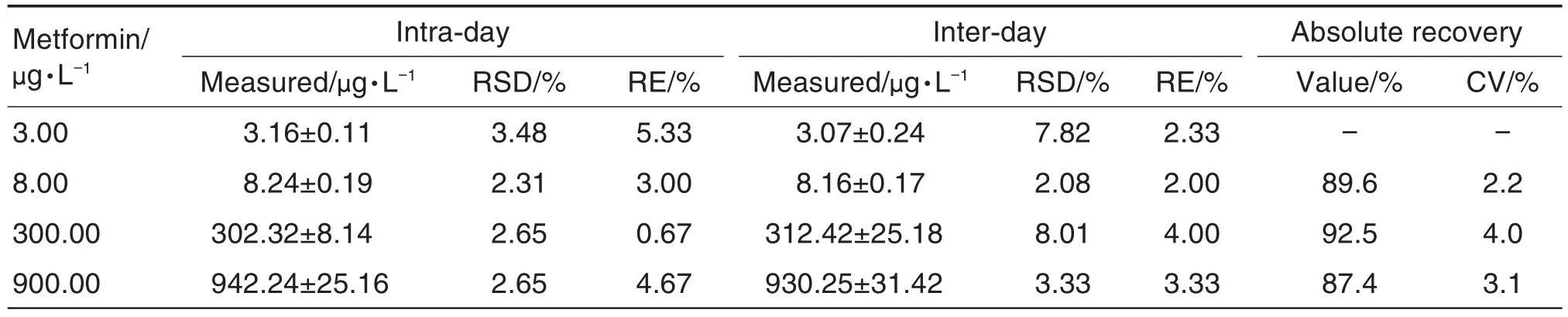
Tab.1 Precision and recovery of metformin in plasma
基質效應:6個不同來源的空白基質加入待測物和內標,二甲雙胍8.00,300.00和900.00 μg·L-1濃度組內標歸一化的基質因子分別為74.7±3.2,74.5±2.0和78.8±1.4,CV分別為4.3%,2.7%和1.8%,均<15%,表明基質效應不影響血漿中二甲雙胍的準確定量,符合生物樣品分析要求。
穩定性:通過比較儲備液和質控樣品經過放置或低溫多次凍融后與新鮮配制的對照樣品峰面積和內標峰面積比值來考察樣品的穩定性(n=6)。與對照樣品與內標峰面積的比值相比,待測樣品與內標峰面積比值的標準偏差應<±10.0%,且每份待測樣品與內標峰面積比值的CV≤10.0%,視為穩定性良好。結果表明,二甲雙胍儲備液和待測溶液的短期(室溫,17.0 h)和長期(-20℃,34.96 d)穩定性、質控樣品-20℃和-70℃經過5個凍融循環的凍融穩定性良好,標準偏差和CV均<10.0%。
2.2 中國健康受試者空腹單次口服2種鹽酸二甲雙胍緩釋片藥動學特征
由圖2和表2可見,受試制劑和參比制劑的血藥濃度-時間曲線重合度好,提示二者的藥動學特征相似度高。受試者空腹單次口服受試制劑和參比制劑后,血漿中二甲雙胍濃度逐漸升高,兩者的血藥濃度達峰時間(Tmax)、Cmax、AUC0→t、AUC0→∞、消除半衰期t1/2和末段消除速率常數λz均無顯著差異。
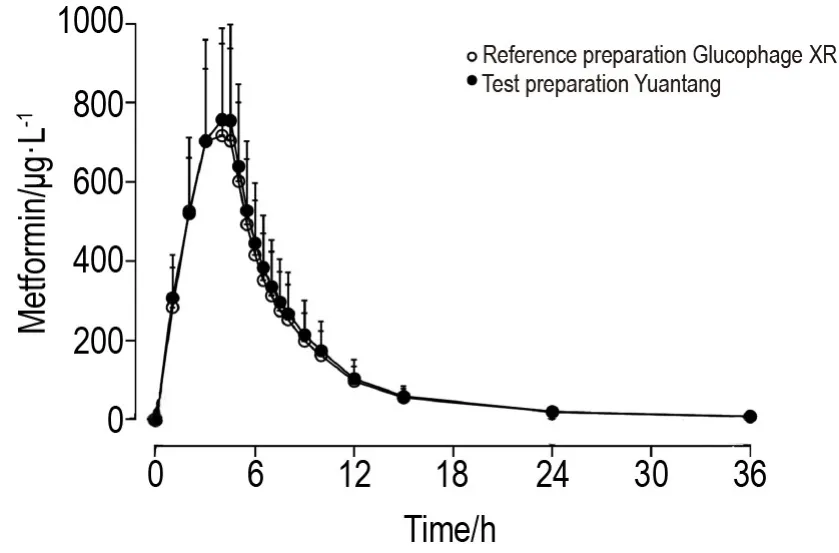
Fig.2 Mean plasma concentration-time curves of test preparation Yuantang and reference preparation Glucophage XR after single oral dose of 500 mg in 34 Chinese healthy subjects under the fasting state.A randomized,open,two-period,two cross-over trial was conducted in healthy subjects under the conditions of fasting and single oral administration(500 mg).After the first oral administration and the 7 d washout period,the second period of cross administration was conducted.±s,n=34.
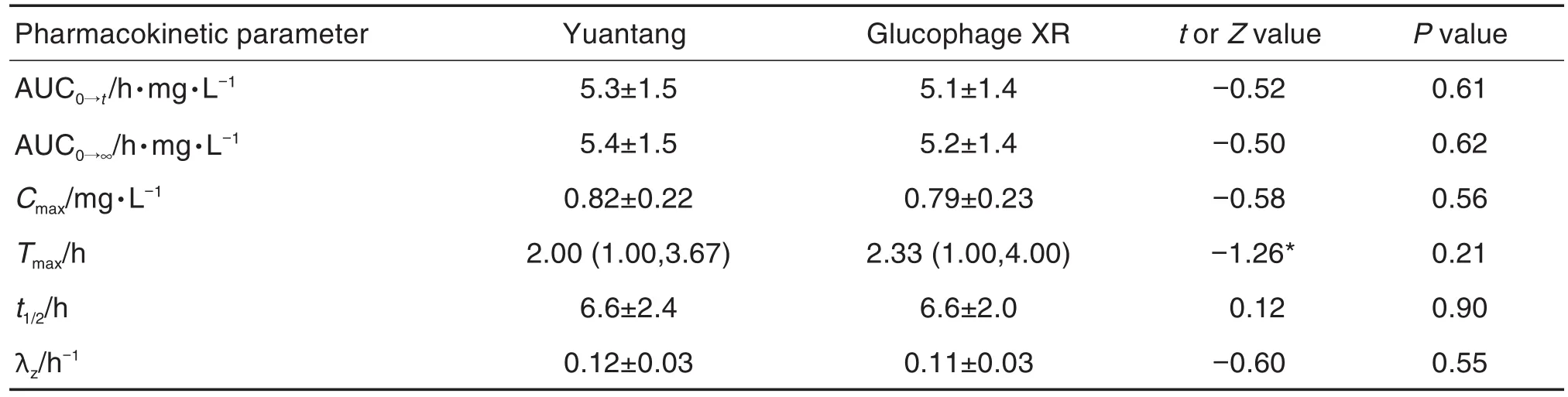
Tab.2 Comparison of arithmetic mean values of two kinds of metformin hydrochloride sustained-release tablets after single oral administration under fasting conditions in Chinese healthy volunteers
由表3可見,在中國健康受試者空腹條件下單次口服受試制劑(500 mg)或參比制劑(500 mg)后,Cmax,AUC0→t和 AUC0→∞幾何均值分別為 0.79和0.76 mg·L-1,5.1和5.0 h·mg·L-1,5.2和5.0 h·mg·L-1;二者比值的90%置信區間分別為96.3%~113.7%,96.2%~110.8%和96.3%~110.4%,均在80.0%~125.0%的生物等效性區間內,表明本研究的受試制劑和參比制劑在空腹給藥條件下具有生物等效性。
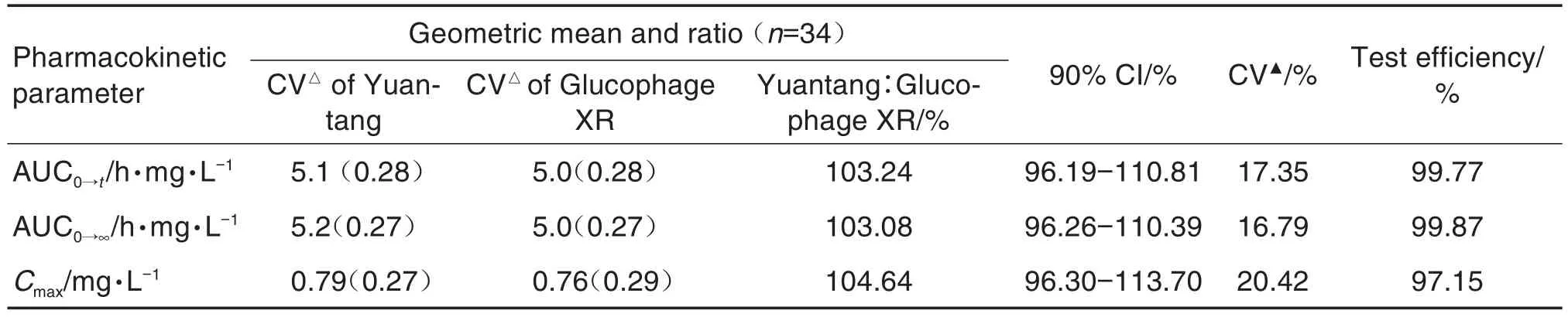
Tab.3 Geometric mean values of pharmacokinetic parameters and bioequivalence evaluation of two types of metformin hydrochloride sustained release tablets after single oral administration under fasting conditions in Chinese healthy volunteers
用Phoenix WinNonlin 7.0分別對受試制劑和參比制劑的給藥序列、給藥周期和不同制劑對Cmax,AUC0→t和AUC0→∞(取自然對數)的影響進行方差分析。結果表明,上述 3 因素對 lnCmax,lnAUC0→t和lnAUC0→∞無顯著影響(表4)。
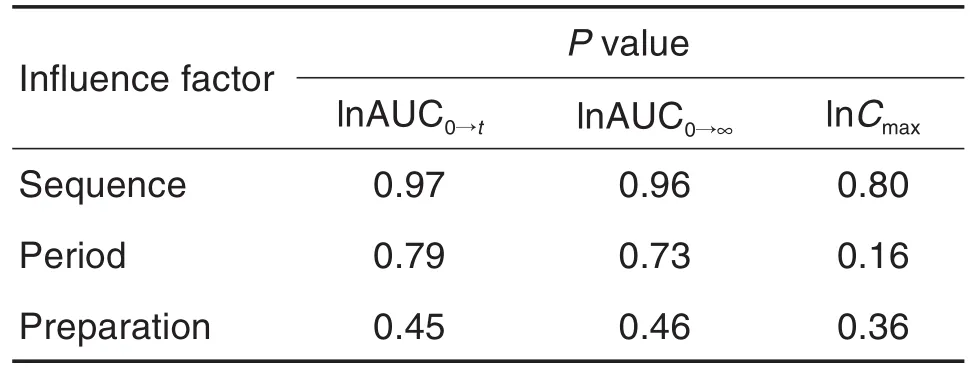
Tab.4 Results of ANOVA test on bioequivalence of two types of metformin hydrochloride sustained release tablets after single oral administration under fasting conditions in Chinese healthy volunteers
2.3 安全性分析
試驗過程中無非預期不良事件和嚴重不良事件發生。在各自服用周期內,受試制劑有8例受試者(22.9%,8/35)發生10例次不良反應,參比制劑有10例(28.6%,10/35)發生15例次不良反應,兩者無統計學差異(χ2=0.30,P=0.58);服用受試制劑的受試者中發生6例次消化道反應、4例次實驗室檢查異常有臨床意義,服用參比制劑的受試者中發生5例次消化道反應、9例次實驗室檢查結果異常有臨床意義、1例次上呼吸道感染,不良反應無統計學差異(Fisher檢驗,P=0.51)(表5)。1例受試者在服用參比制劑后發生1次Ⅱ級中度不良反應(上呼吸道感染),其余不良反應均為Ⅰ級輕度(表5),2種制劑不良反應嚴重程度無統計學差異(Fisher檢驗,P>0.99)。1例次不良反應轉歸為“未知”(受試者失訪),其余均為“痊愈”,2種制劑發生不良反應轉歸無統計學差異(Fisher檢驗,P>0.99)。
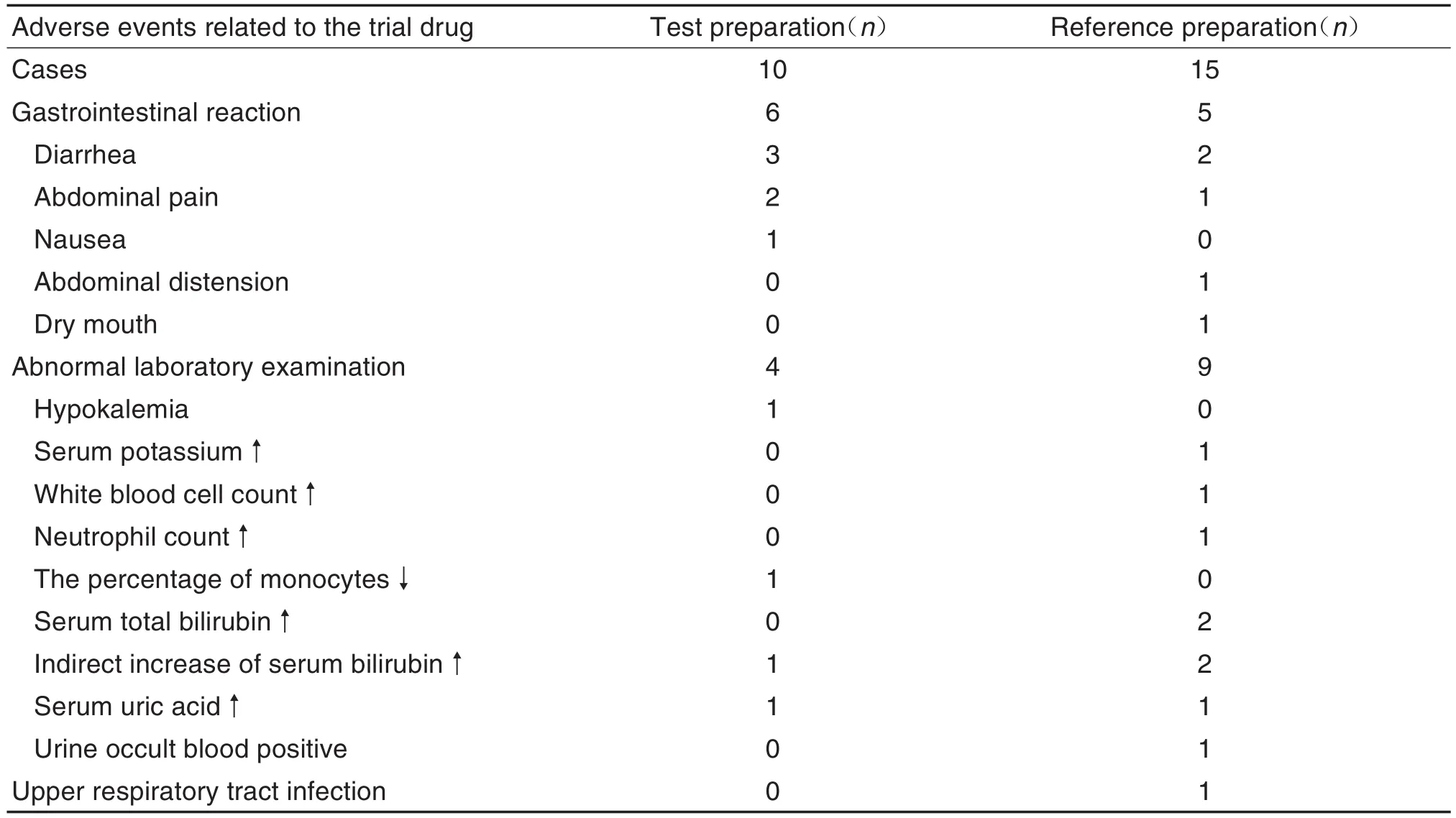
Tab.5 Comparison of adverse reactions of two kinds of metformin hydrochloride sustained release tablets in Chinese healthy volunteers after single oral administration under fasting conditions
3 討論
Zhou等[12]研究2種鹽酸二甲雙胍緩釋片在健康受試者餐后單次給藥條件下生物等效。本研究采用液相色譜-串聯質譜法[11]測定健康受試者空腹單次口服給藥條件下二甲雙胍血漿藥物濃度,采用Cmax,AUC0→t和 AUC0→∞作為藥動學評價的主要指標,評價2種制劑的生物等效性。結果表明,2種制劑在健康受試者空腹單次口服給藥條件下生物等效,進一步豐富了國產仿制藥的生物等效資料,為國內2型糖尿病治療提供更多的選擇和參考。
二甲雙胍在臨床上已有60多年的用藥史,良好的安全性已成共識[13-14]。本研究結果亦表明,受試制劑和參比制劑不良反應輕,主要為消化道反應和實驗室檢查異常,且均可自愈。2種制劑在試驗期間均無非預期不良事件和嚴重不良事件發生,不良反應發生率、類型、嚴重程度和轉歸無統計學差異,且安全性均好,與本課題組前期報道結果一致[15]。
綜上,本研究中受試制劑元唐和參比制劑格華止在健康受試者空腹單次口服給藥條件下生物等效,安全性良好。

