多囊卵巢綜合征患者血清性激素水平與胰島素釋放峰值后移的相關性研究
林延潤,邱偉全,彭學博,朱 琳,楊發達,陳躍瑜
(1.佛山市南海區婦幼保健院a.檢驗科;b.生殖健康科 ,廣東佛山 528200; 2.廣東省中西醫結合醫院公衛科, 廣東佛山 528200)
多囊卵巢綜合征(polycystic ovary syndrome, PCOS)是生殖健康科常見的內分泌和代謝異常性疾病,在育齡女性中疾病發生率約10%[1,2]。由PCOS引發的糖代謝異常問題越來越受關注,無論是妊娠期糖耐量受損,還是生育后的慢性2 型糖尿病,都會對患者的妊娠結局和生育后的生活造成影響[3]。糖代謝異常的發生與PCOS 患者胰島β 細胞功能損傷有關,胰島β 細胞功能損傷早期表現為胰島素釋放峰值后移,抑制胰島素釋放峰值的后移就有可能延緩胰島β 細胞功能減退,甚至逆轉胰島β 細胞功能衰竭的發生,但目前胰島素釋放峰值后移的機制未明[4]。本課題著眼研究PCOS 患者,探討PCOS 患者血清性激素水平與胰島素釋放峰值后移的關系。
1 材料與方法
1.1 研究對象 選取2019年11月~2021年1月在佛山市南海區婦幼保健院生殖健康科就診的PCOS 患者120 例。PCOS 診斷參照2003年鹿特丹國際會議制定的標準:①B 超提示卵巢多囊;②臨床和(或)生化有高雄激素表現;③稀發排卵或不排卵;符合上述3 項中的任意2 項者并排除先天性腎上腺皮質增生、分泌雄激素的腫瘤、高泌乳素血癥等疾病。研究對象納入標準:①符合上述PCOS 診斷標準的患者;②臨床研究資料完整。排除標準:①并發甲狀腺疾病;②有嚴重營養不良、肝腎等原發性疾病;③近3 個月內接受過改善胰島素抵抗藥物治療,或者已接受降糖藥物或激素治療的患者。一般臨床資料后移組年齡、身高和體重分別為28.67±4.33 歲,155.78±4.49cm和56.04±9.36kg;無 后 移 組 為28.08±3.14 歲,157.21±4.76cm 和52.74±9.50 kg。兩組研究對象上述一般臨床資料差異無統計學意義(P>0.05)。本課題立項經佛山市南海區婦幼保健院倫理委員會批準。
1.2 儀器與試劑 胰島素釋放試驗(insulin release test, IRT)和血清性激素檢測均采用免疫發光法,檢測儀器為羅氏E601,配套使用專機專用檢測試劑及質控品。
1.3 方法 符合納入標準的研究對象月經第三天行IRT 和性激素六項檢測。IRT 包括空腹血漿胰島素以及服用糖水后30, 60, 120 和180 min 血漿胰島素結果, 性激素六項包括雌二醇(estradiol, E2)、孕酮(progesterone, PG),黃體生成素(luteinizing hormone, LH),卵泡刺激素(follicle stimulating hormone, FSH)、泌乳素(polactin, PRL)和睪酮(testosterone, T)。根據IRT 結果進行分組,峰值時間在30 min 或者60 min,納入無峰值后移組(n=60),峰值時間在120 min 或者180 min,納入峰值后移組(n=60)。收集兩組患者的年齡、身高、體重和性激素六項結果。
1.4 統計學分析 采用SPSS 21.0 進行數據的分析處理,臨床資料和性激素六項結果先行Kolmogorov-Smirnov 檢驗。臨床資料年齡、身高、體重符合正態分布(P>0.05),血清E2,LH,FSH,PRL,T 符合正態分布(P>0.05),以均數±標準差(x±s)表示,組間比較采用t檢驗;血清PG 不符合正態分布(P<0.05),采用中位數(四分位間距)[M(P25,P75)]表示,組間比較采用 Wilcoxon 秩和檢驗。相關性分析采用雙變量相關Pearson 分析,P<0.05 為差異有統計學意義。
2 結果
2.1 兩組性激素六項結果比較 見表1。后移組血清LH 和FSH 高于無后移組,血清E2 低于無后移組。峰值后移組血清LH,FSH 和E2 分別為10.64±6.22IU/L,7.79±2.01IU/L 和159.75±51.38ng/L,無后移組分別為8.23±4.85IU/L,7.10±1.63IU/L和185.87±78.46IU/L,這三者組間差異均具有統計學意義(均P<0.05)。而血清PG,PRL 和T 水平與無后移組比較,差異無統計學意義(均P>0.05)。
表1 兩組性激素六項結果比較[±s,M(P25 ,P75 )]
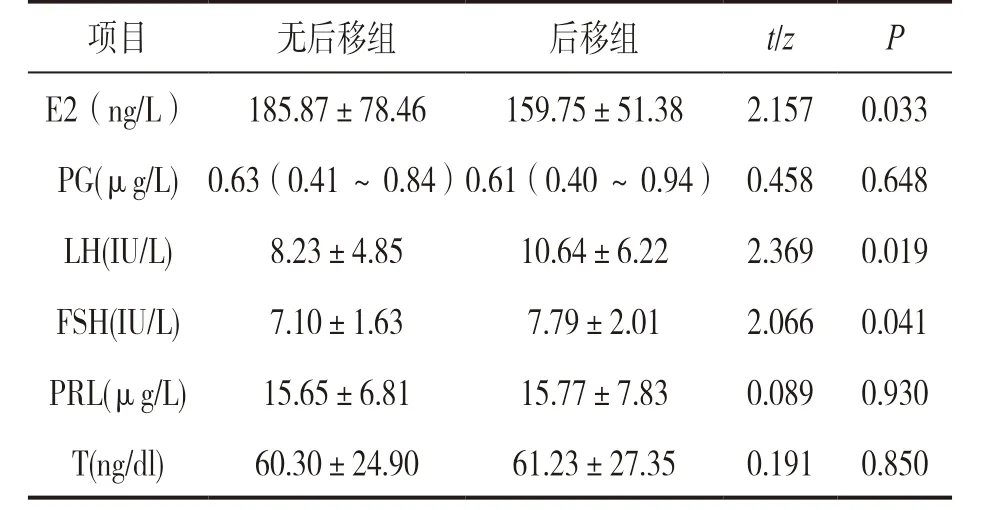
表1 兩組性激素六項結果比較[±s,M(P25 ,P75 )]
項目 無后移組 后移組 t/z P E2(ng/L) 185.87±78.46 159.75±51.38 2.157 0.033 PG(μg/L) 0.63(0.41 ~0.84)0.61(0.40 ~0.94) 0.458 0.648 LH(IU/L) 8.23±4.85 10.64±6.22 2.369 0.019 FSH(IU/L) 7.10±1.63 7.79±2.01 2.066 0.041 PRL(μg/L) 15.65±6.81 15.77±7.83 0.089 0.930 T(ng/dl) 60.30±24.90 61.23±27.35 0.191 0.850
2.2 性激素六項與胰島素峰值后移的相關性分析 見表2。將胰島素峰值后移定義為1,無胰島素峰值后移定義為0,采用雙變量相關Pearson 分析,血清PG,PRL,T 與胰島素釋放峰值后移無相關性(r=-0.042,0.008,0.018, 均P>0.05); 而LH 和FSH 與胰島素峰值后移呈顯著正相關(r=0.213,0.187,均P<0.05),E2 與胰島素峰值后移呈顯著負相關(r=-0.195,P<0.05)。
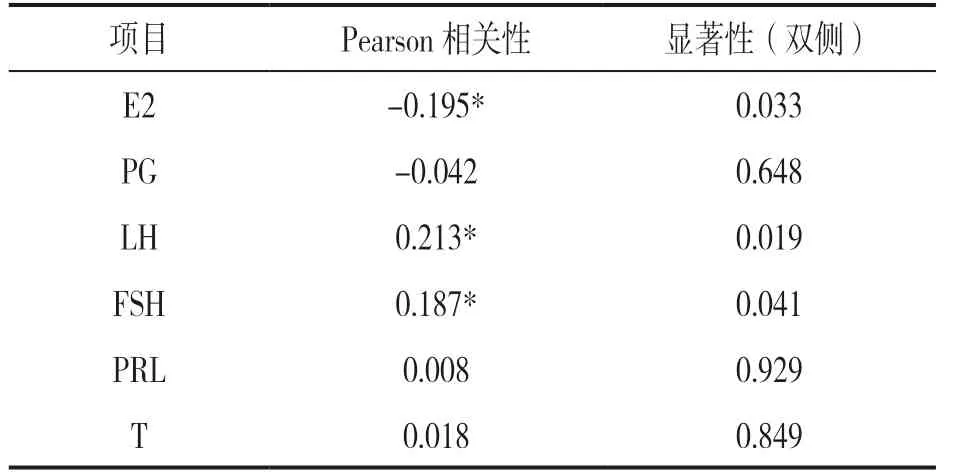
表2 性激素六項與胰島素峰值后移的相關性分析(n=120)
3 討論
既往關于PCOS 的研究大多集中在解決患者育齡期的生育問題,但PCOS 患者糖代謝異常的并發癥也不應忽視。研究表明PCOS 患者妊娠糖尿病發病率高于非PCOS 患者,2 型糖尿病發病率也明顯高于普通人群[5-6],PCOS 患者糖代謝異常發生與胰島β 細胞功能損傷有關,胰島素峰值后移是胰島素功能損傷的早期表現[4,7]。胰島β 細胞的損傷其實從可以檢測到血糖變化之前就已經出現了,表現為胰島素釋放動力學障礙,其主要特征是機體在葡萄糖刺激下,胰島素釋放第一時相下降甚至喪失,第二時相胰島素代償性升高,這個過程即為峰值后移。峰值后移的后果是第一時相胰島素反應減低或者喪失,肝臟未能迅速胰島素化,不能及時抑制肝葡萄糖的輸出,進而引起血糖持續性高水平[8-9]。
胰島β 細胞的損傷與PCOS 患者性激素紊亂有關[10-12]。性激素紊亂改變胰島素釋放受體蛋白的活性,使機體胰島素的作用發生改變,引起胰島素功能損傷[13]。本研究對比分析了胰島素峰值后移組與無后移組的血清性激素變化,結果顯示峰值后移組血清LH 和FSH 高于無后移組,血清E2 低于無后移組,差異均有統計學意義(均P<0.05);而血清PRL,T,PG 兩組比較,差異無統計學意義(P>0.05)。E2 具有抗細胞凋亡的作用,可以保護胰島β 細胞,有明顯的抗糖尿病活性,在人體的生理和疾病發展的過程中發揮重要作用[14-15]。吳婷婷等[16]通過實驗證明,進行雌激素干預,可以使糖尿病小鼠血糖水平降低,使小鼠的胰島體積和胰島素分泌增加,雌激素甚至可能影響胰島素基因的表達。女性的E2 水平下降,機體代謝降低,可引起糖脂代謝異常[17],臨床上也常用雌激素替代治療來改善患者糖脂代謝異常[18]。E2 可以影響胰島素的分泌,這與本研究結果相符,胰島素峰值后移組E2 比無后移組要低。高LH 是PCOS 患者典型內分泌紊亂特征,LH 與胰島素有相關性[19]。胰島素可以作用于垂體,影響下丘腦-垂體-卵巢軸功能,引起LH升高[20],本研究結果顯示,發生胰島素峰值后移的PCOS 患者,LH 水平更高。PCOS 患者FSH 常降低或者維持在正常水平[21],本研究卻發現峰值后移的患者FSH 更高,似乎與PCOS 疾病進程矛盾,不符合PCOS 病人的內分泌特點。近年來有學者研究發現,血清FSH 較高的PCOS 病人往往提示卵巢儲備功能低下,卵巢儲備功能下降使內竇卵泡數不斷減少,下降的抑制素可導致FSH 水平升高[22-23]。PCOS 病人卵巢儲備功能下降與胰島素分泌是否存 在相關性,有待進一步研究證實。
相關性分析表明,LH 和FSH 與胰島素釋放峰值后移呈顯著正相關(r=0.213,0.187,均P<0.05),E2 與胰島素峰值后移呈顯著負相關(r= -0.195,P<0.05);血清PRL,T 和PG 與胰島素峰值后移無相關性(P>0.05),血清E2,LH 和FSH可能是引起PCOS 患者峰值后移的影響因素。女性性激素水平受下丘腦-垂體-卵巢軸和生長激素-胰島素樣生長因子軸的調節,這兩條軸相互影響,王立會等[24]研究表明下丘腦分泌的促性腺激素釋放激素(GnRH)與胰島素第一時相分泌呈正相關,高水平的LH 和FSH 可負反饋使GnRH 降低。推測PCOS 患者持續低水平E2 可負反饋引起LH 和FSH升高,抑制促性腺激素釋放激素(GnRH)的分泌,進而影響胰島素第一時相的分泌。當機體受到高糖刺激時,第一時相胰島素分泌障礙,血糖下降緩慢,不能及時下調血糖水平,但PCOS 糖代謝異常程度輕于糖尿病患者,胰島素β 細胞儲備功能尚可,第二時相代償性增加胰島素的分泌量來維持血糖的穩定,發生峰值后移。
總的來說, PCOS 患者峰值后移與血清E2,LH,FSH 存在一定的相關性,這可為闡明胰島素峰值后移機制提供參考依據。

