混菌固態發酵提高甘蔗葉酚類物質含量及抗氧化活性
閻欲曉,粟桂嬌,何勇強
1. 廣西大學生命科學與技術學院(南寧 530004);2. 廣西微生物與酶工程技術研究中心(南寧 530004)
甘蔗葉為植物甘蔗在種植和收獲過程中產生的副產物,大部分被焚燒處理或做飼料使用,造成了資源的浪費和環境的污染[1]。許多報道顯示甘蔗中富含具有抗氧化活力的酚類化合物[2-3],甘蔗葉(梢)雖然只占甘蔗莖的小部分,但研究發現甘蔗中酚類物質多富集在甘蔗葉、鞘部位[4-5],含量在0.5%~2%之間[6],從經濟和環境角度出發,利用農業殘留物是生產酚類物質的較好選擇。
植物酚類物質有游離態和結合態兩種形式,游離態酚類物質易溶于水和有機溶劑,而結合態酚類物質通過糖苷鍵、酯鍵等與其他物質結合,較難萃取[7-8]。有機溶劑萃取法是目前提取甘蔗葉酚類物質常用的方法,但研究表明,甘蔗葉中含量較高的咖啡酸、阿魏酸、香豆酸等多酚物質都與細胞壁中的纖維素、木質素結合在一起[9],有機溶劑不能破壞這些結合,導致提取率偏低。
近年來,混菌固態發酵常用于提高植物酚類物質的釋放,通過發酵過程中菌體代謝產生的纖維素酶、木質素分解酶等復合酶系的互補性和協同性,將植物細胞壁上的木質素、纖維素水解,破壞纖維致密結構,使結合狀態的黃酮、多酚釋放出來[10-11],顯著提高植物中酚類物質的含量和抗氧化性。
此次試驗利用米曲霉和黑曲霉混合菌種對甘蔗葉進行固態發酵,研究發酵過程中甘蔗葉黃酮、多酚的含量和抗氧化活性的變化情況,并對代謝產生的β-葡萄糖苷酶和纖維素酶活性進行測定,探索這2種水解酶活力與酚類物質釋放的關系,為甘蔗葉酚類物質的高效提取提供依據。
1 材料與方法
1.1 主要材料與試劑
甘蔗葉:采摘于甘蔗種植田,烘干粉碎過12目(1.7 mm孔徑)篩;米曲霉GXU01、黑曲霉GXU06菌種:廣西大學生命科學與技術學院篩選保藏;對硝基苯酚(p-Nitrophenol,p-NP)、對硝基苯基-β-D-吡喃葡萄糖苷(p-Nitrophenyl-β-D-glucopyranoside,p-NPG)、1, 1-二苯基-2-三硝基苯肼(DPPH):均為分析純,美國Sigma公司;其余試劑均為國產分析純。
1.2 主要儀器與設備
3-18K高速冷凍離心機(德國Sigma公司);UVmini-1240紫外分光光度計[島津企業管理(中國)有限公司];Elx80全自動酶標儀(美國Biotek Instruments公司)。
1.3 試驗方法
1.3.1 種子液的制備
分別將米曲霉、黑曲霉菌種接種到PDA斜面培養基,于30 ℃培養4 d,制成孢子懸液后將各菌液以10%的接種量接入種子培養液,在120 r/min,30 ℃條件下培養12 h。
1.3.2 米曲霉/黑曲霉固態發酵單因素試驗
以甘蔗葉65%、麩皮35%為基礎培養基,研究培養基含水量(40%,50%,60%,70%和80%)、接種量(9%,18%,27%,36%和45%)、混菌比例(3∶1,2:1,1∶1,1∶2和1∶3 mL/mL)、發酵時間(2,3,4,5和6 d)因素對黃酮、多酚含量的影響
1.3.3 米曲霉/黑曲霉固態發酵正交試驗
在單因素試驗基礎上,采用四因素三水平正交試驗L9(34)對發酵條件進行優化。

表1 因素水平表L9(34)
1.3.4 酚類物質含量測定
黃酮含量測定:采用NaNO2-Al(NO3)3-NaOH比色法,參照文獻[12]方法測定。
多酚含量測定:參照GB/T 8313—2018《茶葉中茶多酚和兒茶素類含量的檢測方法》測定。
1.3.5 酶活力測定
β-葡萄糖苷酶活力:將酶液20 μL與20 μL 20 mmol/Lp-NPG溶液混合,加入160 μL磷酸緩沖液(pH 5.5),于37 ℃反應20 min后加入50 μL 2 mol/L Na2CO3溶液終止反應,在405 nm波長下測定吸光讀。在反應條件下,1 g發酵甘蔗葉1 h水解p-NPG產生1 μmolp-NP所需酶量為一個酶活單位。
纖維素酶活力測定:將0.5 mL酶液與1% 1.0 mL CMC-Na混合,于50 ℃保溫30 min,加入3 mL DNS試劑,煮沸5 min后定容至20 mL,在540 nm波長下測定吸光讀。在反應條件下,1 g發酵甘蔗葉1 h分解纖維素產生1 μmol葡萄糖所需酶量為一個酶活單位。
1.3.6 抗氧化能力測定
按照文獻[13]進行羥自由基和DPPH自由基清除試驗。
1.4 數據處理及統計分析
2 結果與分析
2.1 米曲霉/黑曲霉混菌固態發酵單因素試驗
2.1.1 培養基含水量的影響
由圖1可知,隨著含水量的增加,黃酮和多酚的質量分數有上升趨勢,在含水量為60%時,黃酮和多酚質量分數均達到最大,但當含水量提高到70%和80%時,固態培養基發生結塊,菌體缺氧導致發酵受抑制,黃酮和多酚質量分數明顯下降。該結果與文獻報道含水量對真菌發酵銀杏葉[14]和紅曲霉發酵番石榴葉[15]提取黃酮、多酚的結果相似。

圖1 培養基含水量對黃酮和多酚質量分數的影響
2.1.2 混菌接種量的影響
由圖2可知:隨著接種量的上升,黃酮、多酚的質量分數顯著上升,在接種量為36%時黃酮質量分數達到最大值,為7.09 mg/g,是對照組的1.28倍;在接種量為18%時,多酚質量分數達到最大,為7.04 mg/g,是對照組的1.24倍;再增加接種量,黃酮、多酚的質量分數都會下降。在一定接種量范圍內,隨著接種量的增加,菌體代謝產生的水解酶會破環甘蔗葉細胞壁結構,使黃酮和多酚從結合態轉變為游離態,增加了黃酮和多酚的釋放量,但接種量過大,抑制了菌體生長和產酶活力,導致提取率降低。

圖2 混菌接種量對黃酮和多酚質量分數的影響
2.1.3 菌種比例的影響
由圖3可以看出,隨著米曲霉所占比例降低,黑曲霉比例增加,黃酮和多酚質量分數先增加后降低,當米曲霉∶黑曲霉比例為1∶2時,含量均達到最高點。原因可能是米曲霉∶黑曲霉為1∶2比例時,兩種菌發揮協同作用最佳,分泌的水解酶系最多,最有利于結合態酚類物質釋放和溶出。

圖3 混菌接種比例對黃酮和多酚質量分數的影響
2.1.4 發酵時間的影響
由圖4可知:隨著發酵時間的延長,甘蔗葉黃酮和多酚的質量分數均呈現先增加后下降的趨勢,在發酵第3和第4天兩者達到最大值,此時微生物分泌的水解酶活力最強,細胞壁對酚類化合物溶出的阻滯作用最小,從而游離態黃酮和多酚質量分數上升;但隨著發酵時間的增長,發酵后期微生物會分泌某種酶將游離酚類化合物降解或聚合,反而導致酚類物質的含量有所下降[16-17]。
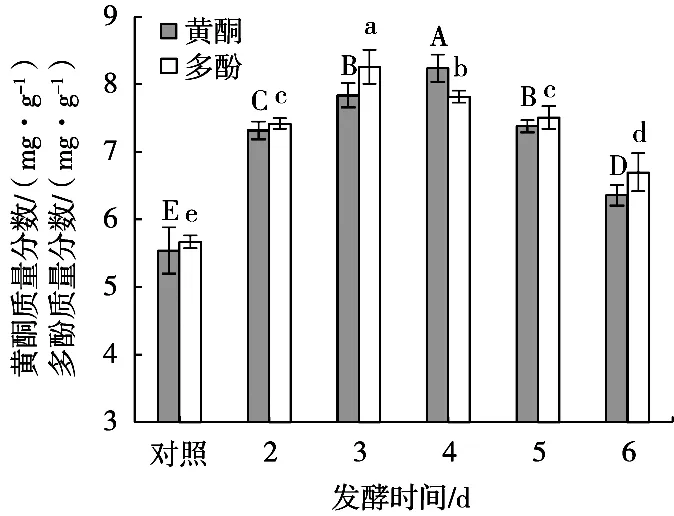
圖4 發酵時間對黃酮和多酚質量分數的影響
2.2 米曲霉/黑曲霉混菌固態發酵正交試驗
對正交試驗數據進行分析處理,結果見表2。
由表2可以看出,對發酵甘蔗葉中黃酮和多酚質量分數的影響程度為含水量>發酵時間>菌種比例>接種量。結合黃酮、多酚質量分數k值進行綜合分析,其最佳工藝條件為A2B1C2D2,即接種量45%、培養基含水量40%、米曲霉與黑曲霉比例為1∶2、發酵時間4 d。在此條件下進行發酵試驗,測得黃酮質量分數為8.35 mg/g,比未發酵甘蔗葉中黃酮質量分數提高了50.72%,多酚質量分數為8.54 mg/g,比未發酵樣品中多酚質量分數提高了50.62%。

表2 正交試驗結果
2.3 發酵過程中酚類物質含量與水解酶活性的相關性
2.3.1 混菌發酵對水解酶活性影響
為了研究發酵過程中酚類物質含量變化與相關水解酶活力的關系,對發酵過程中酶活力進行了測定。從圖5可知,在甘蔗葉發酵過程中纖維素酶的活力均高于β-葡萄糖苷酶的活力,發酵前期兩種酶的活力均不斷增加,在發酵第3天達到最大,分別為585.88 U/g和136.68 U/g,隨著發酵時間延長酶活力有所下降。

圖5 發酵過程中酶活力變化
2.3.2 黃酮、多酚質量分數與水解酶活力的相關性
黃酮、多酚的釋放量與兩種水解酶活力的相關性分析如表3所示。2種水解酶活力與黃酮和多酚質量分數呈現顯著正相關,推測在發酵過程中,纖維素酶首先破壞植物細胞壁結構,使游離黃酮、多酚溶出,并將結合態酚類物質中的糖苷鍵和酯鍵暴露,有利于β-葡萄糖苷酶和纖維素酶等復合水解酶系進行水解,使結合態多酚轉變為游離態多酚溶出[18]。
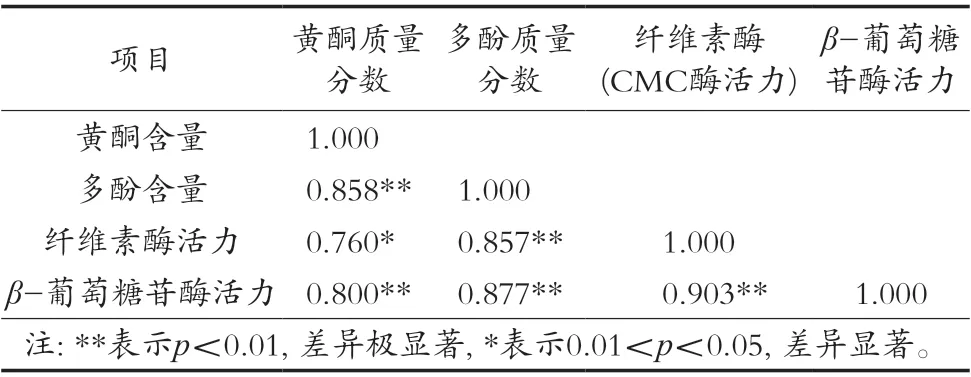
表3 黃酮、多酚質量分數與酶活力的相關系數
2.4 發酵甘蔗葉抗氧化活性
2.4.1 發酵/未發酵甘蔗葉提取物對DPPH自由基清除能力
從圖6可知,相同濃度下發酵甘蔗葉提取物對DPPH自由基清除率均比未發酵甘蔗葉提取液高,從IC50值比較,未發酵甘蔗葉樣品的IC50為37.40 μg/mL,而發酵甘蔗葉樣品的IC50下降為32.64 μg/mL,也說明發酵后甘蔗葉中酚類物質抗氧化能力得到提高。

圖6 發酵/未發酵甘蔗葉提取物對DPPH自由基清除能力
2.4.2 發酵/未發酵甘蔗葉提取物對羥自由基(·OH)清除能力
由圖7可知,發酵/未發酵甘蔗葉提取物對羥自由基均有一定的清除能力,且表現出明顯的量效關系。發酵甘蔗葉樣品的IC50值為174.13 μg/mL,未發酵甘蔗葉樣品的IC50值為280.25 μg/mL,表明發酵后甘蔗葉提取物清除羥自由基的能力顯著提高,但略低于維生素C(IC50值為161.90 μg/mL)。

圖7 發酵/未發酵甘蔗葉對羥自由基的清除能力
3 結論
利用米曲霉和黑曲霉混合菌種對甘蔗葉進行固態發酵,可以提升甘蔗葉中的黃酮、多酚的質量分數。在發酵溫度30 ℃、基質含水量40%、總接種量45%、米曲霉與黑曲霉接種比例1∶2的條件下固態發酵4天,黃酮質量分數為8.35 mg/g,比未發酵甘蔗葉提高了50.72%,多酚質量分數為8.54 mg/g,比未發酵樣品中多酚質量分數提高了50.62%。
在混菌固態發酵過程中,黃酮、多酚質量分數變化與β-葡萄糖糖苷酶和纖維素酶活性變化呈顯著正相關。
通過DPPH自由基和羥自由基體外清除試驗,結果發現發酵甘蔗葉產物對DPPH自由基和羥自由基的清除能力比未發酵甘蔗葉有良好的上升趨勢,說明經過混合菌種固態發酵后甘蔗葉酚類物質的抗氧化能力得到了提高。

