熱應(yīng)激對豬顆粒細胞蛋白質(zhì)表達譜的影響
王澤平, 沈 婕, 趙為民, 付言峰, 李碧俠, 任守文, 程金花, 李 輝
(1.江蘇省農(nóng)業(yè)科學(xué)院宿遷市農(nóng)業(yè)科學(xué)研究所,江蘇宿遷223800;2.江蘇省農(nóng)業(yè)科學(xué)院畜牧研究所,江蘇南京210014;3.廣西大學(xué)動物科學(xué)技術(shù)學(xué)院,廣西南寧530005)
豬的皮膚較厚,皮下脂肪含量高且汗腺不發(fā)達,故調(diào)節(jié)體溫能力相對較差。研究結(jié)果表明,豬最適溫度為12~21 ℃[1],當(dāng)環(huán)境溫度由18 ℃升至29 ℃時,豬體溫將從34.6 ℃升至37.4 ℃[2],而直腸溫度將從39.2 ℃升高至40.0 ℃[3]。因此當(dāng)外界氣溫超過27 ℃時,母豬體溫也將被動升高而產(chǎn)生熱應(yīng)激[4],并對豬機體造成不良影響。以母豬為例,當(dāng)受到熱應(yīng)激時可表現(xiàn)出發(fā)情不明顯、乏情或短促發(fā)情等癥狀,經(jīng)產(chǎn)母豬斷奶7 d內(nèi)發(fā)情率顯著降低,而后備母豬則表現(xiàn)出初情期推遲等現(xiàn)象[5-6]。夏秋時節(jié),中國大部分地區(qū)的氣溫超過30 ℃,因此母豬受到熱應(yīng)激是夏秋季節(jié)造成中國養(yǎng)豬業(yè)受損的重要因素,隨著全球變暖,熱應(yīng)激的影響將更加嚴重。然而,目前人們對熱應(yīng)激影響母豬繁殖性能的機制并不清楚。
顆粒細胞介于膜細胞和卵母細胞之間,是體內(nèi)唯一與卵母細胞直接接觸的體細胞。它們可以通過分泌類固醇類激素、供給卵母細胞營養(yǎng)物質(zhì)、接收并傳遞信號等方式參與維持卵泡發(fā)育、促進卵母細胞成熟和誘導(dǎo)排卵等過程。顆粒細胞功能受損將影響動物卵泡發(fā)育和繁殖活動[7]。養(yǎng)殖過程中,動物常常受到一些因素的影響,導(dǎo)致顆粒細胞功能紊亂,主要表現(xiàn)在類固醇激素分泌能力下降、細胞增殖抑制/凋亡、黃體化受阻等[8-10],其直接后果是抑制動物的繁殖性能,最終影響畜牧業(yè)的健康發(fā)展。遺憾的是,目前關(guān)于熱應(yīng)激直接影響顆粒細胞的研究相對較少且大多從單一角度或者在某一點上展開研究,例如,前人研究發(fā)現(xiàn)熱應(yīng)激可抑制顆粒細胞中促卵泡素受體(FSHR)表達,并促進細胞凋亡[11]。我們前期研究也發(fā)現(xiàn)熱應(yīng)激處理豬顆粒細胞可顯著抑制雌激素的分泌,造成熱休克蛋白HSP70表達量上調(diào)[9, 12]。總體而言,目前在熱應(yīng)激影響卵泡顆粒細胞功能方面缺乏系統(tǒng)性、整體性的認識。為解決該問題,本研究擬先解析熱應(yīng)激對豬顆粒細胞蛋白質(zhì)表達譜的影響。
1 材料與方法
1.1 試驗材料
將在屠宰場取的豬卵巢,放置于裝有37 ℃生理鹽水(預(yù)先加入1%青霉素/鏈霉素)的保溫瓶中盡快拿回實驗室處理。在實驗室超凈臺中清洗消毒卵巢,擦凈殘留液體后,選取直徑大于5 mm卵泡,用一次性注射器抽取其卵泡液,并利用Ficoll-Paque梯度離心法分離出顆粒細胞[13]。分離出的細胞經(jīng)多次清洗后用DMEM/F12培養(yǎng)液(含10%胎牛血清、1%青霉素/鏈霉素)稀釋后接種于6孔板中,并置于37 ℃,含有5% CO2、95%空氣的培養(yǎng)箱中持續(xù)靜止培養(yǎng)24 h后,用溫?zé)岬臒oCa2+、Mg2+的磷酸鹽緩沖溶液(PBS)清洗2~3次,洗掉未貼壁細胞,更換新的DMEM/F12培養(yǎng)液(含10%胎牛血清、1%青霉素/鏈霉素)后進行后續(xù)處理。
1.2 熱應(yīng)激處理
將獲得的細胞隨機分為2組。一組為對照組,將細胞放入37 ℃的細胞培養(yǎng)箱中培養(yǎng)3 h;另一組作為熱應(yīng)激組,將細胞放入41 ℃的細胞培養(yǎng)箱中培養(yǎng)3 h。處理結(jié)束后,用溫?zé)岬臒oCa2+、Mg2+的PBS徹底清洗細胞,確保無培養(yǎng)基殘留,然后將細胞刮下備用。所有試驗重復(fù)3次。
1.3 蛋白質(zhì)的提取及定量
收集的細胞按照蛋白質(zhì)組學(xué)的標準流程進行處理。處理過程簡述如下:細胞沉淀先用四乙基溴化銨緩沖溶液(TEAB)溶解;裂解后的初始蛋白質(zhì)溶液經(jīng)超聲破碎后離心并收集上清液,棄掉細胞碎片。在收集的上清液中加入4倍體積的預(yù)冷丙酮[含有10 mmol/L的二硫蘇糖醇(DTT)],充分混勻后放置在4 ℃冰箱中靜置2 h,蛋白質(zhì)沉淀逐漸析出后通過離心將蛋白質(zhì)沉淀收集至管底,再用預(yù)冷丙酮(含10 mmol/L的DTT)清洗蛋白質(zhì)沉淀后進行干燥。最終用四乙基溴化銨(TEAB)溶解蛋白質(zhì)沉淀,并對蛋白質(zhì)進行定量。
1.4 蛋白質(zhì)樣品酶解、脫鹽及標記
選取一定質(zhì)量的蛋白質(zhì)溶液,調(diào)整體積后用NH4HCO3(50 mmol/L)進行稀釋,加入胰蛋白酶溶液,置于37 ℃培養(yǎng)箱中酶解過夜。酶解結(jié)束后將酶解液進行脫鹽處理;脫鹽后的蛋白質(zhì)按照試劑盒說明書進行標記。標記結(jié)束后在所有標記樣本中取相同體積進行混合,準備上機分離。
1.5 蛋白質(zhì)樣品組分分離及液相色譜-質(zhì)譜/質(zhì)譜(LC-MS/MS)檢測
將上述混合后的樣本用Thermo DINOEX Ultimate 3000 BioRS分成12個組分,并利用AB SCIEX nano LC-MS/MS(Triple TOF 5600 plus)對每個組分依次進行質(zhì)譜檢測。
1.6 蛋白質(zhì)的鑒定、差異表達蛋白質(zhì)的功能注釋和通路分析
以可信度95%為標準對所得的肽段進行篩選,可信度大于95%的肽段用搜索引擎ProteinpilotTMV4.5進行搜索。當(dāng)差異表達倍數(shù)≥1.5倍(即上調(diào)≥1.5倍或下調(diào)≤0.67倍)且P值≤0.05時,視為顯著差異表達蛋白質(zhì),并利用在線分析系統(tǒng)BLAST2GO (http://www.Blast2GO.com/)對所有差異表達蛋白質(zhì)進行GO功能注釋,隨后利用通路數(shù)據(jù)庫KEGG進行通路分析。
2 結(jié)果與分析
2.1 熱應(yīng)激后豬顆粒細胞的蛋白質(zhì)總體鑒定情況
利用同位素標記相對和絕對定量(iTRAQ)技術(shù)對受熱應(yīng)激處理的豬顆粒細胞的蛋白質(zhì)進行定量分析,共鑒定到5 451個蛋白質(zhì)。鑒定肽段數(shù)為35 936個,其中至少包含2個Unique肽段的蛋白質(zhì)數(shù)為4 448個。本研究鑒定到的肽段的長度主要分布在7.00~20.00 aa,其中大多數(shù)肽段的長度為11.00 aa,平均長度為14.57 aa,處于肽段長度合理范圍(圖1A)。對可信度≥95%的肽段覆蓋度分布的分析結(jié)果顯示,覆蓋度介于0~10.0%的蛋白質(zhì)數(shù)量占總鑒定蛋白質(zhì)數(shù)量的38.49%(圖1B)。
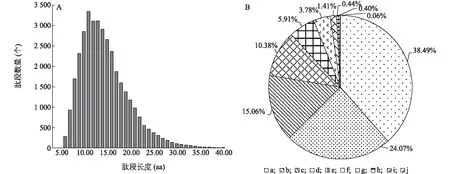
A:肽段長度分布;B:蛋白質(zhì)鑒定覆蓋度分布。a:0~10.0%; b:10.1%~20.0%; c:20.1%~30.0%; d:30.1%~40.0%; e:40.1%~50.0%; f:50.1%~60.0%; g:60.1%~70.0%; h:70.1%~80.0%; i:80.1%~90.0%; j:90.0%~100.0%。圖1 肽段長度分布和蛋白質(zhì)覆蓋度Fig.1 Distribution of peptides length and protein sequence coverage
2.2 差異表達蛋白質(zhì)分析
通過對熱應(yīng)激處理的豬顆粒細胞中蛋白質(zhì)表達的分析,共鑒定到289個差異表達蛋白質(zhì),其中上調(diào)表達蛋白質(zhì)162個,下調(diào)表達蛋白質(zhì)127個(部分差異表達蛋白質(zhì)見表1和表2)。從表1中可以看出,熱休克蛋白HSP70、HSP90等與熱應(yīng)激相關(guān)的標志性蛋白質(zhì)上調(diào)表達。這些蛋白質(zhì)的上調(diào)表達也可被視為熱應(yīng)激處理成功的標志。同時,肽基脯氨酸順反異構(gòu)酶、鈣網(wǎng)蛋白、鈣調(diào)理蛋白等蛋白質(zhì)上調(diào)表達(表1)。而組蛋白H4、載脂蛋白E、芳香化酶3、雌二醇17β-脫氫酶、三磷酸腺苷合成酶α亞基等蛋白質(zhì)表達顯著下調(diào)(表2)。
我們進一步對對照組和熱應(yīng)激組樣品的分析結(jié)果進行聚類分析,從圖2可以看出,3個生物學(xué)重復(fù)之間重復(fù)性良好,且差異表達蛋白質(zhì)的聚類清晰。
2.3 差異表達蛋白質(zhì)的直系同源簇(COG)注釋
為預(yù)測和系統(tǒng)了解所鑒定到的蛋白質(zhì)的潛在生物學(xué)功能,我們對所有鑒定到的蛋白質(zhì)與COG數(shù)據(jù)庫進行了比對分析和分類統(tǒng)計。圖3是本次鑒定結(jié)果比對到COG數(shù)據(jù)庫的統(tǒng)計結(jié)果。
2.4 差異表達蛋白質(zhì)的GO分類和KEGG分析
為解析差異表達蛋白質(zhì)的生物學(xué)功能,本研究對所有的差異表達蛋白質(zhì)進行了注釋。如圖4所示,本研究所鑒定到的差異表達蛋白質(zhì)參與了細胞過程、代謝過程、生物調(diào)控、應(yīng)激反應(yīng)等相關(guān)功能的調(diào)控。

表1 部分上調(diào)表達的差異蛋白質(zhì)
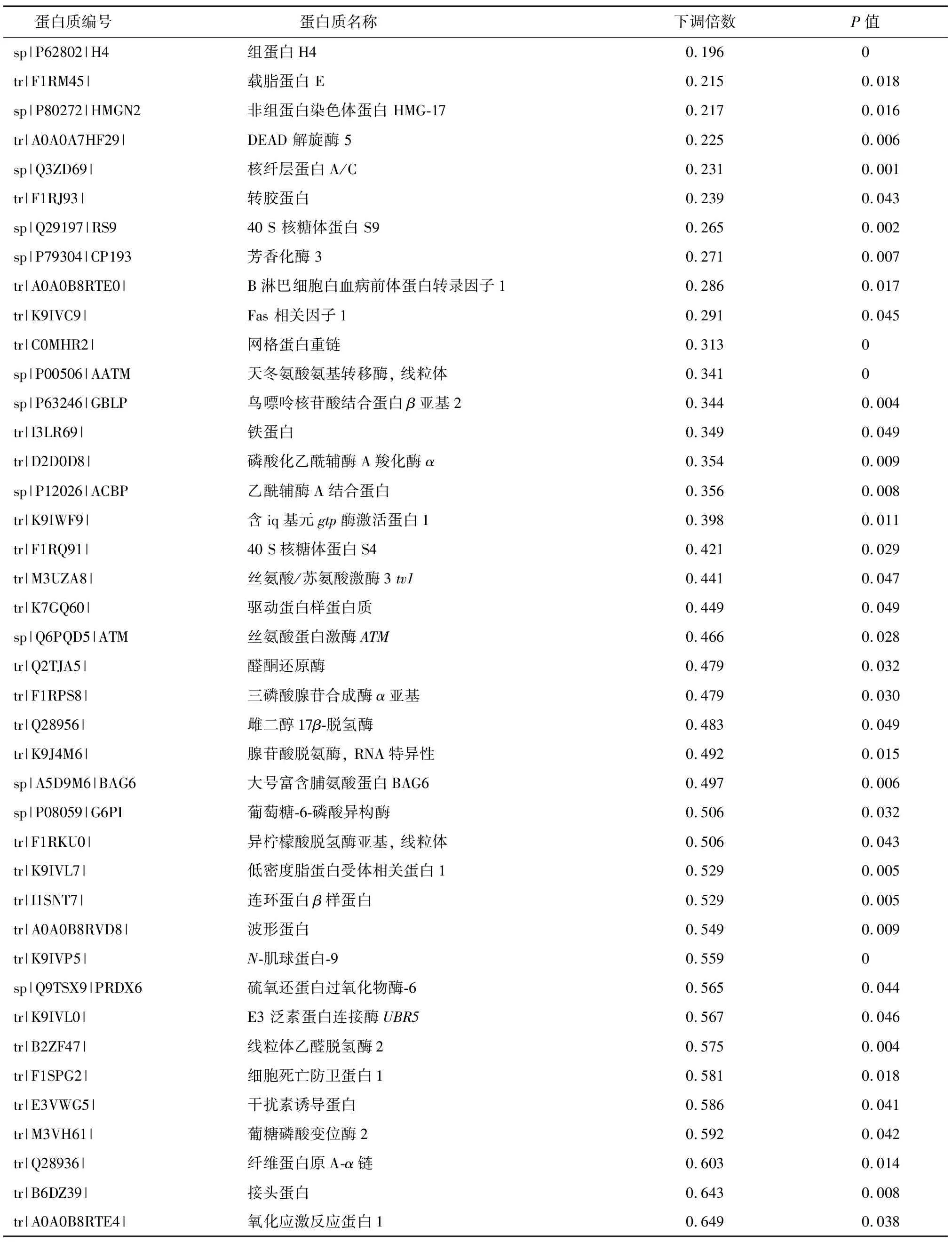
表2 部分下調(diào)表達的差異蛋白質(zhì)
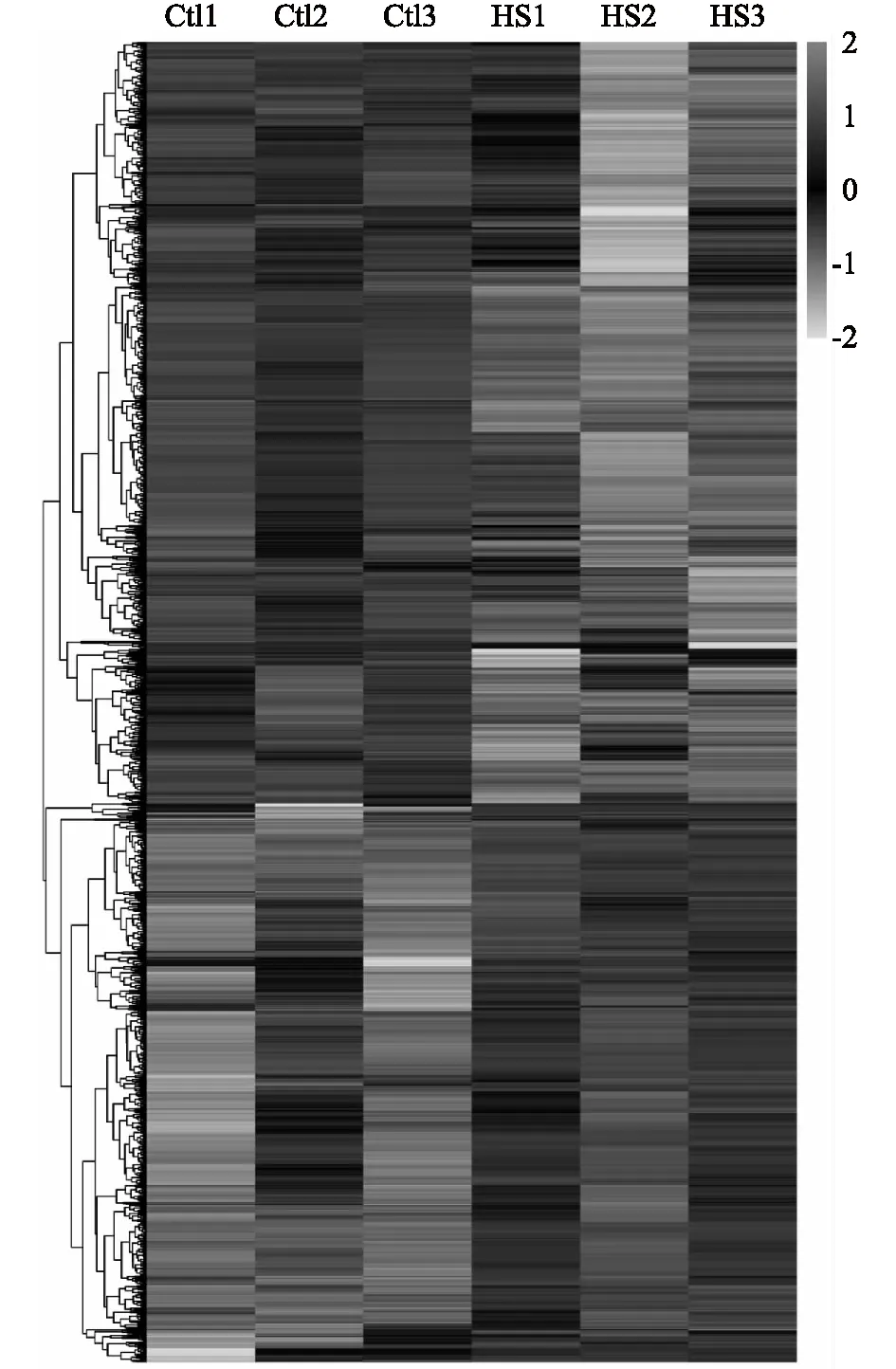
Ctl:對照;HS: 熱應(yīng)激。圖2 豬顆粒細胞受熱應(yīng)激過程中差異表達蛋白質(zhì)的聚類分析Fig.2 Clustering results of differentially expressed proteins in porcine granulosa cells during heat stress
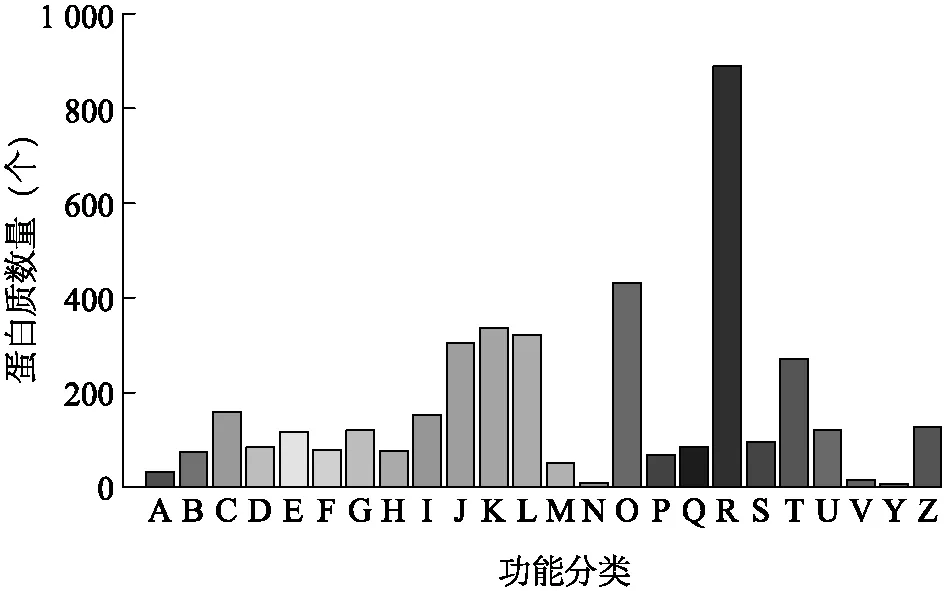
A:RNA加工和修飾; B:染色質(zhì)結(jié)構(gòu)和動態(tài)變化; C:能量產(chǎn)生和變化; D:細胞周期控制,細胞分裂,染色體分割; E:氨基酸運輸和代謝; F:核苷酸轉(zhuǎn)移和代謝; G:碳水化合物轉(zhuǎn)移和代謝; H:輔酶轉(zhuǎn)移和代謝; I:脂類轉(zhuǎn)移和代謝; J:翻譯,核糖體結(jié)構(gòu)和生物發(fā)生; K:轉(zhuǎn)錄; L:復(fù)制,重組和修復(fù); M:細胞壁/膜/殼生成; N:細胞運動; O:轉(zhuǎn)錄后修飾,蛋白質(zhì)折疊,分子伴侶; P:無機鹽離子轉(zhuǎn)運和代謝; Q:次級代謝產(chǎn)物生成,轉(zhuǎn)運和代謝; R:功能預(yù)測; S:未知功能; T:信號轉(zhuǎn)導(dǎo)機制; U:胞內(nèi)交通,分泌和微囊轉(zhuǎn)運; V:防御機制; Y:核結(jié)構(gòu); Z:細胞骨架。圖3 蛋白質(zhì)的直系同源簇注釋分析Fig.3 COG annotation analysis of proteins

1:細胞過程; 2:代謝過程; 3:生物調(diào)控; 4:應(yīng)激反應(yīng); 5:生物過程調(diào)控; 6:細胞組分配置或生物發(fā)生; 7:發(fā)育過程; 8:多細胞生物過程; 9:定位; 10:定位建立; 11:信號; 12:死亡; 13:免疫系統(tǒng)過程; 14:正調(diào)控生物過程; 15:負調(diào)控生物過程; 16:細胞增殖; 17:運動; 18:繁殖; 19:繁殖過程; 20:多物種過程; 21:生長; 22:病毒繁殖; 23:生物黏附; 24:細胞; 25:細胞組分; 26:細胞器; 27:細胞器組分; 28:大分子復(fù)合物; 29:膜封閉腔; 30:胞外域; 31:部分胞外域; 32:結(jié)合; 33:催化活性; 34:結(jié)構(gòu)分子活動; 35:轉(zhuǎn)運活性; 36:能量調(diào)控活性; 37:蛋白質(zhì)結(jié)合轉(zhuǎn)錄因子活性; 38:抗氧化活性; 39:受體調(diào)控活性。圖4 差異表達蛋白質(zhì)的GO功能注釋結(jié)果Fig.4 GO function annotation results of differentially expressed proteins
為進一步了解差異表達蛋白質(zhì)所富集的通路,進行了KEGG通路分析。如圖5所示,表達量上調(diào)的蛋白質(zhì)主要富集在剪接體以及內(nèi)質(zhì)網(wǎng)的蛋白質(zhì)加工、代謝通路、胞吞、RNA降解和氧化磷酸化等信號通路中。而下調(diào)表達蛋白質(zhì)則顯著富集在代謝通路、次級代謝產(chǎn)物的生物合成、嘌呤代謝、泛素化蛋白質(zhì)降解、糖酵解/糖異生以及胞間緊密連接等信號通路中。

A:上調(diào)表達蛋白質(zhì)富集的通路及數(shù)量占比;B:下調(diào)表達蛋白質(zhì)富集的通路及數(shù)量占比。a1:剪接體; b1:內(nèi)質(zhì)網(wǎng)蛋白質(zhì)加工; c1:代謝通路; d1:胞吞; e1:帕金森病; f1:亨廷頓癥; g1:抗原加工和遞呈; h1:RNA降解; i1:氧化磷酸化; j1:阿爾茨海默病。a:代謝通路; b:次級代謝產(chǎn)物的生物合成; c:不同環(huán)境下微生物的代謝; d:嘌呤代謝; e:泛素化蛋白質(zhì)降解; f:糖酵解/糖異生; g:胞間緊密連接; h:磷酸戊糖途徑; i:淀粉和糖代謝; j:氨糖和核糖代謝。圖5 差異表達蛋白質(zhì)的KEGG通路分析結(jié)果Fig.5 KEGG pathway analysis results of differentially expressed proteins
3 討論
熱應(yīng)激可導(dǎo)致雌性動物短促發(fā)情或乏情、降低受胎率、早期胚胎死亡和流產(chǎn)等問題[12]。前人研究發(fā)現(xiàn),熱應(yīng)激可經(jīng)下丘腦-垂體-性腺軸對動物的內(nèi)分泌產(chǎn)生不良影響進而造成上述問題[14]。熱應(yīng)激導(dǎo)致動物內(nèi)分泌紊亂主要表現(xiàn)在性激素[促性腺激素釋放激素(GnRH)、促卵泡激素(FSH)和促黃體激素(LH)等]分泌量下降、抑制促性腺激素受體基因的表達[15-17]等。此外,通過下丘腦-垂體-性腺軸,熱應(yīng)激還可調(diào)控其他激素的分泌,例如抑制促甲狀腺激素[18]、甲狀腺激素[19]以及促腎上腺皮質(zhì)激素釋放激素[20]等激素的合成和分泌,從而增加腎上腺皮質(zhì)激素分泌量,造成黃體提早溶解,引起早期胚胎死亡或流產(chǎn)[21]。
熱應(yīng)激通過下丘腦-垂體-性腺軸對顆粒細胞功能產(chǎn)生影響,是其重要的內(nèi)分泌調(diào)控路徑。然而,就顆粒細胞所處的位置來講,其位于動物腹腔最深處,受熱應(yīng)激時,豬機體深處的體溫,即核心體溫顯著升高[22],升高的核心溫度必然直接作用于顆粒細胞而影響其功能。遺憾的是,當(dāng)前對于熱應(yīng)激直接影響顆粒細胞的研究較少。因此本研究通過體外培養(yǎng)的方式,將顆粒細胞所處的卵泡微環(huán)境、下丘腦-垂體-性腺軸以及內(nèi)分泌環(huán)境的影響剝離,純粹在細胞水平上對熱應(yīng)激調(diào)控顆粒細胞功能的分子機理開展研究。我們前期在體外模擬了顆粒細胞受到熱應(yīng)激的狀態(tài):將顆粒細胞分別在37 ℃(對照組)和41 ℃(熱應(yīng)激組)培養(yǎng)箱中培養(yǎng),結(jié)果發(fā)現(xiàn),顆粒細胞合成雌激素和孕酮的能力隨著溫度的升高顯著下降,且與之相關(guān)的CYP11A1、CYP19A1和FSHR基因表達量顯著下調(diào),但HSP70的表達量顯著上調(diào)[9]。上述結(jié)果說明熱應(yīng)激可直接對顆粒細胞的功能產(chǎn)生影響。
為深入了解熱應(yīng)激對豬卵泡顆粒細胞功能的影響,并最終為解決受熱應(yīng)激的母豬繁殖性能降低的問題提供理論依據(jù),本研究利用iTRAQ技術(shù)對受熱應(yīng)激處理的豬顆粒細胞的蛋白質(zhì)表達差異進行了系統(tǒng)研究,共鑒定到5 451個蛋白質(zhì)。這是目前已知鑒定到的相對較多的豬卵泡顆粒細胞蛋白質(zhì)組表達譜,并篩選出了289個差異表達蛋白質(zhì),其中上調(diào)表達蛋白質(zhì)162個,下調(diào)表達蛋白質(zhì)127個。通過對這些差異表達蛋白質(zhì)的GO分類和KEGG通路分析,初步闡明其分類屬性和富集的功能通路。我們推測這些差異表達蛋白質(zhì)在細胞抵抗熱應(yīng)激和減輕熱應(yīng)激對細胞造成損傷方面起到重要作用。例如,熱休克蛋白HSP70和HSP90是細胞受熱應(yīng)激的標志性蛋白質(zhì),作為分子伴侶,它們參與蛋白質(zhì)折疊,在抵御不利因素造成的應(yīng)激或凋亡過程中發(fā)揮了重要作用[23],其表達量的升高也標志著細胞正在抵御熱應(yīng)激帶來的損害[24]。
在對差異表達蛋白質(zhì)富集的KEGG通路分析中我們發(fā)現(xiàn)了參與內(nèi)質(zhì)網(wǎng)蛋白質(zhì)加工、RNA降解以及氧化磷酸化等過程的重要通路,說明這些通路的激活參與顆粒細胞抵抗熱應(yīng)激的過程。以氧化磷酸化為例,該過程是還原型煙酰胺腺嘌呤二核苷酸(NADH)通過氧化制造細胞代謝的重要能量載體——三磷酸腺苷(ATP)的過程[25],其詳細過程為:電子經(jīng)電子傳遞鏈從供體轉(zhuǎn)移至載體上,最后傳遞到受體,同時釋放能量以便ATP的合成[26]。Yin等[27]也發(fā)現(xiàn)熱應(yīng)激處理可促進卵丘顆粒細胞中ATP的合成,在我們前期研究中發(fā)現(xiàn)脂多糖(LPS)處理亦可上調(diào)豬顆粒細胞中ATP的合成[28]。這些結(jié)果充分說明,細胞提高胞內(nèi)ATP的合成可能是為了抵御受到的不良刺激。然而合成的ATP如何參與抵御不良刺激,目前尚不清晰,這需要我們通過進一步的研究加以闡明。
4 結(jié)論
本研究利用iTRAQ技術(shù)對受熱應(yīng)激處理的豬顆粒細胞的蛋白質(zhì)表達譜進行了研究,初步篩選出289個差異表達蛋白質(zhì),并分別富集到蛋白質(zhì)的泛素化降解、蛋白質(zhì)加工、胞吞、RNA降解、氧化磷酸化、嘌呤代謝、次生代謝產(chǎn)物的生物合成、糖酵解以及胞間緊密連接等信號通路中,也預(yù)示這些差異表達蛋白質(zhì)和信號通路參與了熱應(yīng)激對豬顆粒細胞功能影響的過程。

