辛伐他汀對哮喘小鼠細胞自噬和炎癥的影響及其機制的實驗研究
黃蘭 蔣振歡 杜月君
近年來,隨著環境污染加重及生活壓力增大,哮喘的發病率和死亡率仍較高,給世界帶來巨大經濟負擔,但目前尚無特定、有效的治療方法[1]。其發病機制包括氣道免疫-炎癥、神經調節等,現大量研究表明細胞自噬與哮喘氣道炎癥、氣道重塑密切相關[2-4]。近年來,大量研究表明辛伐他汀可通過mTOR信號通路調控細胞自噬,從而治療心血管疾病、自身免疫性疾病、神經系統疾病等,但辛伐他汀對哮喘細胞自噬的調控及其機制國內外少有報道,故該研究將通過建立小鼠哮喘模型進一步探討辛伐他汀對哮喘小鼠細胞自噬和炎癥的影響及其可能的機制,為其臨床應用提供更新的理論依據。
資料與方法
一、一般材料
1 實驗動物 共32只6~8周齡雌性BALB/C小鼠,購于重慶騰鑫科技公司,體重在15~18 g之間, 于西南醫科大學動物房適應性喂養1周后體重增加至18~25 g。 所有小鼠均由倫理委員會批準。
2 實驗物品 飼料,卵清蛋白(美國Sigma公司),氫氧化鋁(美國Pierce公司),辛伐他汀(10 mg/片),灌胃針,移液槍,試劑盒,抗體。
二、方法
1 動物分組 使用隨機法將32只小鼠分為4組,平均每組8只,分別為正常對照組(A組)、哮喘模型組(B組)、低劑量辛伐他汀組(C組40 mg/Kg)、高劑量辛伐他汀組(D組60 mg/Kg)。
2 哮喘模型建立 B、C、D三組于第0、7、14天腹腔注射100 ug卵清蛋白(OVA)+2 mg氫氧化鋁致敏,并在第21~60天給予5%水合氯醛瞬時麻醉后用50 ug OVA滴鼻激發,每周3次,A組給予等量生理鹽水腹腔注射致敏及滴鼻激發。
3 給藥方法 自第21天起,C、D兩組激發前1小時分別給予辛伐他汀40 mg/kg、60 mg/kg灌胃,每天1次,A、B兩組給予等量生理鹽水灌胃。
4 標本獲取 第70天給藥結束后采取斷頭法處死小鼠后置于手術臺,消毒后打開胸腔留取左側肺葉。用鑷子小心分離小鼠左肺葉,從矢狀面切取2mm厚度的中外帶肺組織,迅速置于4%多聚甲醛固定液中浸泡48小時后用于制備石蠟切片,剩余肺組織置于-80攝氏度冰箱中保存,用于后續實驗。
5 相關指標檢測 H.E染色檢測氣道炎癥及結構變化,Western blot檢測肺組織自噬相關蛋白LC3Ⅱ/Ⅰ、自噬信號通路蛋白t-mTOR、p-mTOR表達水平,RT-PCR法檢測自噬相關基因Atg5 mRNA和Beclin1 mRNA表達水平。取約100 mg肺組織通過trizol法充分溶解提取組織總RNA,在逆轉錄酶的作用下進行反轉錄,之后再以cDNA(互補脫氧核糖核苷酸)為模板行PCR擴增,擴增引物如下,結果(見表1)。

表1 肺組織引物序列情況
三、統計學處理
應用SPSS 19.0統計學軟件進行數據分析,模型組與對照組采用t檢驗分析;模型組和兩個給藥組間比較采用單因素方差分析(One-way ANOVA),方差齊時多重比較采用LSD法分析,方差不齊時則采用Games-Howell法分析;P<0.05為差異具有統計學意義。
結 果
一、小鼠哮喘發作癥狀
在哮喘激發過程中小鼠均出現哮喘急性發作表現,呼吸急促,呼吸動度增強、煩躁不安、安靜少動、嗆咳、打噴嚏。
二、病理學結果
A組小鼠肺組織及支氣管均呈正常表現,未見炎癥細胞浸潤,支氣管管腔規則,黏膜上皮、肌層結構正常;B組可見大量炎癥細胞浸潤,支氣管黏膜破壞,基底膜增厚,平滑肌細胞增殖,杯狀細胞表達增加,黏液分泌增加;C、D兩組可見炎癥細胞浸潤,黏膜破壞,杯狀細胞表達增加,黏液分泌也有增加,但與B組比較明顯減輕(見圖1)。

圖1 小鼠肺組織病理像
三、自噬相關基因表達水平
Western Blot與RT-PCR法分析結果顯示,與A組比較,B組LC3 Ⅱ/Ⅰ、Atg5 mRNA、Beclin1mRNA表達水平增加,差異均有統計學意義(P<0.05);與B組比較,C、D兩組LC3 Ⅱ/Ⅰ、Atg5 mRNA、Beclin1 mRNA表達水平增加,D組變化更明顯,差異具有統計學意義(P<0.05)(見圖2、表2)。

圖2 小鼠肺組織微管相關蛋白l輕鏈3(LC3 Ⅱ/Ⅰ)水平變化
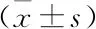
表2 各組自噬相關基因表達水平
四、信號通路蛋白表達水平
Western Blotting法結果分析顯示,與A組比較,B組通路蛋白p-mTOR/mTOR表達降低,差異均有統計學意義(P<0.05);與B組比較,C、D兩組p-mTOR/mTOR蛋白表達進一步降低,D組變化更明顯,差異具有統計學意義(P<0.05)(見圖3、4)。

圖3 各組小鼠肺組織自噬信號通路蛋白表達水平

圖4 各組小鼠肺組織自噬信號通路蛋白表達水平
討 論
細胞自噬是指錯誤折疊的蛋白質和受損的細胞器通過溶酶體依賴性途徑被降解,該過程涉及Atg5, Atg7,Atg12, Beclin1等,LC3 II/I比例是檢測自噬水平高低的金標準[3-4]。自噬蛋白可能影響程序性細胞死亡、炎癥、細胞增殖、先天免疫功能等;同時,細胞自噬在維持細胞內穩態方面發揮重要作用,它為細胞更新修復提供原料與營養,保持能量穩態[4-5]。現研究磷脂酰肌醇-3激酶/蛋白激酶B(PI3K/AKT/mTOR)通路是影響細胞自噬的重要信號通路之一,PI3K可以通過其下游分子AKT、mTOR磷酸化調節自噬[5-6]。哺乳動物雷帕霉素靶蛋白(m TOR)是一種在進化上保守的絲氨酸/蘇氨酸蛋白激酶,其包括mTORC1和mTORC1兩種復合物,它是細胞內的中心信號調節因子,受能量狀態、氨基酸、生長因子、激素、氧化應激等多種因素調節。總之,m TOR通路在炎癥、細胞凋亡、腫瘤等過程中發揮重要作用。此外, RAS-PKA信號通路、LKB1-AMPK通路、MAPK-JNK通路也參與了自噬調節[7-8]。
哮喘是由多種細胞和細胞組分參與的慢性氣道炎癥疾病,同時,它也是一種Th2途徑占主導作用的免疫性疾病。現大量研究表明哮喘氣道炎癥過程還伴隨細胞自噬水平增加。通過電鏡人們發現哮喘患者成纖維細胞和氣道上皮細胞自噬體形成增多[9]。Ban GY等發現哮喘患者外周血嗜酸性粒細胞、嗜中性粒細胞有較高的自噬水平[10]。研究還發現,與正常對照組小鼠比較,OVA激發的哮喘組小鼠肺組織自噬蛋白LC3、嗜酸性粒細胞自噬體顯著增加[11]。該實驗也發現了類似結果。與A組相比,B組小鼠肺組織中LC3-Ⅱ/Ⅰ、Atg5 mRNA、Beclin1 mRNA表達水平顯著增加,p-mTOR/t-mTOR通路蛋白表達降低。近年來,Suzuki 等[12]發現敲除自噬基因可誘導哮喘嗜中性粒細胞氣道炎癥和氣道高反應性,牟艷等[13-14]發現給予自噬誘導劑雷帕霉素處理后小鼠哮喘氣道炎癥得到緩解,可能與自噬水平增加有關。總之,自噬的激活代表對氧化應激等的一種重要防御反應,它通過先天性和適應性免疫,在宿主防御中發揮多功能作用[7,15]。在肺疾病中,已有研究證明細胞自噬在一定程度上對哮喘氣道炎癥具有保護作用。
辛伐他汀是一種半合成的他汀類降脂藥物,它還可抗炎、抗氧化、免疫調節、抗凋亡等,現大量研究表明它還具有自噬調控作用。在帕金森、阿爾茨海默癥、腦出血等神經系統疾病中,辛伐他汀可以通過mTOR信號通路上調細胞自噬從而發揮神經元保護作用[16];心血管疾病方面,辛伐他汀通過抑制Rac1-m TOR通路增加細胞自噬,從而防止冠狀動脈肌細胞增殖和生長,同時還可通過增強氧化型低密度脂蛋白誘導的巨噬細胞自噬,減弱脂質聚集[17];現有研究表明辛伐他汀可通過增強自噬來改善口腔種植體骨結合,改善肌營養不良患者的生理功能[18-19]。同樣,該實驗通過建立哮喘模型發現辛伐他汀具有自噬調控作用,給予辛伐他汀干預后,小鼠肺組織炎癥、細胞自噬水平、信號通路蛋白發生了重要變化,且與辛伐他汀劑量有關。該實驗研究發現,與B組比較,C、D兩組LC3-Ⅱ/Ⅰ、Atg5 mRNA、Beclin1 mRNA表達進一步增加,p-mTOR/t-mTOR通路蛋白表達降低,且辛伐他汀劑量越大細胞自噬水平越高,mTOR信號通路蛋白表達越低,哮喘氣道炎癥緩解越明顯。該研究表明,通過抑制mTOR通路上調細胞自噬,可能是辛伐他汀治療哮喘的潛在機制之一。
綜上所述,細胞自噬與哮喘氣道炎癥密切相關,在一定程度上具有保護性作用。辛伐他汀通過mTOR信號通路調控自噬可能是其改善哮喘氣道炎癥的機制之一,但該研究仍存在較多局限性,如動物數量少、對照組不充分等,需進行更多的實驗以進一步研究。

