消風宣竅湯對變應性鼻炎豚鼠免疫調節作用研究
夏 晨 汪受傳 李 萌 魏肖云
變應性鼻炎(allergic rhinitis,AR)是由于變應原刺激特應性個體,導致鼻黏膜產生IgE,進而使得各種免疫細胞共同作用的I 型變態反應,屬于祖國醫學中“鼻鼽”范疇。近年來,AR 患病率逐漸增加。目前西醫多使用鼻用糖皮質激素、第二代抗組胺藥等來控制AR癥狀,但停藥后癥狀容易復發;而中藥治療既可減輕AR癥狀,還能改善機體免疫功能,受到越來越多學者的關注。汪受傳教授從“伏風”論治,自擬消風宣竅湯治療小兒鼻鼽,臨床效果好,不良反應少,有獨特的優勢[1]。前期研究已經證實,消風宣竅湯治療兒童AR的作用機制與免疫調節相關[2]。本實驗以AR 模型豚鼠為實驗對象,進一步探究其免疫調節的作用機制。
1 材料與方法
1.1 實驗動物40 只Hartley 豚鼠,體重(300±35)g,清潔級,4~5 w齡,雄性,來源于南京中醫藥大學實驗動物中心,動物許可證號為SCXK(蘇)(2012-0008)。
1.2 藥品與試劑(1)消風宣竅湯(由炙麻黃3 g、桂枝3 g、辛夷3 g、蒼耳子6 g、五味子6 g、烏梅6 g、膽南星6 g、廣地龍6 g組成),來源于南京中醫藥大學附屬醫院中藥房制成濃縮濾液,生藥含量為1.05 g/mL;(2)氯雷他定來源于上海先靈葆雅制藥有限公司(批號為10KRXF1047),規格為10 mg/片,用蒸餾水稀釋為0.1 g/mL;(3)卵白蛋白(OVA)來源于美國Sigma 公司(批號為326A05);(4)氫氧化鋁凝膠來源于上海美興化工有限公司(批號為2008050);(5)酶聯免疫吸附(ELISA)檢測試劑盒來源于美國R&D 公司(批號為201304)。
1.3 儀器與設備DMIL 型倒置顯微鏡來源于德國Leica 公司;EXL 800 型酶標儀來源于美國BioTek公司。
1.4 分組、建模及給藥40只Hartley 豚鼠被隨機分成正常組、模型組、消風宣竅湯組、氯雷他定組,每組10 只。在正式試驗之前,將每只豚鼠鼻腔分泌物行Wright染色,觀察嗜酸性粒細胞(EOS)的分布情況,發現染色結果均為陰性。除正常組外,其余3 組采用OVA 模型的建立方法[3]制備豚鼠變應性鼻炎模型,并用鼻部分泌物EOS分布情況、鼻部癥狀行為學評分評估造模成功與否(局部致敏30 min,若鼻腔分泌物涂片EOS 陽性且鼻部癥狀行為學評分總分>5 分,表示AR 豚鼠模型構建成功)。待造模成功,按照1歲兒童臨床等效劑量并根據《藥理試驗方法學》公式進行人和動物給藥劑量的換算,消風宣竅湯組等效劑量為14 g/(kg·d),氯雷他定組等效劑量為1.88 mg/(kg·d)。給藥方式為消風宣竅湯組、氯雷他定組每只豚鼠每8 h灌胃1次,每日2次;AR模型組、正常組則按照相同次數、方法給予相等量的生理鹽水。共灌胃7 d。
1.5 觀察指標
1.5.1 鼻部行為學觀察 給藥7 d 后,對豚鼠給予致敏物,給致敏物即開始計時,共計時30 min,觀察各組豚鼠鼻部癥狀、行為,根據過敏反應行為的評分標準評分[3]:噴嚏次數1~3 次為1 分,4~10 次為2 分,≥11次為3分;擦鼻次數1~4次為1分,4次以上為4分;清涕流至前鼻孔為1 分,超出前鼻孔為2 分,涕流滿面為3分。
1.5.2 鼻黏膜分泌物陽性細胞計數 鼻部行為學觀察后,將每只豚鼠鼻腔分泌物涂片滴加Wright 染色液,油鏡下每張涂片觀察10 個視野(視野倍數:10×40),分別計算嗜酸性粒細胞(EOS)和肥大細胞(MC)的比率。
1.5.3 免疫指標 鼻黏膜分泌物涂片后,麻醉豚鼠,采頸動脈血5 mL,以3000 r/min離心10 min,分離出血清,并于-70 ℃冰箱保存。用雙抗體夾心酶聯免疫吸附法(ELISA)分別檢測四組豚鼠的血清IgE、組胺及Th1、Th2、Th17細胞相關細胞因子水平。
1.5.4 病理指標 豚鼠取血后處死,取出其鼻腔黏膜組織,在4%多聚甲醛溶液中固定72 h,依次經過75%-85%-95%-100%梯度酒精脫水、二甲苯透明、常規石蠟包埋。以4~5 μm切片,最后行HE染色,觀察高倍鏡下各組豚鼠的鼻黏膜組織學改變情況,并進行病理變化分級評分[3]。
1.6 統計學方法采用SPSS 16.0 統計軟件進行處理。數據以均數±標準差(-x±s)表示。采用單因素方差分析進行組間比較,采用Bonferroni 法進行兩兩比較。P<0.05表示有統計學差異。
2 結果
2.1 豚鼠死亡情況實驗過程中,共死亡10 只豚鼠。正常組不明原因死亡1只;模型組因鼻塞嚴重死亡2只;消風宣竅湯組因鼻塞死亡1只;氯雷他定組因鼻塞死亡1 只、不明原因死亡1 只。治療結束后各組豚鼠數量如下:正常組9 只,模型組8 只,消風宣竅湯組9只,氯雷他定組8只。經比較,各組豚鼠死亡數量差異無統計學意義(P>0.05)。
2.2 各組豚鼠鼻部癥狀行為學評分比較模型組的各項癥狀及癥狀積分明顯高于正常組,差異有統計學意義(P<0.05)。與模型組相比,消風宣竅湯組與氯雷他定組的各項癥狀及癥狀積分均明顯降低,差異有統計學意義(P<0.05);而消風宣竅湯組與氯雷他定組相比,差異無統計學意義(P>0.05)。見表1。
表1 各組豚鼠鼻部癥狀行為學評分比較(分,)
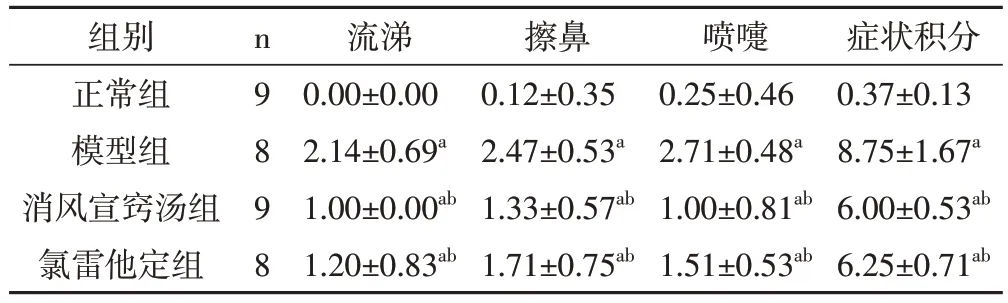
表1 各組豚鼠鼻部癥狀行為學評分比較(分,)
注:與正常組相比,aP<0.05;與模型組比較,bP<0.05
2.3 各組豚鼠鼻黏膜分泌物陽性細胞計數比較和正常組比較,模型組豚鼠鼻腔分泌物中EOS、MC計數均有明顯升高,差異有統計學意義(P<0.05)。和模型組比較,消風宣竅湯組和氯雷他定組兩種陽性細胞計數值均明顯降低,差異有統計學意義(P<0.05);而消風宣竅湯組與氯雷他定組相比,差異無統計學意義(P>0.05)。見表2。
表2 各組豚鼠鼻黏膜分泌物EOS、MC計數比較()

表2 各組豚鼠鼻黏膜分泌物EOS、MC計數比較()
注:和正常組相比,aP<0.05;和模型組比較,bP<0.05
2.4 各組豚鼠血清IgE、組胺水平比較模型組豚鼠血清IgE、組胺水平較正常組明顯升高,差異有統計學意義(P<0.05)。和模型組相比,消風宣竅湯組與氯雷他定組豚鼠血清IgE、組胺水平顯著降低,差異有統計學意義(P<0.05);消風宣竅湯組較氯雷他定組下降更明顯,差異有統計學意義(P<0.05)。見表3。
表3 各組豚鼠血清IgE、組胺水平比較()
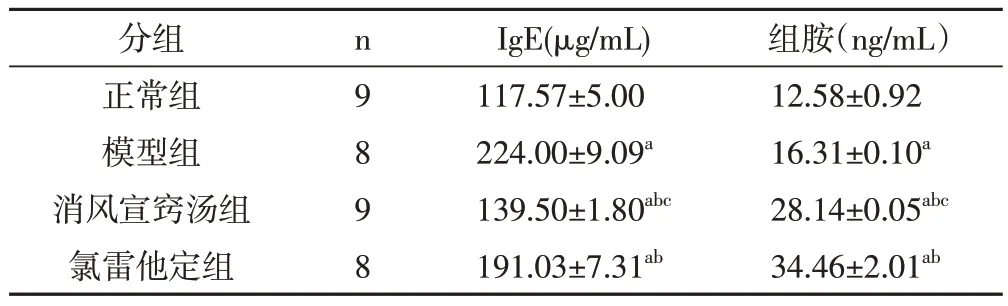
表3 各組豚鼠血清IgE、組胺水平比較()
注:和正常組相比,aP<0.05;和模型組比較,bP<0.05;和氯雷他定組比較,cP<0.05
2.5 各組豚鼠Th1、Th2、Th17細胞相關細胞因子水平比較與正常組相比,模型組豚鼠血清中的NFκB、IL-4、IL-6、IL-17 水平均明顯升高,IFN-γ、IL-12水平明顯降低,差異有統計學意義(P<0.05)。與模型組相比,消風宣竅湯組及氯雷他定組豚鼠血清中NFκB、IL-4、IL-6、IL-17 水平均顯著降低,IFN-γ、IL-12水平明顯升高,差異有統計學意義(P<0.05)。消風宣竅湯組與氯雷他定組各細胞因子水平相比,差異無統 計學意義(P>0.05)。見表4。
表4 各組豚鼠血清中Th17、Th1、Th2 細胞相關細胞因子水平比較()

表4 各組豚鼠血清中Th17、Th1、Th2 細胞相關細胞因子水平比較()
注:和正常組相比,aP<0.05;和模型組比較,bP<0.05
2.6 各組豚鼠病理組織評分比較正常組的豚鼠鼻黏膜組織結構基本正常,HE 染色未見EOS。模型組鼻黏膜組織上皮細胞壞死脫落或化生,固有層組織水腫,大量EOS浸潤,腺體增生明顯,病理組織評分明顯高于正常組,差異有統計學意義(P<0.05)。消風宣竅湯與氯雷他定組的上述病理學改變均有所減輕,鼻黏膜組織炎性反應明顯減輕,黏膜血管輕度擴張,稍有水腫,病理組織評分明顯低于模型組,差異有統計學意義(P<0.05)。消風宣竅湯組與氯雷他定組的病理組織評分比較,差異無統計學意義(P>0.05)。見表5。
表5 各組豚鼠鼻黏膜病理組織評分比較(分,)
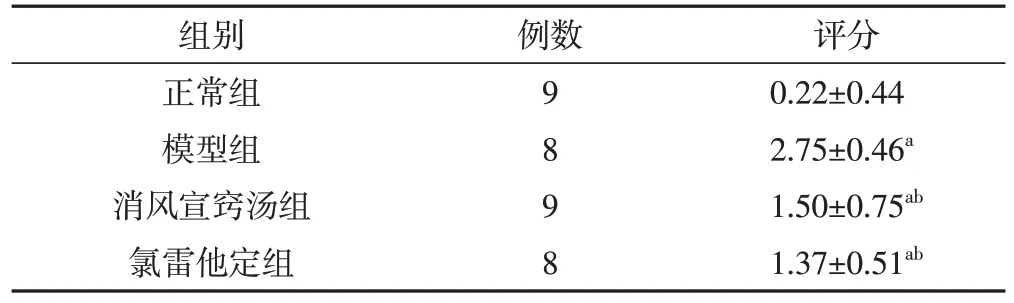
表5 各組豚鼠鼻黏膜病理組織評分比較(分,)
注:和正常組相比,aP<0.05;和模型組比較,bP<0.05
3 討論
AR 已經成為兒童主要呼吸道慢性炎癥性疾病,有報道[4]顯示2016 年美國兒童變應性鼻炎的自報患病率達到40%,確診患病率為13%。2020年內蒙古12個市6~18歲兒童青少年變應性鼻炎的標化自報患病率為18.20%,標化確診患病率為9.71%[5]。盡管有很多治療AR 的西藥,如抗組胺藥、鼻用糖皮質激素、鼻減充血劑和肥大細胞穩定劑等,但長期治療的不良反應多,復發率高。因此,對改善過敏癥狀的新方法或替代方法的需求日益增加。臨床研究顯示消風宣竅湯不僅可治療患兒變應性鼻炎發作癥狀,而且可以逐步改善患兒過敏體質,減少鼻鼽反復發作,長期應用不良反應少[6],但其作用機制尚不清楚。本研究通過實驗研究初步探討了消風宣竅湯治療AR的免疫作用機制。
AR 是以IgE 明顯升高為特征的I 型變態反應疾病,發病機制復雜,重要原因之一為Th1/Th2 平衡失調。糾正Th1/Th2細胞的分化、Th1/Th2細胞因子分泌的失衡,可有效抑制變應性炎癥反應。IL-4為Th2細胞重要的特征因子之一,可以誘導免疫球蛋白IgM至IgE 的同型轉換,使得MC 的脫顆粒作用增強。通過Pearson相關性分析表明,AR感染后血清IL-4水平與其SFAR、VAS 評分以及外周血清IgE 均呈正相關[7]。IFN-γ 能激活巨噬細胞,促進靜止的Th0 細胞向Th1細胞的分化,還能抑制Th2 細胞的增殖[8]。IL-4 和IFN-γ 的表達異常提示Th 細胞的分化偏移。IL-4 逐漸增多和IFN-γ 減少,乃是變應性鼻炎機體內IgE 合成增多的主要機制,INF-γ 在AR 炎癥早期發生可能起主導作用,而IL-4在晚期發展可能發揮主要作用[9]。IL-6是Th2細胞分泌的另一種重要的細胞因子,參與多種靶細胞黏附和集聚,并具有重要的免疫調節功能,可提示氣道炎癥的活躍程度,促進氣道炎癥的發生和氣道結構重建。研究證實IL-6 在CRS 的鼻腔黏膜高表達[10]。IL-12 是誘導Th0 向Th1 細胞分化的重要因素,可促進產生Th1型細胞因子,并抑制Th2型細胞因子,還可以通過抑制IL-4發育從而拮抗Th2型細胞應答。IL-12為誘導產生IFN-γ的最主要的細胞因子[11]。當血清IL-12過高表達時,EOS分化、生成得到抑制,使進入靶組織的EOS 和T 細胞減少,進一步抑制由IgE 介導的I 型變態反應,改善AR 癥狀[12]。NFκB參與炎癥和免疫反應,并起樞紐作用,可調節各類炎癥遞質和免疫因子之間的級聯放大連鎖效應,因此抑制其激活可有效防止AR的產生[13]。NF-κB表達增加,可誘發Th2 細胞因子IL-4 等分泌,從而促進B 淋巴細胞合成IgE,同時增強EOS 的黏附聚集[14]。Th17細胞可上調Th2 細胞介導的嗜酸性氣道炎癥,IL-17是其分泌的特征性細胞因子,可增強氣道平滑肌收縮和氣道上皮細胞對變應原的通透性[15]。IL-17可增加氣道上皮細胞黏液的表達,并通過NF-κB依賴通路激活黏液蛋白基因表達和蛋白生成[16]。炎癥性疾病和自身免疫性疾病發生可能與IL-17過度產生有關。
本研究顯示,消風宣竅湯治療后可減輕豚鼠流涕、擦鼻、噴嚏等AR 癥狀,顯著減少鼻腔分泌物中EOS和MC計數,降低血清中IgE、組胺水平,證實了消風宣竅湯可以減輕局部免疫反應,起到抗炎、抗過敏的作用,并可以改善鼻黏膜的病理損傷。其中消風宣竅湯治療后豚鼠血清IgE、組胺水平下降較氯雷他定組更為明顯,提示消風宣竅湯抗過敏方面可能更有優勢。AR感染前,各細胞因子之間相互聯系、協調及作用,Th1 和Th2 則通過這些細胞因子的變化保持著動態平衡。臨床證實AR感染后,存在Th1/Th2平衡被破壞及Th17 細胞比例升高的情況[17]。本研究通過豚鼠感染前后細胞因子情況的對比,得到了類似的結論,并通過觀察Th17、Th1、Th2細胞分泌的不同細胞因子的水平變化,證實消風宣竅湯治療后可以降低豚鼠血清Th2 相關細胞因子IL-4、IL-6 含量,增高Th1 分泌IFN-γ、IL-12 相關細胞因子的含量,同時抑制了血清NF-κB、Il-17 表達,其細胞因子的水平變化較氯雷他定組無顯著差異。通過本次實驗研究,推測消風宣竅湯治療變應性鼻炎模型可能通過降低機體Th2 相關細胞因子含量,同時升高Th1 相關細胞因子含量,來抑制Th2 免疫反應,增強Th1 的免疫反應,糾正Th1/Th2 免疫失衡來治療疾病,也提示調節機體中Th1/Th2、IL-17 免疫平衡狀態成為該疾病新的治療方向[18]。

