丹酚酸A通過調節氧化應激抑制LPS誘導的人臍靜脈血管內皮細胞NLRP3炎性小體的表達
張淼 鄧悅 于克英 常麗萍 田騰輝 石銳 邵笑
動脈粥樣硬化(atherosclerosis,AS)是由于膽固醇物質的過度沉積從而導致動脈硬化及管腔狹窄,進而在動脈壁上累積聚集形成AS[1]。炎癥反應是AS的主要病因之一[2]。其中脂質沉積及炎性因子的釋放能夠造成內皮損傷、平滑肌細胞遷移及巨噬細胞極化,進而導致細胞外基質擴張,形成纖維帽,促進動AS斑塊的形成[3]。
丹酚酸A(salvianolic acid A,Sal A)是唇形科植物丹參(SalviamiltiorrhizaBge.)的根莖中的主要活性成分,具有抑制氧化應激、抗炎、調節脂質代謝、保護血管內皮功能等作用[4],但尚未明確其對血管內皮細胞及炎性小體的影響和機制。因此本研究采用脂多糖(lipopolysaccharide,LPS)作用于人臍靜脈內皮細胞(human umbilical vein endothelial cells,HUVECs)造成炎性損傷,觀察Sal A對HUVECs中活性氧(reactive oxygen species,ROS)含量及炎性小體相關指標的表達的影響,旨在明確Sal A對HUVECs損傷保護作用,為中醫藥預防和治療AS提供科學依據。
1 材料與方法
1.1 實驗細胞
HUVECs(武漢普諾賽生命科技有限公司)培養于DMEM培養基中(含10%胎牛血清及1%雙抗),培養箱條件:37℃,5%CO2。
1.2 主要試劑和儀器
Sal A(索萊寶公司,批號:200D301);LPS(索萊寶公司,批號:820F038);胎牛血清(美國Clark公司,批號:FB25025);青鏈霉素雙抗(美國Hyclone 公司,批號:SV30010);磷酸鹽緩沖溶液(美國Hyclone 公司,批號:AC10257442);CCK-8試劑盒(索萊寶公司,批號:CA1210,);ELISA試劑盒(上海優選生物公司,批號:T1320);ROS檢測試劑盒(碧云天生物技術公司,批號:S0033);總RNA提取試劑盒(天根生化科技有限公司,批號:DP419);RIPA裂解液(碧云天生物技術,批號:R0010);BCA蛋白濃度測定試劑盒(碧云天生物技術,批號:P0012);NLRP3一抗(美國CST 公司,批號:13158);ASC一抗(美國CST公司,批號:13833);GAPDH一抗(美國CST公司,批號:5174);辣根過氧化物酶二抗(Proteintech 公司,批號:SA00001)。
超凈工作臺(蘇州凈化有限公司);CO2細胞培養箱(美國Thermo公司);酶標儀(瑞士Tecan公司);RT-PCR儀(美國伯樂公司);智能成像系統(iBright,FL1000)。
1.3 CCK-8檢測細胞活力
取對數生長期HUVECs細胞以每孔約1×104個接種于96孔板中,將細胞分為對照組、模型組、不同濃度Sal A組(6.25、12.5、25、50、100、200 μmol/L)及空白組(不含細胞)。待細胞完全貼壁后,棄培養基,對照組、空白組每孔加100 μL正常培養基,其余每孔加入含LPS(濃度1 μg/mL)的培養基100 μL以誘導炎性反應,培養4小時后,吸去培養基,對照組、模型組及空白組加入100 μL的正常培養基,各Sal A組分別加入濃度為6.25、12.5、25、50、100、200 μmol/L 的Sal A培養基,培養24小時后,每孔加入10 μL的CCK-8溶液,于培養箱中孵育2小時,在450 nm波長下測定吸光度(optical density,OD),并計算細胞活力。細胞活力(%)=(給藥組-空白組)OD值/(對照組-空白組)OD值×100%,共測3次。
1.4 酶聯免疫吸附法檢測HUVECs中炎性因子腫瘤壞死因子-α(transforming necrosis factor-α,TNF-α)、白細胞介素-1β(interleukin-1β,IL-1β)的表達
取對數生長期HUVECs細胞以每孔約1×105個接種于6孔板中,將細胞分為:對照組、模型組、Sal A低劑量組、Sal A中劑量組及Sal A高劑量組。待細胞完全貼壁后,棄培養基,對照組加1 mL正常培養基,其余每孔加入含脂多糖(濃度1 μg/mL)的培養基1 mL以誘導炎性反應,培養4小時后,吸去培養基,對照組、模型組加入1 mL正常培養基,Sal A低劑量組、中劑量組及高劑量組分別加入濃度為6.25、12.5、25 μm/L 的SalA培養基1 mL,24小時后,將各組孵育后的細胞上清液以3000 r/分鐘,離心10分鐘除去顆粒和聚合物,嚴格并按照酶聯免疫吸附法試劑盒說明書進行測定,共檢測3次。
1.5 活性氧ROS檢測
取對數生長期HUVECs細胞以每孔約1×105個接種于6孔板中,分組及給藥同1.4;收集細胞后,嚴格按照ROS試劑盒說明書進行操作以測定各組細胞中活性氧ROS含量,檢測3次。
1.6 實時熒光定量PCR檢測含NLP家族Pyrin域蛋白3重組蛋白(recombinant NLR Family Pyrin domain containing protein3,protein3,NLRP3)、凋亡相關斑點樣蛋白(adaptor protein apotosis speck-like protein containing CARD,ASC)、半胱氨酸天冬氨酸蛋白酶-1(Caspase-1)、白細胞介素(interleukin,IL)-18、IL-1β mRNA表達
取對數生長期HUVECs細胞以每孔約1×105個接種于6孔板中,分組及給藥同1.4,培養24小時后棄培養基,每孔加入1 mL RNA裂解液,按試劑盒步驟提取總RNA,檢測RNA濃度及純度,合格后轉錄為cDNA,繼而進行實時熒光定量PCR擴增(擴增條件:95℃,30 s,95℃,5 s,60℃,30 s,40個循環),最后用2-ΔΔCT計算各目的基因的表達變化,檢測3次。PCR引物序列見表1。

表1 引物序列
1.7 蛋白免疫印跡檢測NLRP3、ASC蛋白表達
取對數生長期HUVECs細胞以每孔約1×105個接種于6孔板中,分組及給藥同1.4,培養24小時后棄培養基,給予RIPA裂解液提取總蛋白,BCA法測定各組細胞蛋白濃度后將濃度調平;配置6%及12%分離膠,5%濃縮膠,各組蛋白等量上樣進行電泳,轉膜,5%脫脂奶粉室溫封閉1小時,4度一抗(1∶1000)封閉過夜,后經二抗(1∶2000)室溫孵育1小時;超敏ECL試劑盒顯色,成像儀拍照。使用Image J軟件帶進行灰度值分析,目的蛋白均以GAPDH為內參,每個指標測定3次。
1.8 統計學方法
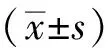
2 結果
2.1 Sal A對HUVECs細胞活性的影響
與對照組比較,模型組在LPS刺激后細胞活性顯著下降(P<0.05);與模型組比較,Sal A各組在一定范圍內以濃度依賴方式提高細胞活性,當濃度為25 μm/L時效果最明顯(P<0.05)。見表2。

表2 Sal A對HUVECs細胞活性的影響
2.2 Sal A對HUVEC細胞TNF-α、IL-1β表達的影響
CCK-8檢測細胞活性結果提示,Sal A濃度為25 μm/L時,細胞活性升高最為顯著,故以LPS 1 μg/mL +Sal A 25μmol/L為高劑量組,LPS 1 μg/mL +Sal A 12.5μmol/L為中劑量組,LPS 1 μg/mL +Sal A 6.25 μmol/L為低劑量組。酶聯免疫吸附法檢測結果表示:與對照組比較,模型組TNF-α、IL-1β含量顯著增高(P<0.05);與模型組比較,Sal A低劑量組、中劑量組及高劑量組中TNF-α、IL-1β表達顯著下降(P<0.05)。見表3。

表3 Sal A對HUVECs細胞TNF-α、IL-1β表達的影響
2.3 Sal A對HUVECs細胞ROS表達的影響
與對照組比較,模型組ROS表達顯著升高(P<0.05);與模型組比較,Sal A低、中、高劑量組ROS表達均有所降低(P<0.05)。見表4。
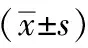
表4 Sal A對HUVECs細胞ROS表達的影響
2.4 Sal A對HUVECs細胞NLRP3、ASC、Caspase-1、IL-1β、IL-18 mRNA表達水平的影響
與對照組相比,模型組NLRP3、ASC、Caspase-1、IL-1β、IL-18 mRNA的表達量升高(P<0.05);與模型組相比,Sal A低、中、高劑量組中NLRP3、ASC、 Caspase-1、IL-1β、IL-18 mRNA表達水平均降低(P<0.05)。見表5。

表5 Sal A對HUVEC細胞NLRP3、ASC、Caspase-1、IL-1β、IL-18 mRNA表達水平的影響
2.5 Sal A對HUVECs細胞NLRP3、ASC蛋白表達水平的影響
與對照組相比,模型組NLRP3、ASC 蛋白表達量升高(P<0.05);與模型組相比,各濃度Sal A組中NLRP3、ASC 蛋白表達水平均降低(P<0.05)。表6、見圖1。

表6 丹酚酸A對HUVECs細胞NLRP3、ASC蛋白表達水平的影響

注:A 對照組;B 模型組;C Sal A低劑量組;D Sal A 中劑量組;E Sal A高劑量組。
3 討論
NLRP3炎性小體的結構包括受體蛋白NLRP3、凋亡相關斑點蛋白ASC及效應蛋白Caspase-1以三部分[5]。當NLRP3炎性小體激活后,半胱氨酸天冬氨酸蛋白酶的無活性前體pro-Caspase-1,在ASC的作用下聚集并被水解為具有生物活性的Caspase-1,繼而Caspase-1將無活性的pro-IL-1β和pro-IL-18,剪切為炎性因子IL-1β、IL-18,從而發細胞焦亡[6]。研究表明,與正常組織比,人頸動脈斑塊中NLRP3、ASC、IL-1β和IL-18 mRNA表達顯著增高[7]。目前研究認為NLRP3炎癥小體激活的機制復雜,大致可分為以下三種方式:(1)離子再分布,當細胞外ATP含量升高,P2X嘌呤受體7(P2X7)信號通路介導離子通道開放,從而促進K+外流,NLRP3炎性小體在鉀離子通量發生改變時被激活[8];(2)溶酶體損傷,當胞外晶體或特殊顆粒如蛋白聚集體等進入細胞內后,引起溶酶體破裂,在多種組織蛋白酶作用于細胞膜,促進鉀離子外流,進而促進NLRP3炎癥體的聚集和激活;(3)ROS的產生,ROS作為NLRP3炎性小體形成和激活的關鍵因素,可依賴PAMPs和DAMPS通過ROS依賴的信號通路產生,當ROS的產生和清除失衡時,引起氧化應激,進而導致DNA損傷、脂質過氧化和蛋白質的氧化修飾[9]。研究表明,線粒體功能障礙,則能夠導致mtROS的產生,激活NLRP3炎性小體,同時氧化的mtDNA也是激活NLRP3炎性小體的原因之一[10]。
內皮功能障礙是AS發生發展的重要因素之一,可通過炎癥、氧化應激及自噬等不同機制參與動脈粥樣硬化的發生。內皮細胞作為NLRP3炎性小體激活后的產物IL-1β的靶細胞之一,當炎癥反應被激活后,內皮細胞功能不僅受到影響,還能夠促進內皮細胞分泌粘附分子和趨化因子以進一步促進炎癥[11]。當NLRP3炎性小體被激活后,其分泌的IL-18和IL-1β能夠引起內皮細胞的氧化應激及炎癥反應,這種由NLRP3炎性小體介導的氧化應激及炎性反應,又會進一步增加DAMPs的釋放,進而形成不良循環。
中藥材丹參常用于預防和治療心血管疾病,其味苦,微寒,具有活血祛瘀,涼血消癰功效,如《本經》言其有主治“心腹邪氣……破癥除瘕”作用。其水溶性酚類化合物Sal A被證實有抗AS、抗炎作用[12-15],但尚無其通過氧化應激調控NLRP3炎性小體的表達作用于血管內皮細胞的研究,因此本實驗探究了推測Sal A的抗氧化應激及抗炎作用,證明了其對氧化應激反應及炎性小體的抑制作用,為中醫藥治療AS提供了科學依據。但炎性小體對AS的作用機制復雜,Sal A是否通過其他信號通路作用于炎性小體及其抗AS的作用具體機制仍需進一步研究。

