大豆斑疹病菌內(nèi)切甘露聚糖酶ManA的功能研究
王宏杰, 孫楚韻, 蘇如意, 田傳玉, 徐江玲,張俊楠, 許夢潔, 郭 威
(浙江師范大學 化學與生命科學學院,浙江 金華 321004)
由大豆斑疹病菌(X.axonopodispv.glycines,Xag)引起的大豆斑疹病(bacterial pustule,BP)是大豆上重要的檢疫性細菌病害[1].該病原菌可侵染大豆葉片、葉柄、莖和豆莢,整個生育期均可引起大豆病害,導致葉片早枯脫落、籽粒皺縮,從而降低大豆經(jīng)濟效益[2-3].
借助Ⅱ型分泌系統(tǒng),植物病原黃單胞菌將多種細胞壁水解酶如內(nèi)切甘露聚糖酶、淀粉酶、纖維素酶等分泌至胞外,破壞細胞壁以便于病原菌在植物上寄生和致病[4-6].內(nèi)切甘露聚糖酶負責隨機切割β-1,4-糖苷鍵,在病原菌與寄主植物互作過程中起重要作用[7].相較于其他細胞壁水解酶,有關植物病原黃單胞菌內(nèi)切甘露聚糖酶的研究鮮有報道.2003年,Dow等[8]研究證實野油菜黃單胞菌(X.campestrispv.campestris,Xcc)8004菌株的內(nèi)切甘露聚糖酶編碼基因manA(XC2458)突變,導致菌株的內(nèi)切甘露聚糖酶活性喪失,在寄主上的致病性、生物膜形成能力相對于野生型均顯著減弱.2010年,Hsiao等[9]研究再次證實,XccXc17菌株的manA基因突變,導致菌株的內(nèi)切甘露聚糖酶活性完全喪失.已有研究表明,Xag具有較高的內(nèi)切甘露聚糖酶活性[10-11],但其編碼基因仍未知.在Xag中,manA是唯一注釋編碼內(nèi)切甘露聚糖酶的基因,但其是否負責Xag的內(nèi)切甘露聚糖酶合成及其他生物學特性,并不知曉.
本研究證實ManA涉及負調(diào)控engXCA和egl2基因的表達,其突變增強菌株的內(nèi)切甘露聚糖酶活性和胞外纖維素酶活性、促使菌株形成膠狀物;但不影響菌株的其他生物學特性,如生物膜形成、胞外多糖合成及蛋白酶和淀粉酶活性.
1 材料和方法
1.1 供試材料
本研究所用菌株和質(zhì)粒列于表1.XagZJ15菌株及其衍生菌株在28 ℃NB(3 g/L牛肉膏,10 g/L蔗糖,5 g/L多聚蛋白胨,1 g/L酵母提取物)中培養(yǎng).培養(yǎng)菌株所用抗生素濃度:羧芐青霉素(Cb)100 μg/mL,卡那霉素(Km)50 μg/mL,壯觀霉素(Sp)100 μg/mL[11].

表1 本研究所用菌株和質(zhì)粒
1.2 缺失突變株構建及功能互補
本研究所用引物列于表2.基于同源重組原理,借助pKMS1自殺載體[12],以Xag野生型菌株ZJ15為出發(fā)菌株,構建內(nèi)切甘露聚糖酶manA基因的缺失突變株,命名為ΔmanA.同時,以pHM1為互補載體[13],構建ΔmanA的功能互補菌株,命名為CΔmanA.
1.3 RNA提取及RT-PCR
將新鮮的各供試菌株培養(yǎng)至OD600≈2.0,富集菌體,洗滌2次;使用RNA抽提試劑(TRIzol)制備各菌株的總RNA,去除基因組DNA;利用反轉錄試劑盒(TaKaRa)將mRNA反轉錄成cDNA;然后采用實時熒光定量PCR試劑盒(TaKaRa)檢測各待測菌株中目標基因的mRNA水平(見表2).

表2 本研究所用引物
1.4 胞外酶活性分析
參照文獻[10]方法,檢測分別以刺槐豆膠、羧甲基纖維素、可溶性淀粉或脫脂牛奶為底物培養(yǎng)基上的各菌株水解能力,分析各菌株的內(nèi)切甘露聚糖酶、纖維素酶、淀粉酶及蛋白酶的活性.
1.5 胞外多糖測定
將新鮮的各供試菌株培養(yǎng)至對數(shù)生長期,收集菌體,滅菌水洗滌2次后調(diào)至OD600≈1.0.吸取2 μL各待測菌液分別接種至含2%葡萄糖或蔗糖的NY固體培養(yǎng)基上,28 ℃培養(yǎng)3~5 d后,觀察結果并拍照記錄[14].
1.6 生物膜測定
參照文獻[15]將等量新鮮的各供試菌株接種至生物膜測定培養(yǎng)基中,28 ℃靜置培養(yǎng)5~7 d后,觀察結果并拍照記錄.
2 結 果
2.1 內(nèi)切甘露聚糖酶ManA在植物病原黃單胞菌中高度保守
內(nèi)切甘露聚糖酶(mannanendo-1,4-β-mannosidase,ManA)屬于第5家族糖基化水解酶,在植物病原細菌中分布較廣.根據(jù)生物信息學分析顯示,XagZJ15,12-2和8ra等菌株中的manA基因序列完全一致,具有100%同源性.此外,XagZJ15菌株的manA基因與柑橘潰瘍病菌(X.axonopodispv.citri,Xac)306菌株的manA基因(XAC1796)、辣椒斑點病菌(X.campestrispv.vesicatoria,Xcv)85-10菌株的manA基因(XCV1826)、水稻條斑病菌(X.oryzaepv.oryzicola,Xoc)BLS256菌株的manA基因(XOC2180)和野油菜黃單胞菌(X.campestrispv.campestris,Xcc)8004菌株的manA基因(XC2458)分別具有99.9%,96.3%,89.2%和81.4%的同源性.這些結果說明,內(nèi)切甘露聚糖酶ManA在植物病原黃單胞菌中高度保守.

圖1 大豆斑疹病菌內(nèi)切甘露聚糖酶基因manA的系統(tǒng)發(fā)育樹
2.2 大豆斑疹病菌內(nèi)切甘露聚糖酶基因manA的缺失突變
為了便于Xag內(nèi)切甘露聚糖酶編碼基因manA的功能研究,以ZJ15菌株為模板,分別擴增毗鄰manA基因的上游片段(644 bp)和下游片段(317 bp),將其順式融合并構入敲除載體pKMS1中,經(jīng)2次同源片段重組交換獲得雙交換子(見圖2a).然后,采用2輪巢式PCR對所獲取的雙交換子進行驗證后發(fā)現(xiàn),2輪PCR擴增所獲取的DNA片段相對于野生型均缺失987 bp(見圖2b).結果表明,實驗獲得了正確的manA基因缺失突變體,命名為ΔmanA,可用于后續(xù)功能研究.
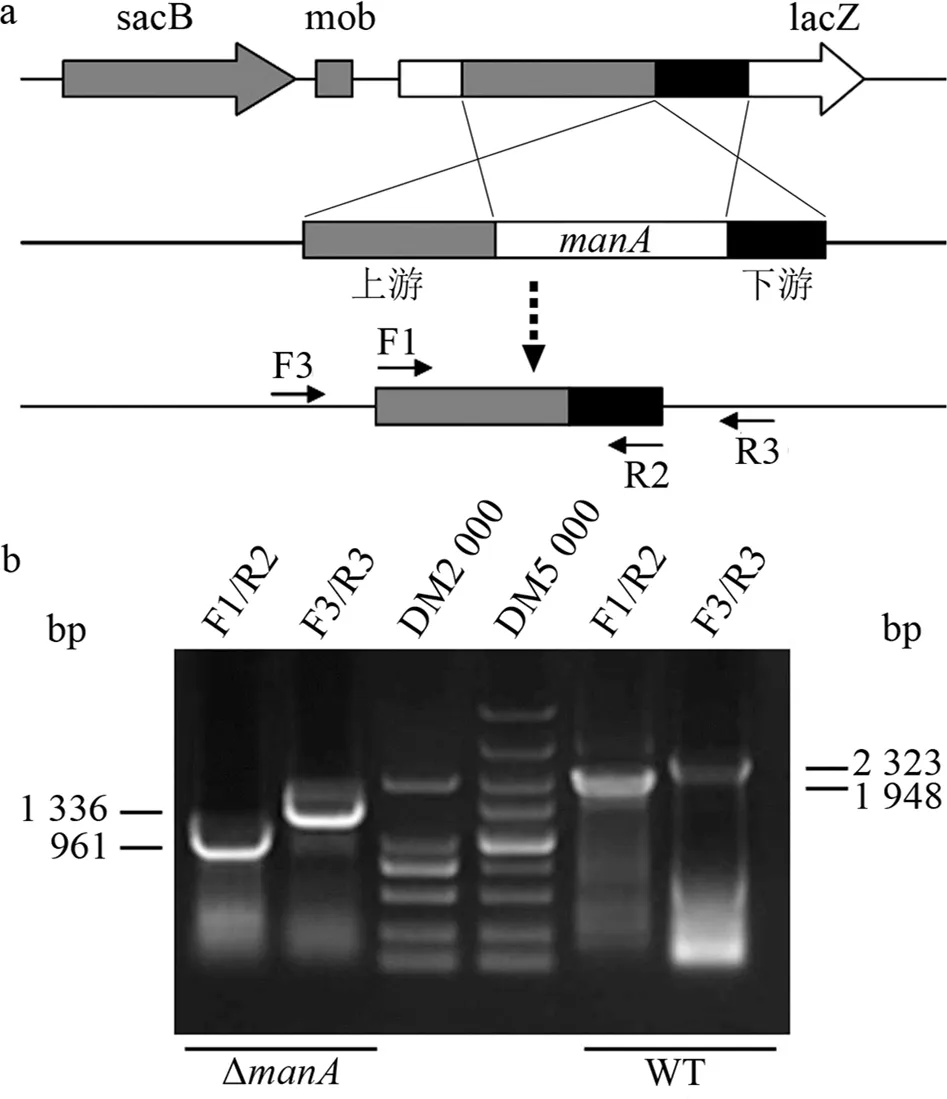
a:manA基因缺失突變的構建示意圖;b:manA基因缺失突變株的PCR驗證
2.3 ManA負調(diào)控大豆斑疹病菌的胞外纖維素酶活性和內(nèi)切甘露聚糖酶活性
為了探究ManA是否參與Xag的胞外纖維素酶活性和內(nèi)切甘露聚糖酶活性,采用平板法定性檢測ΔmanA、CΔmanA和野生型菌株的纖維素酶活性和內(nèi)切甘露聚糖酶活性.結果顯示:在含0.5%羧甲基纖維素或含0.2%刺槐豆膠的NA平板上,ΔmanA菌株相較于野生型均形成明顯較大的水解圈;功能互補使ΔmanA菌株的上述2種胞外酶活性均恢復至野生型水平(見圖3a~3b).這些結果表明,ManA負調(diào)控Xag的胞外纖維素酶活性和內(nèi)切甘露聚糖酶活性.
先前研究證明,engXCA和egl2基因共同控制Xag的胞外纖維素酶合成[16],本研究證實,engXCA和egl2基因也共同決定Xag的內(nèi)切甘露聚糖酶活性(見圖3d~3f).為了探究ManA調(diào)控Xag內(nèi)切甘露聚糖酶活性和胞外纖維素酶活性的方式,借助熒光定量PCR手段分析同時編碼內(nèi)切甘露聚糖酶和胞外纖維素酶的engXCA和egl2基因的表達模式.結果顯示,engXCA和egl2基因在ΔmanA菌株中的表達水平相對于在野生型中均顯著增加(P<0.01)(見圖3c).這些結果表明,ManA負調(diào)控Xag的engXCA和egl2基因的轉錄表達.

a:ΔmanA菌株的胞外纖維素酶活性測定;b:ΔmanA菌株的內(nèi)切甘露聚糖酶活性測定;c:egl2和engXCA基因表達分析;d:Δegl2菌株的內(nèi)切甘露聚糖酶活性測定;e:ΔengXCA菌株的內(nèi)切甘露聚糖酶活性測定;f:ΔengXCAΔegl2菌株的內(nèi)切甘露聚糖酶活性測定
2.4 ManA不參與大豆斑疹病菌的蛋白酶活性和淀粉酶活性
為了探究ManA是否參與Xag的蛋白酶活性和淀粉酶活性,采用平板法定性檢測ΔmanA,CΔmanA和野生型菌株的蛋白酶活性和淀粉酶活性.結果顯示:在含1%脫脂牛奶或含0.2%可溶性淀粉的NA平板上,3個菌株均產(chǎn)生大小相近的水解圈,說明3個菌株水解牛奶或可溶性淀粉的能力基本一致(見圖4).這些結果表明,ManA不參與Xag的蛋白酶活性和淀粉酶活性.
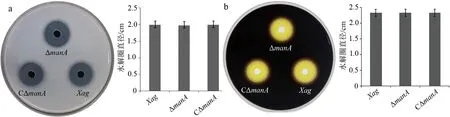
a:ΔmanA菌株的蛋白酶活性測定;b:ΔmanA菌株的淀粉酶活性測定
2.5 內(nèi)切甘露聚糖酶基因manA突變促使菌株形成膠狀物
為了探究ManA是否參與Xag的生物膜形成,分別檢測ΔmanA,CΔmanA和野生型菌株的生物膜形成能力.結果顯示:在試管側壁上,ΔmanA菌株能形成明顯的細菌細胞聚集圈,其形成能力與野生型基本一致(見圖5a).然而,實驗中卻發(fā)現(xiàn)了一種新的表型,即離心后在ΔmanA菌株細胞沉淀的頂部積累了一層透明可見的膠狀物質(zhì),這種現(xiàn)象在CΔmanA和野生型菌株中并未觀察到(見圖5b).這些結果表明,manA突變不影響菌株的生物膜形成能力,但能促使菌株形成膠狀物質(zhì).為了探究ManA是否參與Xag的胞外多糖合成,分別檢測ΔmanA,CΔmanA和野生型菌株的胞外多糖合成能力.結果顯示:3個菌株產(chǎn)生胞外多糖的能力基本一致(見圖5c),表明ManA不參與Xag的胞外多糖合成.

a:ΔmanA菌株的生物膜測定;b:ΔmanA菌株的膠狀物形成;c:ΔmanA菌株的胞外多糖合成分析
3 討 論
在分類上,ManA屬于第5家族糖基化水解酶,它在植物病原細菌中分布較廣[9].在已完成基因組測序的植物病原黃單胞菌中,manA是全基因組中唯一注釋編碼內(nèi)切甘露聚糖酶的基因,在不同菌株間約有81%~100%的堿基同源性(見圖1),說明manA基因在植物病原黃單胞菌中具有高度保守性.然而由目前研究可知,ManA在不同植物病原黃單胞菌中的生物學功能差異顯著,揭示其具有菌株特異性.
有趣的是,與Xcc菌株的ManA功能相悖[8-9],Xag的內(nèi)切甘露聚糖酶基因manA缺失突變,顯著增強菌株的內(nèi)切甘露聚糖酶活性和胞外纖維素酶活性(見圖3a~3b).先前研究報道,EngXCA和Egl2是Xag的2個胞外纖維素酶[16];此外,engXCA和egl2基因在Xoo,Xag基因組中注釋編碼內(nèi)切葡聚糖苷酶(endoglucanase)或內(nèi)切葡聚糖苷酶前體(endoglucanase precursor)[17].基于此,本研究進一步證實:Egl2和EngXCA也共同控制Xag的內(nèi)切甘露聚糖酶活性(見圖3d~3f);ManA涉及負調(diào)控egl2和engXCA基因的表達(見圖3c).由此推斷,manA基因突變導致egl2和engXCA基因的表達水平上調(diào),從而增強菌株的胞外纖維素酶和內(nèi)切甘露聚糖酶活性.這些研究表明,植物病原黃單胞菌內(nèi)切甘露聚糖酶的編碼基因不盡相同,因菌株而異.
ManAXcc能驅散Xcc菌株的生物膜形成[8];然而manAXag基因突變并不影響Xag的生物膜形成和胞外多糖合成(見圖5a和圖5c),但卻能在離心管底部產(chǎn)生一種由于較少或輕量細胞聚集所形成的膠狀物現(xiàn)象(見圖5b),這種現(xiàn)象屬于一種較弱的生物膜形成[18].這表明,ManAXag驅散菌株生物膜形成能力相較于ManAXcc較弱.此外研究發(fā)現(xiàn),manA基因突變顯著削弱病原菌在寄主大豆上的致病性(數(shù)據(jù)未顯示),ManA是如何在Xag與寄主植物親和互作中發(fā)揮毒性作用、是否還參與Xag的其他生物學特性,有待進一步研究.

