二甲雙胍與胃癌細胞的增殖、遷移及上皮-間充質轉化之間的關系*
王文婷 胡楊志 張芡 胡志立 劉力 鄧祖亮
(湘南學院附屬醫院,湖南 郴州 423000)
在世界范圍常見腫瘤中胃癌患病率排名第四位,致死率排名第二[1-2]。研究[3]顯示,胃癌的5年生存率很低,轉移是胃癌預后不良的主要原因之一。上皮-間充質轉化(Epithelial-mesenclymal transformation,EMT)是腫瘤細胞轉移的關鍵步驟。EMT在胃癌的發生和發展過程中起著至關重要的作用。二甲雙胍,也稱為1,1-二甲基雙胍鹽酸鹽,是FDA批準臨床治療2型糖尿病的藥物;且二甲雙胍能夠調節細胞能量代謝,與腫瘤的發病率和死亡率降低相關[4-5]。研究[6-7]顯示,在乳腺癌患者中輔助化療聯合二甲雙胍可以提高治療的完全病理反應率。因此,本研究旨在探討二甲雙胍在胃癌過程中的生物學功能,并試圖探討其是否參與調節胃癌細胞的增殖、遷移及上皮-間充質轉化。
1 材料與方法
1.1 細胞培養與二甲雙胍溶液配制 實驗細胞選用胃癌細胞系AGS細胞,購自美國ATCC。細胞培基為含有10%胎牛血清及1%青鏈霉素混合液的高糖DMEM培養基。培養條件:37℃,5%CO2的恒溫培養箱。試驗中處理細胞所用的二甲雙胍購自中國碧云天生物,在操作臺上用PBS溶解成400 mmol/L保存液,用無菌注射式過濾器過濾,分裝-20℃保存。用不同濃度(0、10、20、40 mmol/L)的二甲雙胍處理胃癌細胞,將細胞分為對照組、二甲雙胍處理組(10、20、40 mmol/L)。
1.2 細胞形態及增殖評估 取生長狀態良好的胃癌細胞按每孔1×106個接種至6孔板中,用不同濃度二甲雙胍(0、10、20、40 mmol/L)處理24 h,棄去培養基用PBS清洗2~3次。用結晶紫染色液對胃癌細胞進行染色,處理30 min棄去染色液,用PBS清洗2~3次后置于倒置顯微鏡下進行拍照,觀察細胞在不同濃度二甲雙胍處理下的細胞密度和狀態。用CCK-8試劑盒(碧云天生物,中國)檢測胃癌細胞增殖活性。取生長狀態良好的胃癌細胞,按1×103/孔的密度接種于96孔板,在37℃下培養24 h后進行二甲雙胍(10、20、40 mmol/L)處理。處理24 h后,將CCK-8試劑加入每個含有孔的細胞中,培養2 h,然后在450 nm處測量吸光度。實驗重復三次。
1.3 細胞遷移評估 采用劃痕實驗評價胃癌細胞遷移能力。收集二甲雙胍(0、10、20、40 mmol/L)處理后的胃癌細胞并重新植入6孔板中。讓細胞在37℃下生長,直到100%融合,然后用移液管在細胞層上小心地劃出一道劃痕。在劃痕后0、24 h分別對細胞生長狀況進行顯微鏡拍照。
1.4 Western blot檢測蛋白水平 不同濃度二甲雙胍(10、20、40 mmol/L)處理后的胃癌細胞PBS清洗2~3次,冰上用RIPA進行裂解得到總蛋白。處理后的胃癌細胞在RIPA緩沖液中裂解后得到總蛋白。用蛋白濃度監測儀imagequantlas Q5000(美國夸威爾)測定提取總蛋白的濃度。將相同量的蛋白質煮沸,用SDS-PAGE方法溶解,然后轉移到PVDF膜上。用5%脫脂牛奶封閉PVDF膜1 h,然后用TBST清洗3次,用一級抗體(1:1000)在4℃下培養過夜。在我們的研究中,免疫印跡用以下抗體進行:E-cadherin(英國abcam,1:1000)、vimentin(英國abcam,1:1000)、GAPDH(abcam,英國,1:1000)。然后用TBST清洗PVDF膜3次,共30 min,辣根過氧化物酶結合的二級抗體(1:2000)孵育1 h。用TBST清洗三次,每次10 min。用imagequantlas500(美國通用電氣公司)對薄膜進行化學發光檢測,并用NIH-Image-J軟件測量其條帶密度。
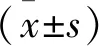
2 結果
2.1 二甲雙胍抑制胃癌細胞增殖活性 倒置顯微鏡拍照顯示,二甲雙胍可以抑制胃癌細胞的密度逐漸降低,且呈濃度依賴性(P<0.0001),見圖1、表1。CCK8檢測細胞增殖活性結果顯示,與對照組比較,二甲雙胍處理組隨濃度增加增殖水平顯著降低,呈濃度依賴(F=27.22,P<0.0001),見圖2。

圖2 不同濃度二甲雙胍對胃癌細胞增殖的影響Figure 2 The effect of different concentrations of metformin on proliferation in gastric cancer cells注:與對照組相比,①P<0.05

表1 二甲雙胍對胃癌細胞增殖的影響Table 1 Effect of metformin on proliferation of gastric cancer cells

圖1 不同濃度二甲雙胍對胃癌細胞增殖的影響Figure 1 The effect of different concentrations of metformin on proliferation in gastric cancer cells
2.2 二甲雙胍抑制胃癌細胞的遷移 使用不同濃度(10、20、40 mmol/L)的二甲雙胍溶液處理胃癌細胞,結果顯示:二甲雙胍處理的胃癌細胞的遷移顯著減慢,且呈濃度依賴性,濃度越大胃癌細胞的遷移越慢(P<0.0001),見圖3。

圖3 不同濃度二甲雙胍對胃癌細胞遷移的影響Figure 3 The effect of different concentrations of metformin on the migration of gastric cancer cells注:與對照組相比,①P<0.05
2.3 二甲雙胍抑制胃癌細胞的上皮-間充質轉換 檢測不同濃度二甲雙胍處理胃癌細胞時,胃癌細胞的E-cadherin和vimentin蛋白表達情況結果顯示,二甲雙胍處理胃癌細胞,顯著降低vimentin蛋白水平,增加E-cadherin蛋白的表達水平,均呈濃度依賴性(均P<0.01),見圖4。提示二甲雙胍可以抑制胃癌細胞的上皮間質轉換,對胃癌的進程可能有一定的抑制作用。

圖4 不同濃度二甲雙胍對胃癌細胞E-cadherin和vimentin蛋白表達的影響 Figure 4 The effect of different concentrations of metformin on the expression of E-cadherin and vimentin proteins in gastric cancer cells注:與對照組相比,①P<0.05
3 討論
在全世界范圍內胃癌是一種致命的疾病,生存率很低,每年新診斷的胃癌主要發生在亞洲和南美國家[8]。在美國,至2020年有27000個新病例出現[9]。在發展中國家,胃癌對人口的影響要嚴重得多。然而,進展期和轉移性胃癌的生存率非常低,攻克這項疾病還很困難。
二甲雙胍作為2型糖尿病的降糖藥物已經使用了很長時間,可以作為單一療法或與其他降糖尿藥物聯合使用[10]。1995年英國進行的一項具有里程碑意義的前瞻性糖尿病研究(UKPDS)證實了二甲雙胍對心血管系統的長期益處[11]。近期,二甲雙胍已用于各個方面的實驗性研究,如生殖醫學、腫瘤化療、代謝性疾病和神經退行性疾病。評估二甲雙胍在腫瘤治療中的相關性研究,關于其抗腫瘤作用,人們提出了不同的機制,包括激活單磷酸腺苷激酶、調節腺苷A1受體、減少胰島素/胰島素生長因子,以及二甲雙胍在抑制內源性活性氧中的作用,此外其對DNA分子的損傷是另一個重要的抗腫瘤機制。關于鹽酸二甲雙胍抗腫瘤的研究[12]表明,二甲雙胍一定程度上能夠抑制肺癌、乳腺癌及消化系統腫瘤的發生與發展。本研究證實二甲雙胍可能降低胃癌中胃癌細胞的增殖、侵襲和遷移能力。
上皮-間充質轉化(EMT)在包括胃癌在內的腫瘤的發生、發展中起著重要作用。在EMT過程中,上皮細胞的各種生化變化會導致細胞極性和遷移能力的喪失,從而導致細胞形態的改變,促使靜止的上皮細胞向運動的間充質細胞轉化,最終加強細胞的轉移[13]。據報道,EMT可導致多種腫瘤的病理遷移和侵襲,其誘發的癌變是胃癌、頸部鱗狀細胞癌和卵巢癌等惡性腫瘤的常見原因[14]。EMT是胚胎發育和器官發生過程中細胞重塑的關鍵過程,參與了腫瘤的發生,并通過增強侵襲性和移動性賦予癌細胞轉移特性[15-16]。研究[17]發現,促進EMT過程的分子機制包括調節特定細胞表面蛋白水平、細胞外基質降解酶和改變某些轉錄因子的表達。我們檢測了與EMT密切相關的生物標記物E-cadherin和vimentin的表達水平,結果顯示二甲雙胍可以顯著降低胃癌細胞中E-cadherin和vimentin蛋白水平,且呈濃度依賴性。近年來,有研究[18]表明大蒜素與IL-33均能抑制胃癌細胞間充質轉化進而抑制胃癌細胞的侵襲與遷移。基于以上結果,我們認為二甲雙胍可能通過誘導EMT促進胃癌的侵襲和遷移。
研究[19]發現,基質金屬蛋白酶(MMPs)能降解上皮細胞重要標志物E-cadherin。EMT的延長與MMP-2活性和MMP-9分泌水平有關,MMPs能夠通過PI3K/AKT通路影響E-cadherin表達調節在包括胃癌在內的多種腫瘤中對EMT的作用[20]。此外,據報道,Wnt/β-catenin信號通路在EMT中起著重要作用。在EMT過程中,E-cadherin的丟失可能會異常激活Wnt/β-catenin信號通路,然后抑制β-catenin的降解,進入細胞核促進Myc等下游靶基因的表達,最終促進腫瘤細胞的侵襲和遷移[21]。這與我們的研究結果一致,E-cadherin和vimentin的表達抑制影響了胃癌細胞的侵襲和轉移。
4 結論
本研究表明,二甲雙胍能夠抑制GC細胞增殖、遷移,其在胃癌轉移中發揮抑制作用,可能與抑制EMT相關,具體的作用通路還需進一步探索。

