丹參酮ⅡA對人膀胱癌J82細胞增殖與凋亡效應及作用機制
戴順 沈瑞林 唐晨野 汪家盛 郭曉
丹參酮類化合物又稱總丹參酮,是從唇形科植物丹參干燥后的根和根莖中提取的一大類脂溶性菲醌類化合物。丹參酮是其中一種所含丹參含量最高的一種成分,不僅對能夠保護人體心血管與神經細胞、改善血液微循環、抵抗慢性肝血管纖維化以及能夠誘導體內干擾素細胞功能發生良性分化等均具有重要的保護作用[1],還具有良好的抗腫瘤活性[2]。前期臨床研究顯示,丹參酮ⅡA 在體外免疫作用中可以有效抑制人體惡性膀胱癌J82細胞的體外增殖,促進其細胞凋亡,且同時降低體外侵襲及細胞遷移時的性能,具有多方面的抗膀胱癌作用[3]。本研究初步探討丹參酮ⅡA抗膀胱癌作用的機制。
1 材料與方法
1.1 細胞株和主要材料 (1)膀胱癌細胞株來源:人膀胱癌J82細胞(中國科學院上海細胞庫)。(2)主要材料:培養基(DMEM)(貨號SH30022.01B,美國Hyclone公司),FBS(貨號S601S-500,德國Sera & Pro公司),丹參酮ⅡA(貨號T4952-5MG,美國Sigma公司),0.25%Trypsin-EDTA細胞消化液(貨號0457,美國Amresco公司),青霉素-鏈霉素雙抗混懸液(貨號15140-122,美國Gibco公司),PBS緩沖液(美國Sigma公司),牛血清蛋白(BSA)粉劑(美國Abcam公司),丙烯酰胺40%溶液、SDS、TEMED(美國Thermo Fisher公司),甘氨酸、Tris base(美國Amresco公司),SDS(美國VWR公司),PNPP(美國Biolab 公司),APS(美國VWR公司),細胞計數試劑盒(CCK-8)、Annexin V-FITC/碘化丙錠(PI)(日本同仁化學研究所),聚偏二氟乙烯(PVDF)膜(美國Millipore公司)。(3)主要抗體:β-actin抗體(武漢賽維爾生物科技有限公司),caspase 3抗體、caspase 9抗體(美國CST)。
1.2 實驗方法 (1)細胞培養:將人膀胱癌J82細胞體外培養,均使用含10%FBS、1%青霉素-鏈霉素雙抗的DMEM(高糖)培養基,將其置于37℃、5%CO2恒溫培養箱中培養。(2)丹參酮ⅡA對J82細胞半數抑制率(IC50)的測定:①將對數生長期J82細胞用0.25%胰蛋白酶消化,配制成細胞懸液,通過細胞計數方式,按2,000~4,000個細胞每孔接種于96孔板,每孔加150μL,設置藥物濃度分別為1、2、3、5、8 μmol/L的實驗組、陰性對照組及空白對照組,每組設4個復孔。將96孔板置于37℃、5%CO2培養箱中培養(過夜貼壁),邊緣孔用無菌PBS填充。②細胞培養1 d后,細胞貼壁完全且穩定生長后對其進行加藥處理。在實驗組中每孔加入相應濃度藥物10μL,陰性對照組及空白對照組每孔加入10μL DMEM培基。③置于培養箱中培養48 h后,每孔加入10μL CCK-8試劑,混勻后再孵育2 h。使用酶標儀測定450 nm光吸收值(OD值)。增殖抑制率=1-(實驗組OD值-空白對照組OD值)/(陰性對照組OD值-空白對照組OD值)×100%。采用Graphpad Prism軟件計算半數抑制濃度(IC50)并繪圖。(2)CCK-8法檢測丹參酮ⅡA對細胞增殖的影響:①將對數生長期J82細胞用0.25%胰蛋白酶消化,配制成細胞懸液,通過細胞計數方式,按2,000~4,000個細胞每孔接種于96孔板,每孔加150μL。設置不加藥物的空白組和加IC50范圍濃度的丹參酮ⅡA藥物處理組,每組設置4個復孔,同時鋪孔5天,邊緣孔以及天數間用無菌PBS填充。②將96孔板搖晃混勻,置于37℃、5%CO2恒溫培養箱中培養,每天同一時間加入10μL CCK-8試劑,混勻后再孵育2 h。使用酶標儀測定450 nm光吸收值(OD值)。(3)流式細胞術檢測細胞周期情況:取對數生長期J82細胞,分別用不同濃度(1、3μmol/L)的丹參酮ⅡA藥作用于細胞,另設一組對照組,更換不含藥物的培養基,每組設3個復孔,繼續培養48 h,觀察細胞生長狀態是否良好,將各組細胞通過無菌PBS清洗、0.25%胰蛋白酶消化、收集細胞離心制成細胞懸液,經甲醇固定過夜,PBS清洗3次加入適量的Annexin V-FITC溶液與PI染色液共孵育30 min,混勻后轉移至上樣管,用流式細胞儀檢測細胞凋亡與周期情況。(4)免疫印跡法(Western blotting)檢測細胞周期、凋亡相關蛋白及p65蛋白的表達情況:將對數生長期J82細胞分別用含1、3μmol/L藥物及不含藥物的培養基(對照組)處理培養48 h,吸盡舊液,用細胞刮子將細胞刮下來,加入細胞裂解液(100 μL RIPA、1μL PMSF)提取總蛋白(冰上操作,以防蛋白降解),用BCA蛋白定量法測定總蛋白濃度并計算上樣量,保持內參一致。經SDS-PAGE電泳,濃縮膠80 V,至分離膠時改電壓為120 V,電泳結束后將蛋白轉移至PVDF膜上,轉膜條件為300 mA,70 min。轉膜結束后5%脫脂奶粉封閉1 h。加入一抗稀釋液,4℃孵育過夜,次日TBST洗滌5min×3次,再加二抗稀釋液,室溫避光孵育1 h,TBST避光洗滌5min×3次。進行ECL化學發光曝光、顯影。對感光膠片條帶進行灰度值分析,以β-actin作為內參,計算目的蛋白的相對表達量。重復3次。
1.3 統計學方法 采用SAS 8.1統計軟件。符合正態分布計量資料以(±s)表示。組間整體比較采用單因素方差分析,兩兩比較采用LSD-t檢驗。計數資料比較采用χ2檢驗,兩兩比較采用Bonfferoni校正法。P<0.05為差異有統計學意義。
2 結果
2.1 丹參酮ⅡA抑制J82細胞增殖 OD值可反映細胞增殖活力 丹參酮ⅡA處理J82細胞48 h后,各組450 nm OD值差異有統計學意義(F=346.35,P<0.001),1μmol/L組與陰性對照組比較的差異無統計學意義(P>0.05),其余不同濃度兩組間差異均有統計學意義(P<0.05)。丹參酮ⅡA作用J82細胞48 h的IC50為4.16μmol/L。各藥物處理組增殖抑制率差異有統計學意義(F=293.68,P<0.001),且任意兩組間差異均有統計學意義(P<0.05)。見表1、圖1。確定IC50值后,設置空白對照組和藥物處理組,分別作用于J82細胞,CCK-8法測定其1、2、3、4、5 d的增值情況,根據受測細胞的吸光度值,繪制成細胞增殖曲線。見圖2。藥物處理組細胞增殖速率明顯低于空白對照組,差異有統計學意義(P<0.01)。
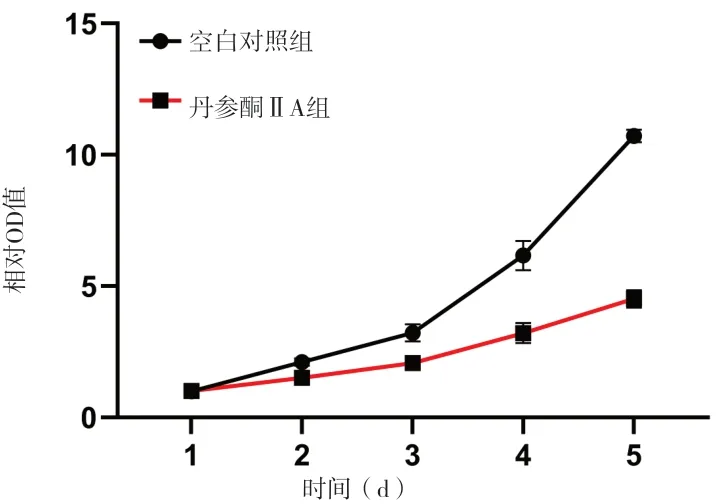
圖2 丹參酮ⅡA的濃度對J82細胞增殖的影響
表1 不同濃度組間450 nm OD值及細胞增殖抑制率的比較(±s)
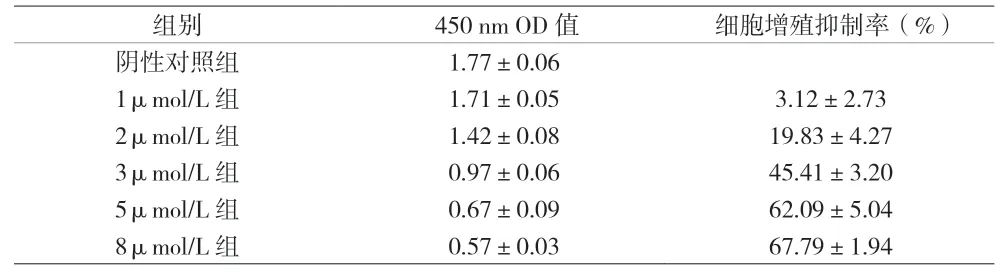
表1 不同濃度組間450 nm OD值及細胞增殖抑制率的比較(±s)
?
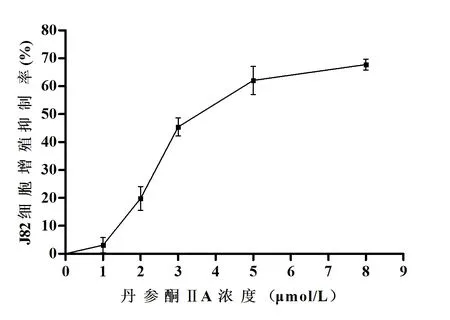
圖1 丹參酮ⅡA的J82細胞增殖半數抑制率的測定
2.2 丹參酮ⅡA阻滯J82細胞周期 對照組、1μmol/L組、3μmol/L組 的G1期 細 胞 百 分 比 值分 別 為(42.22%±0.48%)、(47.98%±1.49%)、(54.94%±3.39%),差異有統計學意義(F=41.15,P<0.05),且任意兩組間差異均有統計學意義(P<0.05);S期細胞百分比分別為(46.32%±2.14%)、(39.72%±2.88%)、(33.19%±4.17%),差異有統計學意義(F=9.21,P<0.05),但差異主要存在于3μmol/L組與對照組(P<0.05);G2期細胞百分比分別為(14.46%±2.17%)、(13.21%±2.83%)、(9.87%±0.95%),差異無統計學意義(F=3.71,P>0.05)。見圖3~4。
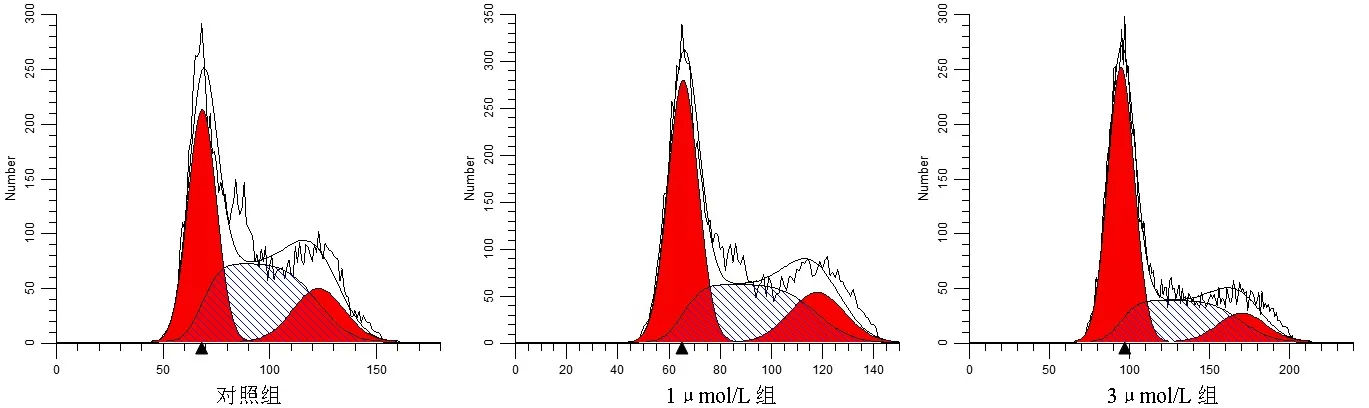
圖3 三組J82細胞周期流式檢測結果
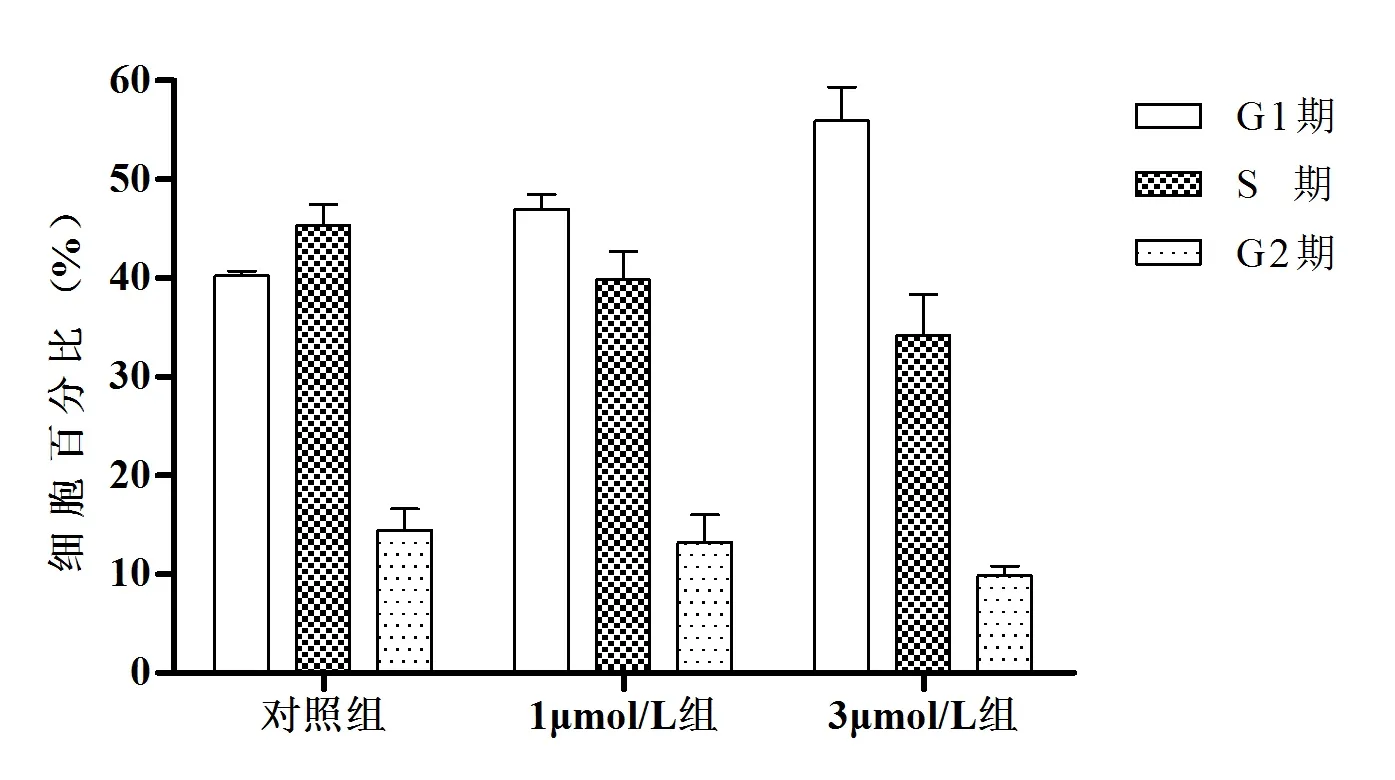
圖4 丹參酮ⅡA對J82細胞周期的影響
2.3 丹參酮ⅡA誘導J82細胞凋亡 對照組、1μmol/L組、3μmol/L組、5μmol/L組的細胞數分別為7,787、10,106、9,502、14,941個;總凋亡率分別為3.36%、12.23%、14.74%、18.40%,差異有統計學意義(χ2=1,028.98,P<0.001)。進一步兩兩比較顯示,3個藥物處理組的總凋亡率均高于對照組(χ2=452.65、638.49、1,006.78,P<0.05),3μmol/L組、5μmol/L組的總凋亡率均高于1μmol/L組(χ2=25.59、161.46,P<0.05),5μmol/L組的總凋亡率高于3μmol/L組(χ2=55.14,P<0.05)。見圖5。
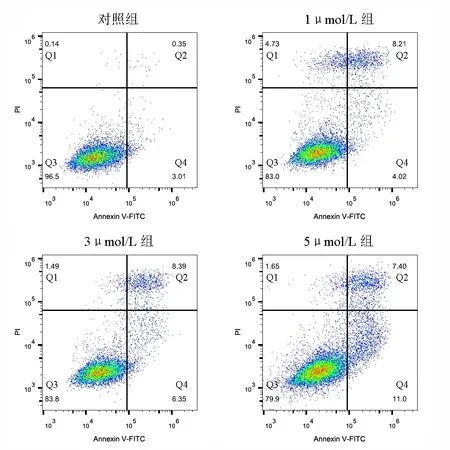
圖5 不同濃度丹參酮ⅡA誘導J82細胞凋亡的流式檢測結果(Q1:機械損傷;Q2:晚期凋亡;Q3:正常細胞;Q4:早期凋亡;總凋亡=Q4+Q2)
2.4 丹參酮ⅡA促進J82細胞中caspase 3、caspase 9蛋白的表達 對照組、1μmol/L組、3μmol/L組caspase 3蛋白相對表達量分別為0.26±0.02、0.39±0.02、0.52±0.03,差異有統計學意義(F=113.10,P<0.001),且任意兩組間差異均有統計學意義(P<0.05);caspase 9蛋白相對表達量分別為0.02±0.02、0.17±0.03、0.34±0.12,差異有統計學意義(F=15.83,P<0.05),且任意兩組間差異均有統計學意義(P<0.05)。對照組、1μmol/L組、3μmol/L組的 cyclin D1蛋白相對表達量分別為0.21±0.02、0.12±0.03、0.05±0.01,差異有統計學意義(F=113.10,P<0.001),且任意兩組間差異均有統計學意義(P<0.05)。對照組、1μmol/L組、3μmol/L組Bcl-x蛋白相對表達量分別為0.56±0.04、0.23±0.02、0.08±0.01,差異有統計學意義(F=211.10,P<0.001),且任意兩組間差異均有統計學意義(P<0.05)。對照組、1μmol/L組、3μmol/L組P56蛋白相對表達量分別為0.23±0.02、0.10±0.02、0.04±0.01,差異有統計學意義(F=143.20,P<0.001),且任意兩組間差異均有統計學意義(P<0.05)。見圖6~7。
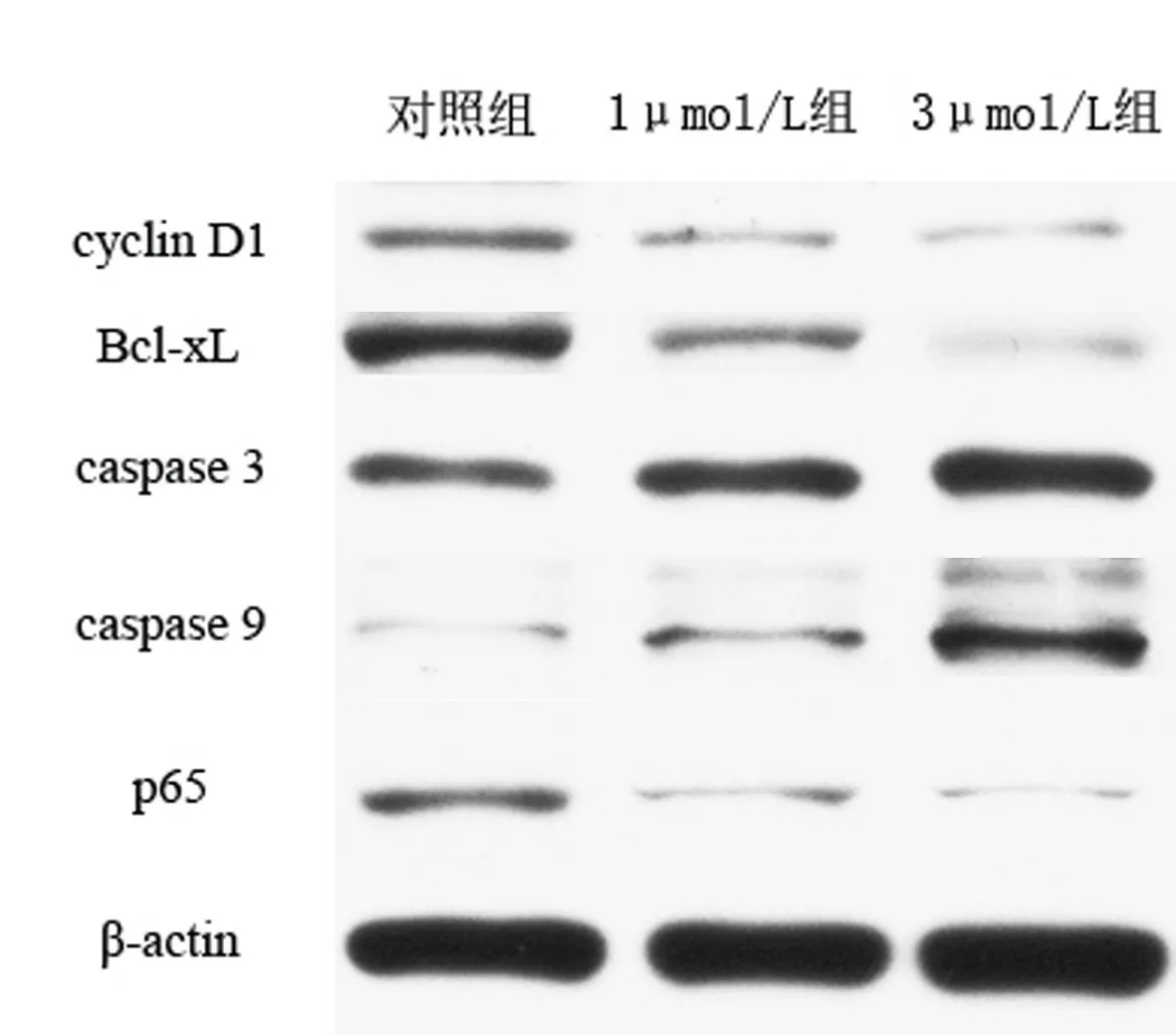
圖6 cyclin D1、Bcl-xL、caspase3、caspase9、P65蛋白在三組J82細胞中表達的Western blotting檢測結果
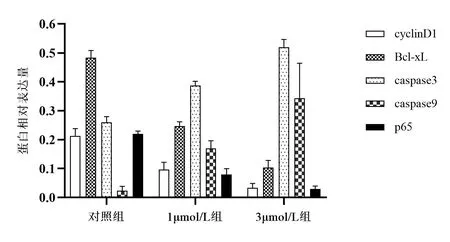
圖7 丹參酮ⅡA對J82細胞cyclin D1、Bcl-xL、caspase3、caspase9、P65蛋白表達的影響
3 討論
膀胱癌是泌尿系統發病率最高的惡性腫瘤,根據病理學分期可分為非肌層浸潤性膀胱癌(non-muscleinvasive bladder cancer,NMIBC)和肌層浸潤性膀胱癌(muscle-invasive bladder cancer,MIBC),新發病例絕大多數為NMIBC,占70%以上。目前在膀胱癌的治療以手術為主的綜合療法已得到公認和普及,但并未給患者的預后帶來突破性改善。NMIBC經手術治療后聯合膀胱灌注治療,復發率仍達50%~70%,約10%~15%的患者會進展為MIBC[4]。MIBC的治療,盡管積極采取根治性膀胱切除術及全身化療,仍有至少50%的患者在5年內死于腫瘤轉移,其中位生存期僅為12~15個月[5]。因此,開發新藥物或尋找某些具有良好的抗腫瘤活性的天然藥物,應用于膀胱癌以減少復發,具有十分重要的意義。
研究表明,丹參酮類化合物丹參酮ⅡA對骨肉瘤、卵巢癌、肝細胞癌、前列腺癌、結腸癌、食管癌、胃癌、肺癌等多種腫瘤細胞均具有良好的抗腫瘤活性[6-13],其抗腫瘤作用表現在抑制腫瘤細胞增殖、調控細胞周期、誘導細胞分化、誘導腫瘤細胞凋亡及抑制腫瘤細胞侵襲和遷移等諸多方面[14]。丹參酮類化合物也可提高化療后機體的免疫功能,對機體的免疫臟器也有一定的保護作[15]。該化合物來源于中國傳統中藥丹參,毒副作用較低,是一種具有潛在臨床應用前景的抗腫瘤天然藥物,近年來越來越受到關注。
本研究結果顯示,丹參酮ⅡA可明顯抑制J82細胞的增殖,且抑制率隨著藥物劑量的增加而增加。這與CHIU等[16]的研究有類似的結果,其發現經丹參酮ⅡA處理后5637、BFTC、T24及TCCSUP四種膀胱癌細胞的存活率均以藥物劑量和作用時間依賴的方式顯著降低。故丹參酮ⅡA對膀胱癌細胞的增殖抑制作用確切。本研究顯示,丹參酮ⅡA可使J82細胞發生G1/S期阻滯,這可能是丹參酮ⅡA抑制J82細胞增殖的機制之一,其中相關的分子機制有待進一步深入研究。本研究還顯示,丹參酮ⅡA可誘導J82細胞凋亡,并隨著劑量的增加而凋亡率升高。以往有研究顯示,丹參酮ⅡA可通過線粒體途徑誘導結腸癌、肺癌、前列腺癌等腫瘤細胞凋亡[17-19],也可通過內質網應激途徑、死亡受體途徑誘導卵巢癌、肝細胞癌凋亡[8,20]。本研究結果顯示,凋亡抑制因子cyclin D1、Bcl-xL,P65蛋白表達隨藥物濃度升高而降低,提升丹參酮ⅡA可抑制凋亡。丹參酮ⅡA可明顯增加J82細胞中caspase 3和caspase 9兩種蛋白的表達,且藥物劑量越高,蛋白表達越多,而caspase 8蛋白的表達則不受藥物影響。當線粒體損傷時,線粒體完整性被破壞可導致多種促凋亡因子包括細胞色素C的釋放,細胞色素C與胞質中的細胞凋亡蛋白酶活化因子1結合,直接激活caspase9等[21],從而導致細胞凋亡,這表明丹參酮ⅡA很可能通過線粒體介導的凋亡途徑來誘導J82細胞凋亡。下一步需要檢測該通路上下游的信號分子來進行驗證。
綜上所述,丹參酮ⅡA在體外可抑制J82細胞增殖,G1/S期阻滯可能是其中的機制之一,同時丹參酮ⅡA可能通過線粒體途徑誘導J82細胞凋亡。本研究為丹參酮ⅡA在膀胱癌藥物治療中的應用提供了初步的實驗依據,但僅為體外實驗,研究結果的科學價值有待進一步開展動物實驗及臨床試驗來驗證。

