穴位埋線對去勢骨質(zhì)疏松大鼠BMD、BMSCs、ALP及TGF-β信號通路的影響
陳 菁,曾麗蓉,龔海峰,謝菊英
(1.湘南學(xué)院 康復(fù)學(xué)院,湖南 郴州423000;2.湘南學(xué)院附屬康復(fù)醫(yī)院,湖南 郴州 423000; 3.湘南學(xué)院第一附屬醫(yī)院,湖南 郴州423000)
絕經(jīng)后骨質(zhì)疏松癥(Postmenopausal osteoporosis,PMO)是骨質(zhì)疏松癥的主要類型之一。其發(fā)病機制與婦女絕經(jīng)后的卵巢功能減弱、雌激素水平降低有關(guān),卵巢功能減弱可能引起骨的吸收生成,進(jìn)而出現(xiàn)以骨量低下、骨組織的顯微結(jié)構(gòu)退行性變?yōu)樘卣鞯墓琴|(zhì)疏松[1-2],該病是一種以骨量減少、骨微結(jié)構(gòu)破壞、骨強度降低、骨脆性增加及易發(fā)生骨折為臨床特征的全身代謝性骨骼疾病[3]。據(jù)國內(nèi)相關(guān)文獻(xiàn)報道PMO發(fā)病率約為20.7%,且隨年齡增加發(fā)病率逐漸提高,已逐漸成為我國嚴(yán)重公共衛(wèi)生問題[5]。因此,選取簡便性、廉價性及安全性高的治療靶點是治療PMO的首選。
近年來,醫(yī)學(xué)界大力提倡采用中西醫(yī)結(jié)合的方法治療骨質(zhì)疏松,穴位埋線作為臨床應(yīng)用較廣泛的方法之一,已得到國內(nèi)外學(xué)者的認(rèn)可[6]。穴位埋線的主要機制是在中醫(yī)針灸學(xué)基礎(chǔ)理論指導(dǎo)下,結(jié)合現(xiàn)代醫(yī)學(xué)手段,將特質(zhì)的可吸收蛋白線置入穴位內(nèi),刺激穴位產(chǎn)生持續(xù)的化學(xué)反應(yīng),從而達(dá)到治病的目的,但是對于穴位埋線的調(diào)控機制機理,目前尚缺乏系統(tǒng)性研究。本研究在中醫(yī)“腎主骨”理論指導(dǎo)下,通過前期臨床實踐發(fā)現(xiàn)通過穴位埋線等方法刺激“腎”相關(guān)腧穴能夠有效改善骨質(zhì)疏松癥。因此,本研究基于“腎主骨”理論,通過對SD大鼠PMO模型進(jìn)行穴位埋線,觀察穴位埋線對大鼠BMD、BMSCs、ALP蛋白及TGF-β信號通路的調(diào)控作用,以期為“腎主骨”的穴位埋線治療PMO基礎(chǔ)理論提供實驗依據(jù)。
1 材料與儀器
1.1 實驗動物
選用3月齡SD雌性大鼠,SPF級(Ⅱ級),體質(zhì)量220 g左右(由煙臺安蒙氏生物醫(yī)藥有限公司提供,購于湖南斯萊克景達(dá)實驗動物有限公司,實驗動物許可證號:SCXK(湘) 2013-0004,飼養(yǎng)溫度 18~25℃,標(biāo)準(zhǔn)普通飼料喂養(yǎng))。實驗過程中對動物的處置符合國家科技部 2006 年頒布的《關(guān)于善待實驗動物的指導(dǎo)性意見》。
1.2 實驗器材及試劑
選用12號埋線針,裝入1/0號羊腸線8 mm;α-MEM培養(yǎng)基、高糖DMEM培養(yǎng)基(美國Gibco公司);血清骨堿性磷酸酶(BALP)試劑盒(上海碧云天生物);Herocell C1型CO2恒溫培養(yǎng)箱(上海潤度生物);BCM-1000A-5702R型低速離心機;骨鈣素(OC)和I型原膠 N-端前膚(PINB) 測定試劑盒(南京建成生物工程研究所)。
2 方法
2.1 實驗動物分組及造模
將48只3月齡健康雌性SD大鼠,SPF級(Ⅱ級),隨機分為正常組、模型組、穴位埋線組、非穴位埋線組,每組各12只。模型制備:選取48只3月齡健康雌性SD大鼠,SPF級(Ⅱ級),所有實驗動物自由攝水和進(jìn)食。造模前飼養(yǎng)大鼠7天以適應(yīng)環(huán)境,腹腔注射20%烏拉坦(4 mL/kg)進(jìn)行麻醉,所有大鼠均以背側(cè)入路方式行完整雙測卵巢摘除術(shù)。術(shù)后青霉素生理鹽水(4萬U/mL)肌注預(yù)防感染,每日注射1.5 mL,連續(xù)3 d。
2.2 干預(yù)手段
穴位埋線組干預(yù)方法:依據(jù)《動物針灸穴位圖譜》(中國針灸學(xué)會實驗針灸研究會制),選取腎俞、京門為主穴,腎俞位于第二腰椎下兩旁,京門位于最后一肋游離端下緣。在模型造模成功即開始穴位埋線(醫(yī)用可吸收蛋白線),每10日1次,3次為1個療程,療程間間隔3 d,共治療3個月(3個療程)[7]。
非穴位埋線組干預(yù)方法:非經(jīng)非穴點選腎俞、京門各穴旁5 mm處;處理時間及療程同穴位埋線組。
正常組和模型組干預(yù)方法:不進(jìn)行任何治療,正常飼養(yǎng)3個月。
2.3 標(biāo)本采集與檢測
2.3.1 骨密度(BMD) 治療3個月后大鼠仰臥位置于QDR-4500A雙能X線骨密度診斷儀上,測量分析股骨近端干骺端及第4腰椎、第5腰椎骨密度。
2.3.2 骨髓間充質(zhì)干細(xì)胞(BMSCs) 采用脫臼法處死SD大鼠,無菌條件下取出大鼠股骨和脛骨,用完全培養(yǎng)液沖洗骨髓腔且收集沖洗液。高轉(zhuǎn)速離心獲得細(xì)胞沉淀液,采用DMEM/F12培養(yǎng)基重懸接種于細(xì)胞培養(yǎng)皿,置于CO2培養(yǎng)箱內(nèi)。當(dāng)細(xì)胞密度達(dá)到80%~90%時,進(jìn)行傳代,當(dāng)進(jìn)行第3-4代細(xì)胞傳代時可得出BMSCs表達(dá)水平。用ELISA法檢測骨鈣素(OC)和I型原膠原N-端前肽(PINP)含量水平[8]。
2.3.3 堿性磷酸酶(ALP)蛋白活性測定 采用免疫組織化學(xué)(SABC) 染色法,光學(xué)顯微鏡下觀察股骨組織ALP蛋白表達(dá)水平[9]。
2.3.4 轉(zhuǎn)化生長因子-β(TGF-β)蛋白 通過RT-qPCR法檢測TGF-β的mRNA蛋白表達(dá)水平[10]。
2.4 統(tǒng)計學(xué)處理
3 結(jié)果
3.1 穴位埋線對SD大鼠骨密度的影響
治療3個月后,與正常組腰椎、股骨BMD水平比較,模型組明顯低于正常組,差異有統(tǒng)計學(xué)意義(P<0.05);經(jīng)埋線治療后,與正常組和模型組相比,穴位埋線組和非穴位埋線組腰椎、股骨BMD均有明顯提高(P<0.05),且穴位埋線組腰椎、股骨BMD水平比非穴位埋線組更高(P<0.05)。見表1。

表1 各組腰椎、股骨BMD對比
3.2 穴位埋線對SD大鼠BMSCs中IC增殖作用影響
治療3個月后,與正常組BMSCs中OC和PINP對比,模型組明顯降低正常組,差異具有統(tǒng)計學(xué)意義(P<0.05);經(jīng)埋線治療后,與正常組和模型組相比,穴位埋線組、非穴位埋線組BMSCs中OC和PINP水平均明顯提高(P<0.05),且穴位埋線組BMSCs中OC和PINP水平高于非穴位埋線組(P<0.05)。見表2。
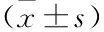
表2 各組BMSCs中OC和PINP含量對比
3.3 穴位埋線對SD大鼠ALP蛋白的影響
與正常組相比,模型組ALP表達(dá)水平明顯降低,差異有統(tǒng)計學(xué)意義(P<0.05);經(jīng)埋線治療后,與正常組和模型組相比,穴位埋線組、非穴位埋線組ALP表達(dá)水平均明顯增強(P<0.05),且穴位埋線組ALP表達(dá)水平優(yōu)于非穴位埋線組(P<0.05)。見表3。

表3 各組ALP蛋白對比
3.4 穴位埋線對SD大鼠TGF-β蛋白水平的影響
經(jīng)RT-qPCR檢測發(fā)現(xiàn),與正常組對比,模型組TGF-β mRNA表達(dá)水平明顯降低,差異有統(tǒng)計學(xué)意義(P<0.05);經(jīng)埋線治療后,與正常組和模型組相比,穴位埋線組、非穴位埋線組TGF-β mRNA表達(dá)水平均明顯增強(P<0.05),且穴位埋線組TGF-β mRNA表達(dá)水平優(yōu)于非穴位埋線組(P<0.05)。見表4。

表4 各組TGF-β蛋白表達(dá)水平對比
4 結(jié)論
原發(fā)性骨質(zhì)疏松(Osteoporosis,OP)是常見的中老年疾病之一,早期多無明顯癥狀,后期多出現(xiàn)骨量減少、骨微結(jié)構(gòu)破壞、骨脆性增加、骨強度降低及以易發(fā)生骨折為特征的全身性代謝性骨骼疾病[11],絕經(jīng)后骨質(zhì)疏松癥患者約占所有骨質(zhì)疏松患者的80%。目前,其發(fā)病機制多認(rèn)為是由于卵巢功能衰退,雌激素水平下降,炎性因子表達(dá)水平增加,引起破骨細(xì)胞的生成增加、凋亡減少,導(dǎo)致骨吸收和重建代謝失衡所致[12]。
基于上述理論分析,目前雌激素補充劑作為主要治療方案之一。主要通過雌激素補充促進(jìn)成骨細(xì)胞增殖、抑制破骨細(xì)胞凋亡,從而發(fā)揮防治絕經(jīng)后骨質(zhì)疏松的作用[13]。但藥物干預(yù)往往是終身性的,昂貴的治療費用已成為家庭和社會的沉重負(fù)擔(dān)。中醫(yī)藥治療方法因其簡便性、廉價性、安全性及有效性被廣泛應(yīng)用于臨床,甚至作為替代療法已逐漸取代普通藥物干預(yù)。POM屬祖國醫(yī)學(xué)“骨痿”“骨痹”“腰痛”“骨枯”“骨極”等病證的范疇,發(fā)病之本在于腎虛。腎為“先天之本”,主骨生髓。腎藏精,精生髓,髓居骨中,骨賴髓以充養(yǎng),腎氣盛衰與骨的生長發(fā)育密切相關(guān)。骨質(zhì)疏松正是病邪侵襲導(dǎo)致痰瘀困阻、氣血不調(diào)而發(fā)病[14]。穴位埋線基于中醫(yī)針灸學(xué)思想,結(jié)合現(xiàn)代科學(xué)手段,通過將可吸收的蛋白線置入穴位內(nèi),在穴位內(nèi)產(chǎn)生相應(yīng)的物理及化學(xué)反應(yīng),通過這種對腧穴的持續(xù)刺激以達(dá)到治療疾病的目的[15]。本研究通過前期文獻(xiàn)檢索發(fā)現(xiàn)目前國內(nèi)外鮮有文章報道穴位埋線對PMOP調(diào)控機制機理的系統(tǒng)性研究。因此,本研究小組通過總結(jié)多年臨床經(jīng)驗,提出基于“腎主骨”理論,通過穴位埋線對調(diào)節(jié)去勢SD大鼠BMD、BMSCs、 ALP蛋白及TGF-β蛋白水平的調(diào)控機制,以求揭示穴位埋線治療PMOP的分子調(diào)控機制。
其中,BMSCs作為骨髓基質(zhì)的重要組成成分,是人體內(nèi)成骨分化和骨形成的重要細(xì)胞來源,在體外也具有分化為成骨細(xì)胞的潛能。同時其作為成骨細(xì)胞(osteoblast,OB)的前體細(xì)胞,在骨的生長和重建過程中發(fā)揮主導(dǎo)作用[16]。當(dāng) BMSCs 出現(xiàn)定向分化功能異常時,成骨細(xì)胞減少,脂肪細(xì)胞增多,成脂、成骨分化失衡,最后引發(fā)骨質(zhì)疏松。此外,堿性磷酸酶(ALP)作為骨代謝和骨形成的標(biāo)志物,對成骨細(xì)胞凋亡有重要的分子作用機制,其活性的高低是BMSCs成骨細(xì)胞分化的重要指標(biāo)之一[17]。BMSCs的成骨分化是多條信號調(diào)控通路共同參與的復(fù)雜過程。TGF-β作為主要信號通路之一,能夠促進(jìn)成纖維細(xì)胞轉(zhuǎn)化成肌成纖維細(xì)胞,對上皮間質(zhì)轉(zhuǎn)化起到關(guān)鍵作用,進(jìn)而促進(jìn)成骨細(xì)胞分化,抑制其向脂肪細(xì)胞分化,通過調(diào)控BMSCs維持骨代謝平衡,提高骨密度,從而達(dá)到防治絕經(jīng)后骨質(zhì)疏松癥的目的[18]。
本研究結(jié)果顯示,模型組SD大鼠BMD、BMSCs、ALP蛋白及TGF-β蛋白水平含量均明顯低于其他3組。當(dāng)采取穴位埋線干預(yù)后,BMD、BMSCs、ALP蛋白及TGF-β蛋白水平與模型組相比有明顯提高,推測其可有效提高BMSCs成骨細(xì)胞生成,減少破骨細(xì)胞,提高BMD,從而在骨的生長和重建過程中發(fā)揮主導(dǎo)作用。此外,ALP、TGF-β蛋白可參與調(diào)控BMSCs作用,達(dá)到維持平衡的骨代謝水平,從而達(dá)到防治和延緩絕經(jīng)后骨質(zhì)疏松癥的目的。另外,穴位組和非穴位組相比,穴位組分子調(diào)控更好,證明了基于“腎主骨”理論的正確性,通過京門和腎俞穴位的刺激,對PMOP分子調(diào)控更具有靶向性。不過由于人力、物力等資源有限,本研究實驗過程引起的BMSCs定向成骨誘導(dǎo)分化、信號通路相互交錯干擾及個體化應(yīng)用等問題只能作為下一步的研究重點進(jìn)行研究。

