利伐沙班成功治療急性主動脈夾層合并肺栓塞一例報道
陳仕鋒,歐煥珍,朱敏敏,卿斌,肖波,曾超
急性主動脈夾層(acute aortic dissection,AAD)是一種危及生命的嚴重心血管疾病。研究證實,未經手術治療的Stanford A型AAD發病24 h內病死率每小時增高1%~2%[1],而Stanford B型AAD發病2周內病死率達6.4%[2]。肺栓塞(pulmonary embolism,PE)是僅次于冠心病、腦卒中的第三大致死性心血管疾病,全球每年有5萬~20萬人死于該疾病[3-4]。近年國內外均有報道AAD合并PE病例[5-13],針對PE需予以抗凝治療,但抗凝治療又可能會增加AAD破裂出血發生風險,故AAD與PE在治療方法上存在矛盾[14]。早期診斷和合理治療是預防AAD合并PE患者死亡的關鍵。既往國內外治療AAD合并PE患者多選擇低分子肝素及華法林[9,13],而新型口服抗凝藥(如利伐沙班)在國外研究中已有所報道[7,11],但國內尚未有相關個案報道。本文就利伐沙班成功救治1例AAD合并PE患者的診治經驗進行報道,以期為該類患者的診療提供參考。
1 病例簡介
患者,男,57歲,因“夜間彎腰抱重物時突發胸腹部撕裂樣疼痛,伴大汗淋漓、胸悶及腹部脹痛”于2020-12-31就診于當地縣醫院,行急診胸部CT檢查結果顯示:主動脈明顯增寬,考慮AAD。為求進一步診療,患者于發病6 h內轉診至當地某三甲醫院,入院時體溫37.1 ℃,呼吸頻率25次/min,血壓:左臂168/96 mm Hg(1 mm Hg=0.133 kPa)、右臂171/99 mm Hg,心率118次/min,血氧飽和度為92%,余檢查無異常。既往有高血壓(2級)、高脂血癥病史3年余,長期服用氨氯地平、阿托伐他汀治療,未規律監測血壓。實驗室檢查結果顯示:血常規指標無異常;低密度脂蛋白膽固醇(low density lipoprotein cholesterol,LDL-C)為3.70 mmol/L(參考范圍:2.10~3.21 mmol/L),總膽固醇(total cholesterol,TC)為5.23 mmol/L(參考范圍:0~5.20 mmol/L),余指標無異常;心肌酶譜正常;心肌肌鈣蛋白T(cardiac troponin T,cTnT)為0.10 μg/L(參考范圍:0~0.15 μg/L);D-二聚體為3 750 μg/L(參考范圍:0~500 μg/L);腦鈉肽(brain natriuretic peptide,BNP)為235 ng/L(參考范圍:0~900 ng/L)。動脈血氣分析指標(未吸氧):pH值為7.41(參考范圍:7.35~7.45),動脈血二氧化碳分壓(arterial partial pressure of carbon dioxide,PaCO2)為31 mm Hg(參考范圍:35~45 mm Hg),動脈血氧分壓(arterial partial pressure of oxygen,PaO2)為67 mm Hg(參考范圍:80~100 mm Hg)。患者心電圖檢查顯示竇性心動過速;心臟彩色超聲檢查結果顯示高血壓心臟病〔左心室舒張功能減退(左心室射血分數為61%),二尖瓣輕度反流,肺動脈壓為28 mm Hg〕;頸部血管彩色超聲檢查無異常;胸主動脈增強CT檢查結果顯示:主動脈壁內血腫(Stanford B型、DeBakey Ⅲ型)、主動脈鈣化。結合上述檢查,最終診斷為:AAD(Stanford B型、DeBakey Ⅲ型)、高血壓2級(很高危)。故指導患者絕對臥床,給予苯磺酸氨氯地平片(5 mg/次、2次/d)、厄貝沙坦氫氯噻嗪片(1片/次、1次/d)、特拉唑嗪膠囊(2 mg/次、1次/晚)、美托洛爾片(75 mg/次、2次/d)、地爾硫緩釋膠囊(90 mg/次、2次/d)、瑞舒伐他汀鈣片(10 mg/次、1次/d)治療。2021-01-02,患者自覺胸痛癥狀有所緩解,血壓、心率均平穩。2021-01-08,患者主訴下床活動后出現胸悶、氣促不適癥狀,應患者家屬要求進行正電子發射計算機斷層顯像(positron emission tomography,PET-CT)檢查,結果顯示:右肺上葉、中葉及下葉多發肺動脈分支血栓形成;主動脈弓潰瘍,胸主動脈及腹主動脈壁間血腫生成,部分血管壁糖代謝增高,考慮局部活動性炎癥可能,排除腫瘤可能,見圖1。建議轉上級醫院進一步診治,故患者于2021-01-09自行轉入中國人民解放軍31661部隊醫院呼吸與危重癥醫學科。
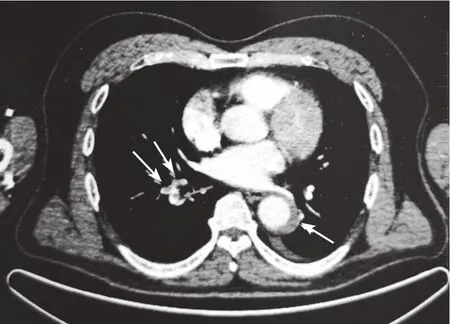
圖1 患者2021-01-08胸部PET-CT檢查結果Figure 1 Chest PET-CT examination result of the patient at 2021-01-08
患者是由平車推入病房,精神、進食、睡眠狀態尚可,無明顯胸悶、胸痛及呼吸困難癥狀,二便正常。體溫36.7 ℃,呼吸頻率18次/min,血壓:左臂118/69 mm Hg、右臂122/73 mm Hg,心率61次/min,查體無異常。實驗室檢查結果顯示:血常規、生化指標均無異常;心肌酶譜、cTnT水平正常;D-二聚體為5 520 μg/L,BNP為1 030 ng/L。凝血四項正常。血氣分析指標(未吸氧):pH值為7.37,PaCO2為31 mm Hg,PaO2為59 mm Hg。風濕全套、血管炎四項指標均為陰性。心電圖檢查顯示竇性心率。心臟彩色超聲檢查結果顯示主動脈瓣退行性變〔三尖瓣反流(少量)〕,肺動脈壓為26 mm Hg,左心室射血分數為63%;下肢血管彩色超聲檢查無異常。結合當地三甲醫院檢查結果及《肺血栓栓塞癥診治與預防指南》[4]最終診斷為:中低危PE,AAD(Stanford B型),高血壓2級(很高危)。治療方面:指導患者絕對臥床,予以吸氧、降壓、控制心率、調脂等治療,嚴格控制血壓在110~120/60~80 mm Hg、心率在60~70次/min。2021-01-10,由心內科醫師進行會診,結合相關檢查結果診斷同上,鑒于國內外指南尚無相關治療建議,建議酌情采用抗凝治療,故于2021-01-12起,在患者原來治療基礎上加入利伐沙班片20 mg/次、1次/d。2021-01-20,患者行胸主動脈增強CT檢查,結果顯示:胸主動脈夾層動脈瘤(Stanford B型);胸主動脈及腹主動脈漿膜下血栓形成;胸主動脈增強CT檢查未見明顯異常,見圖2。而后調整利伐沙班片劑量為10 mg/次、1次/d,維持治療3個月。2021-01-24,患者出院,囑其出院后堅持服用苯磺酸氨氯地平(5 mg/次、2次/d)、厄貝沙坦氫氯噻嗪片(1片/次、1次/d)、特拉唑嗪膠囊(2 mg/次、1次/晚)、美托洛爾片(75 mg/次、2次/d)、地爾硫緩釋膠囊(90 mg/次、2次/d)、瑞舒伐他汀鈣片(10 mg/次、1次/d)、利伐沙班片(10 mg/次、1次/d),嚴格控制血壓、心率,并定期返院復診。
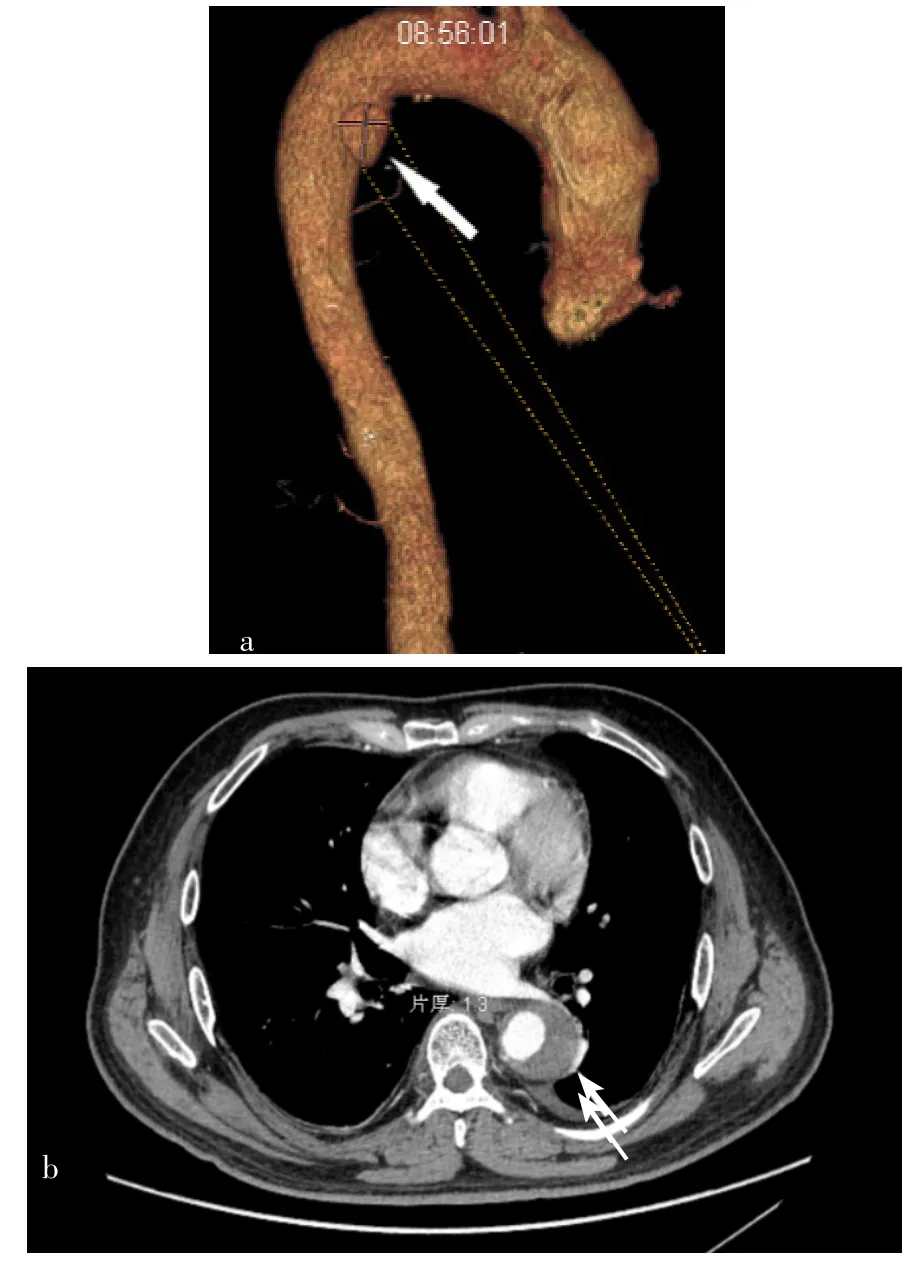
圖2 患者2021-01-20胸主動脈增強CT檢查結果Figure 2 Enhanced CT examination result of thoracic aorta of the patient at 2021-01-20
患者出院后,在電話隨訪期間未訴特殊不適。2021-08-19,患者返院復查胸主動脈增強CT,結果顯示:AAD(Stanford B型);胸主動脈及腹主動脈漿膜下血栓較前明顯吸收,見圖3。
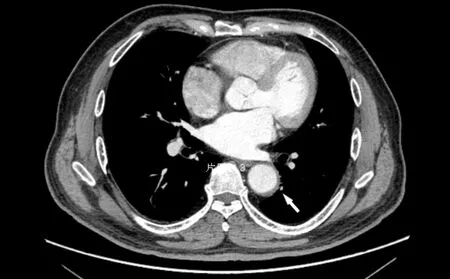
圖3 患者2021-08-19胸主動脈增強CT檢查結果Figure 3 Enhanced CT examination result of thoracic aorta of the patient at 2021-08-19
2 討論
AAD是因多種原因導致主動脈內膜、中膜撕裂,血液流入其中可將主動脈腔分離為真腔及假腔,而血液在真、假腔之間流動或形成血栓[2]。主動脈夾層、壁內血腫和穿透性動脈粥樣硬化性潰瘍等病理改變又稱急性主動脈綜合征[15],臨床上常根據原發破口的位置及夾層累及范圍將主動脈夾層進行DeBakey分型、Stanford分型。《2014年ESC主動脈疾病診斷和治療指南》[16]明確了主動脈夾層分期,即發病時間≤14 d為急性期,15~90 d為亞急性期,>90 d為慢性期。本例患者于發病6 h內入院,影像學檢查結果顯示有急性主動脈綜合征的典型病理改變,原發破口位于左鎖骨下動脈以遠,夾層累及腹主動脈,故主動脈夾層分型確定為DeBakey Ⅲ型、Stanford B型,分期為急性期,參考《主動脈夾層診斷與治療規范中國專家共識》[2]、《2014年ESC主動脈疾病診斷和治療指南》[16],患者無手術指征,故予以嚴格的控制血壓、心率治療,且患者在轉入中國人民解放軍31661部隊醫院時病程已有10 d,病情較穩定,支持繼續保守治療。
據統計,PE發病率為1.17‰~1.45‰[17-18]。PE是由于血栓阻塞肺動脈而導致的呼吸、循環衰竭等一系列臨床病理變化,嚴重危及患者生命,臨床主要基于PE的危險分層進行治療。CT肺動脈造影(CT pulmonary angiography,CTPA)是臨床診斷PE的首選檢查方法,但目前通氣/灌注成像的單光子發射計算機斷層掃描(single photon emission computed tomography,SPECT)和PET-CT的臨床應用越來越廣泛[19]。《肺血栓栓塞癥診治與預防指南》[4]指出,對于血流動力學不穩定的高危PE患者,可綜合PE嚴重程度指數、D-二聚體水平及彩色超聲等影像學檢查進行診斷及評估,若無溶栓禁忌證則可立即啟動溶栓治療;對于血流動力學穩定的中低危PE患者,可根據病情嚴重程度啟動抗凝治療。有研究指出,偶然發現的PE或亞段PE患者多無明顯癥狀,該類患者是否應進行抗凝治療目前尚存在爭議[20],但針對偶然發現的PE患者或亞段PE合并腫瘤或靜脈血栓栓塞癥(venous thromboembolism,VTE)復發或進展危險因素的患者,則應立即啟動抗凝治療[4]。本例患者根據《肺血栓栓塞癥診治與預防指南》[4]診斷為中低危PE,但其存在臥床、高凝等PE進展的危險因素,故采用抗凝治療。鑒于多項研究證實了利伐沙班的抗凝效果不劣于低分子肝素及華法林,且具有較低的出血風險[21-22]。本例患者主動脈夾層處于急性期,故予以低于常規劑量的利伐沙班片治療,即20 mg/次、1次/d,1周后復查胸主動脈增強CT未見明顯異常,提示患者肺動脈血栓已溶解,故調整利伐沙班片為10 mg/次、1次/d維持治療3個月。2021-08-19,患者復查胸主動脈增強CT結果顯示胸主動脈及腹主動脈漿膜下血栓較前明顯吸收,提示主動脈夾層已治愈。
AAD合并PE的發病機制目前尚不明確。既往研究顯示,PE多繼發于主動脈夾層術后[23]。近年越來越多的研究報道了PE多是在AAD診治中偶然發現的[9,24],本例患者也是以AAD為主要表現,在臨床診斷中偶然發現合并PE。國內研究發現,AAD患者的夾層血腫可刺激大量細胞因子釋放,促進凝血和纖溶系統激活、抑制抗凝系統[25-26]。Virchow三要素(靜脈血液淤滯、內皮功能損傷和高凝狀態)是血栓栓塞癥(包括PE)的重要誘因[27-28]。在排除心房顫動、下肢血栓、腫瘤等因素后,AAD后血液高凝、絕對臥床可能是本例患者發生PE的原因。在臨床上,AAD合并PE的病例較少見。ESTRERA等[29]統計了129例Stanford B型AAD患者,其中僅有2例(1.6%)患者合并PE。抗凝是PE的基礎治療,但AAD是抗凝治療的禁忌證[24,30-31]。因此,對需要啟動抗凝治療的AAD合并PE患者進行風險評估至關重要。有多項個案報道了抗凝治療壁內血腫和Stanford B型AAD的安全性[32-34]。LACHAT等[35]研究發現,對Stanford B型AAD患者常規給予低劑量肝素可降低夾層血腫形成及增大發生風險,并能減少血栓相關并發癥。CA?ADAS等[32]對3例AAD合并PE或心房顫動的患者進行抗凝治療,結果顯示該治療并未導致夾層血腫增大及不良預后。張明明等[13]報道了1例DeBakeyⅢ型AAD合并中高危PE患者,在控制血壓、心率穩定的基礎上給予低分子肝素治療2周后橋接華法林進行抗凝治療,結果顯示其預后良好。可見,對于部分AAD合并PE患者,給予低劑量抗凝藥物治療是安全、有效的。利伐沙班屬于直接Ⅹa因子抑制劑,已被推薦用于PE的抗凝治療[3-4]。有研究表明,利伐沙班單藥治療的有效性、安全性與低分子肝素聯合華法林標準治療無明顯差異,且隨著治療時間的延長及劑量的遞減,利伐沙班單藥治療更具優勢[21]。國內一項回顧性研究也證實了利伐沙班單藥治療在住院天數、患者治療依從性、出血風險等方面更具優勢[22]。本例患者在治療期間也采用了利伐沙班進行抗凝治療,預后良好。
綜上所述,目前國內外指南均未有針對AAD合并PE的治療建議,臨床主要根據患者癥狀、危險分級進行經驗性治療,本例AAD合并PE患者采用利伐沙班進行抗凝治療取得了較好的效果,且未出現出血等并發癥,可為今后AAD合并PE患者的治療提供參考。
作者貢獻:陳仕鋒進行文章的構思與設計,撰寫論文;曾超進行文章的可行性分析,負責文章的質量控制及審校,并對文章整體負責、監督管理;歐煥珍、朱敏敏進行文獻/資料收集、整理;卿斌、肖波進行中、英文的修訂。
本文無利益沖突。

