脂聯素、瘦素及其受體基因多態性與妊娠期糖尿病患病關聯性分析
張麗娟,吳宇碧*,曾定元,劉坤友
(柳州市婦幼保健院 廣西婦產疾病臨床醫學研究中心 1.產科;2.質量辦,柳州 545001)
妊娠期糖尿病(Gestational diabetes mellitus,GDM)是妊娠期最常見的并發癥之一,是指妊娠期間首次確認的糖代謝異常(不包含孕前已經存在的1型糖尿病和2型糖尿病)。其可能導致嚴重的新生兒疾病如巨大兒、新生兒低血糖癥,或導致母體先兆子癇等短期并發癥,以及母親及其后代患2型糖尿病、肥胖和心血管疾病的長期風險[1]。GDM的發生是由于胰腺β細胞功能下降和胰島素抵抗增加所導致,它是一種代謝并發癥,尤其好發于與胰島素抵抗相關的肥胖女性中[2]。
瘦素和脂聯素是調節胰島素分泌、胰島素敏感性以及葡萄糖和脂質代謝的脂肪因子。瘦素是ob基因的產物,由脂肪細胞分泌,可調節脂質代謝。有研究表明,血清瘦素水平升高與糖尿病、脂質紊亂有關,并且其是心血管疾病的危險因素[3]。其合成具有遺傳背景,受瘦素基因遺傳多態性的調控。脂聯素在脂肪組織中產生并調節各種代謝過程,包括葡萄糖和脂質代謝以及脂肪酸氧化。脂聯素具有降低胰島素抵抗、改善脂質代謝及抗炎的作用。在代謝綜合征、糖尿病、血脂異常和肥胖癥患者中已觀察到血漿脂聯素水平降低[4]。之前有研究表明,脂聯素和瘦素單核苷酸多態性(SNP)基因分型與糖尿病、代謝綜合征和肥胖癥之間存在顯著關聯[5-6]。但尚未見多個SNP的聯合研究報道。因此,本研究對GDM孕婦外周血脂聯素和瘦素及其受體基因的7個SNP位點多態性進行分析,旨在探討脂聯素和瘦素及其受體基因的SNP位點多態性與GDM發生的可能關系。
資料與方法
一、研究對象
本研究為病例對照研究。
按照GDM篩查和診斷標準[7],孕婦在孕24~28周時進行75 g葡萄糖耐量試驗(OGTT),出現空腹血糖≥5.1 mmol/L、服糖后1 h血糖≥10.0 mmol/L、2 h后血糖≥8.5 mmol/L三項中任何一項者,即可診斷為GDM,納入病例組;OGTT結果正常者視為葡萄糖耐量正常(NGT),納入對照組。
病例組的排除標準:孕前患有1型和2型糖尿病、自身免疫性和炎癥性疾病、腫瘤疾病和慢性感染以及拒絕參加本研究的患者。
對照組排除標準:孕前患有1型和2型糖尿病、既往妊娠GDM、自身免疫性和炎癥性疾病、腫瘤性疾病和慢性感染以及拒絕參加本研究的患者。
根據病例組和對照組的納入、排除標準,共收集2019年1—12月在我院常規產檢的156例NGT孕婦為對照組,162例GDM孕婦為病例組。
本研究中所有樣本監測和采集過程均獲得我院倫理委員會的批準(批文號20170010)。
二、脂聯素和瘦素及其受體多態性基因位點的確定
進行外周血DNA檢測。選擇脂聯素ADIPOQ1基因SNP位點rs266729、rs17300539,ADIPOQ2基因SNP位點rs1501299、rs2241766,脂聯素受體ADIPOQR1基因SNP位點rs1539355,瘦素OGDH基因SNP位點rs12112075和瘦素受體LEPR基因SNP位點rs1137101共7個SNP位點多態性(表1)。
三、脂聯素和瘦素及其受體位點的引物信息
針對上述7個SNP位點,設計了擴增引物和延伸引物(表2)。

續表

表2 脂聯素和瘦素及其受體位點的引物信息
四、單堿基末端延伸(SNaPshot)PCR擴增流程
根據DNA抽提試劑盒的流程,提取研究對象的DNA,經過多重PCR擴增(擴增引物1∶1混合)后,將PCR產物分裝,進一步經SNaPshot PCR擴增,按比例混合延伸引物,加入消化完的模板DNA 1.0 μl混勻,設定反應程序:96℃,10 s;96℃ 10 s,50℃ 5 s,60℃ 30 s;25個循環。保存于4℃。讀取研究結果。
五、統計學分析
結 果
一、兩組研究對象人口學信息和臨床特征
本研究共納入318例孕婦,其中156例NGT孕婦(對照組),162例GDM孕婦(病例組)。兩組比較,病例組的分娩孕周顯著小于對照組,孕前體質量指數(BMI)和孕前體重、空腹血糖和糖化血紅蛋白及剖宮產率顯著高于對照組(P均<0.05)(表3)。
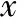
表3 兩組研究對象人口學信息和臨床特征分析[(-±s),n(%)]
二、兩組研究對象脂聯素/脂聯素受體、瘦素/瘦素受體基因檢測位點基因型分布和等位基因頻率
1.脂聯素ADIPOQ1基因SNP位點:rs266729的GG基因型、等位基因G在病例組的分布頻率較對照組顯著降低(P<0.001)(表4)。
2.脂聯素ADIPOQ2基因SNP位點:rs1501299的TT基因型、等位基因T在病例組的分布頻率較對照組顯著升高(P<0.001);rs2241766的GG基因型、等位基因G在病例組的分布頻率較對照組顯著升高(P<0.001)(表5)。

表4 脂聯素ADIPOQ1基因兩個SNP位點基因型分布和等位基因頻率[n(%)]

表5 脂聯素ADIPOQ2基因兩個SNP位點基因型分布和等位基因頻率[n(%)]
3.脂聯素受體ADIPOQR1基因SNP位點:rs1539355基因型分布及等位基因頻率比較均無統計學差異(P>0.05)(表6)。
4.瘦素及瘦素受體基因:瘦素基因OGDH及瘦素受體基因LEPRSNP位點的基因型分布及頻率在兩組間均無統計學差異(P>0.05)(表7)。

表6 脂聯素受體ADIPOQR1基因SNP位點基因型分布和等位基因頻率[n(%)]

表7 瘦素及瘦素受體基因SNP位點基因型分布和等位基因頻率[n(%)]
三、脂聯素基因多態性與GDM患病風險的單因素和多因素分析
1.單因素分析:將結果變量NGT定義為0、GDM定義為1,將自變量中每一個SNP位點的野生純合子定義為0、雜合子和突變純合子定義為1,納入上述基因型頻率差異分布的3個SNP位點rs266729、rs1501299和rs2241766基因型分布數據進行單因素分析。結果顯示:病例組SNP位點rs266729與rs1501299、rs2241766的基因頻率分布與對照組均存在顯著差異性(P均<0.05)(表8)。
2.多因素分析:將3個位點的基因型分布納入到多因素Logistic回歸分析,選擇向后LR模式,結果顯示:rs266729與rs2241766位點突變可致GDM患病風險增加,其OR(95%CI)分別為4.09(2.08,8.06)和2.77(1.63,4.74)(P<0.001)(表9)。
四、脂聯素基因-基因多態性的交互作用分析
為了確定孕婦體內的脂聯素基因是否存在交互作用導致GDM發生的風險增高,對兩組研究對象有頻率分布差異的3個基因位點進行了基因-基因間的交互作用分析,結果顯示,脂聯素ADIPOQ1基因SNP位點rs266729與ADIPOQ2基因SNP位點rs2241766的分布之間存在交互作用,二者的聯合作用導致GDM患病風險增加[OR(95%CI)為4.83(1.57,11.42),P<0.001](表10)。

表8 脂聯素基因SNP位點多態性的單因素分析

表9 脂聯素基因SNP位點多態性的多因素分析

表10 脂聯素基因-基因多態性的交互作用單因素分析
討 論
全球GDM的患病率在過去幾十年中呈持續上升趨勢。根據國際糖尿病聯合會(IDF)的數據,2017年全球GDM的患病率為14%,其中非洲為9%、北美為12.6%、亞洲為21%[8]。一項調查東亞和東南亞地區GDM患病率的薈萃分析顯示,中國GDM的發病率為11.91%,遠高于日本、韓國和泰國的8.0%[9]。由于經濟發展和生活水平提高及生活方式的改變,以飲食模式的變化和缺乏身體活動為特征,加之對GDM篩查的重視,中國GDM患病率急劇上升。包括25項橫斷面研究或回顧性研究在內的涉及79 064名中國孕婦的一項薈萃分析表明,根據國際糖尿病協會和妊娠研究組(IADPSG)診斷標準,中國GDM的總患病率為14.8%[95%CI(12.8%,16.7%)][10]。
作為糖尿病前期狀態,GDM通常與高胰島素血癥和胰島素抵抗有關,但GDM的病理生理學尚不明確。脂聯素和瘦素是研究較多的與糖尿病及GDM相關的脂肪因子,其中脂聯素及瘦素基因多態性的研究尤為廣泛。體內脂聯素水平受遺傳的調控[11]。脂聯素是ADIPOQ基因的產物,該基因長度約15.8 kb,包含3個外顯子,位于染色體3q27上,該染色體與代謝綜合征、2型糖尿病和心血管疾病的易感位點相關[11]。ADIPOQ基因常呈多態性,其常見遺傳變異對血漿脂聯素水平的影響及其與不同代謝特征的關聯受到越來越多的關注。研究結果顯示,ADIPOQ1基因SNP位點rs266729的小G等位基因與白種人和亞洲人的脂聯素水平降低、空腹血糖升高、胰島素抵抗、肥胖、2型糖尿病、糖尿病腎病和代謝綜合征有關[12]。已有較多的文獻報道了rs266729位點多態性與GDM患病的相關性。如一項薈萃分析結果顯示,rs266729位點的GG/GC基因型可增加亞洲人和歐洲人患GDM的風險,其OR(95%CI)分別為2.08(1.01,4.27)和1.52(1.03,2.25)[13]。本研究結果與上述的研究相反,GDM患者攜帶GG/GC基因型和G等位基因的頻率低于非GDM患者,我們分析認為不排除人種差異的關系,并且有文獻報道在GDM患者中發現罕見基因G起了一定的保護作用,而常見的C等位基因與GDM患病風險相關[12]。已有研究發現妊娠特異性β1糖蛋白與脂聯素基因啟動子相關,其過表達增強了基因啟動子的活性。rs266729位點的G等位基因改變了轉錄因子Sp1結合位點的DNA序列,導致脂聯素基因啟動子的轉錄活性降低[14]。此外,根據基因組序列中DNA甲基化的位置,其結果會產生不同的遺傳效應。如基因啟動子和基因間區域會發生甲基化并導致基因沉默,最終影響基因在發育過程中的表達。rs266729啟動子區域的DNA甲基化與多態性相互作用可能導致ADIPOQ1基因表達受到抑制[15]。另一方面,脂聯素基因的轉錄活性在妊娠期間根據新發育胚胎的需要而改變,這可能涉及相應調節因子的活性和/或結合的變化;由rs266729改變的序列可能在孕婦和非孕婦的脂肪細胞中發揮不同的作用。因此,G等位基因會降低非妊娠個體中ADIPOQ的表達,它可能會使啟動子對與妊娠相關的抑制反應減弱[12]。以上兩點可能可以部分地解釋GDM患者的G等位基因的保護作用。本研究未發現瘦素及其受體與GDM發生之間的關系,這與既往報道[16-17]不一致,可通過更大樣本的研究進一步探討。
已有的文獻證據提示ADIPOQ2基因SNP位點rs2241766多態性與個體糖尿病、肥胖和代謝綜合征的易感性有關[11,18]。一項研究表明,ADIPOQ2基因SNP位點rs2241766的GG位點和等位基因G的高頻率分布是導致糖尿病腎病患病的主要危險因素,其OR(95%CI)為1.51(1.16,1.95)[15]。本研究結果表明,ADIPOQ2基因SNP rs2241766的GT/GG基因型和G等位基因更常見于GDM孕婦。此結果與既往的研究報道[19-20]一致。一項在伊朗的孕產婦人群中的研究顯示,與TT基因型相比,GT/GG基因型發生GDM的風險高2.5倍,在調整了包括孕齡、胰島素抵抗指數和糖化血紅蛋白在內的混雜因素后,這種關聯仍然存在[19]。另一項納入了22項研究,包括1 461名GDM孕婦和1 592名非GDM孕婦的薈萃分析結果顯示,與TT基因型相比,GT/GG基因型發生GDM的風險升高[OR(95%CI)為1.43(1.23,1.67)];攜帶G等位基因發生GDM的風險是攜帶T等位基因的1.41倍[95%CI(1.25,1.56)][20]。
由于復雜的疾病往往由多重因素相互作用引起,基因與基因、基因與環境間的交互作用分析將會提高檢測因果關系的能力,從而有可能增加對疾病遺傳學的了解。已有研究揭示,脂聯素基因與其他基因的SNP位點交互作用可導致疾病的發生,如有文獻報道了ADIPOQ1 rs266729與脂聯素基因的其他SNP位點存在基因-基因交互作用可增加結直腸癌的患病風險[21]。此外,也有研究報道了ADIPOQ2 rs2241766位點與其他基因的SNP位點存在基因-基因交互作用可增加結直腸癌的患病風險[22]。但目前尚未發現有關于ADIPOQ1基因rs266729與ADIPOQ2基因rs2241766的基因-基因交互作用對疾病影響情況的報道。本研究報道了ADIPOQ1基因SNP位點rs266729與ADIPOQ2基因SNP位點rs2241766的基因-基因交互作用可增加GDM的患病風險。
綜上,脂聯素ADIPOQ1基因SNP位點rs266729和ADIPOQ2基因SNP位點rs2241766突變可能增加GDM的患病風險,兩個SNP位點之間的交互作用與GDM的發生有關。

