初中化學方程式書寫的模型建構與應用


【摘要】本文從構建化學方程式中的氣體生成物符號“↑”和固體生成物符號“↓”的書寫模型、構建四大基本反應的應用模型、構建“奪氧式反應”“金屬與氧化性酸反應”“多氧化合物反應”的配平模型入手,系統論述化學方程式書寫中的模型認知思想以及模型建構的基本方法與應用。
【關鍵詞】化學方程式 書寫 模型建構與應用
【中圖分類號】G63 【文獻標識碼】A
【文章編號】0450-9889(2022)10-0060-03
化學方程式作為初中化學重要的專業用語和學習工具,以符號的形式,科學、簡明地表達了物質變化的規律,體現了“宏觀—微觀—符號”三重表征的有機聯結。學生初次接觸和書寫化學方程式,很容易出現這樣那樣的錯誤:或者搞不清楚化學反應過程中反應物和生成物的狀態,導致錯標或漏標氣體生成物符號“↑”和固體生成物符號“↓”;或者因為不能從本質上理解四大基本反應類型,導致不能自如地銜接有關的初中、高中化學知識;或者僅會用最小公倍數法、奇數配偶法配平簡單的化學方程式,而對奪氧式反應、金屬與氧化性酸反應、多氧化合物反應的化學方程式配平感到無從下手。
筆者認為,化學方程式是后續學習化學計算和化學應用的基礎。為化學方程式的書寫建構有效的思維模型,有助于學生科學認識化學反應過程中的物質變化規律,提高學生學習化學的興趣和學科思維品質,進而發展學生的模型認知學科素養。
一、模型及模型認知的概念解析
(一)關于模型
“模型”一詞在拉丁語中寫作modulus,意思是尺度、樣本、標準。學界有關模型的觀點主要有三種:其一,模型是與真實物體單一事件或一類事物相對應且具有解釋力的試探性體系或結構;其二,模型是一種科學認知的工具,包括科學方法和科學操作;其三,模型是概括、抽象和簡化了的原型,它的合理性需要通過邏輯和實驗來檢驗。
(二)關于模型認知
《普通高中化學課程標準(2017年版)》首次凝練了化學學科核心素養,其中便包括一個“證據推理與模型認知”核心素養,涉及“模型認知”的解釋為“知道可以通過分析、推理等方法認識研究對象的本質特征、構成要素及其相互關系,建立認知模型,并能運用模型解釋化學現象,揭示現象的本質和規律”。
有學者明確提出:模型認知是運用模型思想(模型方法)認識事物和解決問題的思維方法。
(三)關于模型建構
筆者以為,模型建構指的是通過思維建模活動,可視化地表征、歸納、分析、解釋知識或問題的過程,體現思維的系統性。化學建模可以使學生對研究對象或學習內容的認識思路外顯,便于建立結構化的知識體系。
二、化學方程式書寫中的模型建構與應用
化學方程式書寫涉及的知識面廣、綜合性強,需要學生有系統的化學知識以及分析和解決實際問題的能力。在化學方程式書寫中確立模型建構的思想方法,有助于加深學生對知識和概念的理解,培養學生的學科思維和模型認知學科素養。從學生在化學方程式書寫中的常見問題出發,筆者決定從三個方面入手,培養學生的模型認知素養。
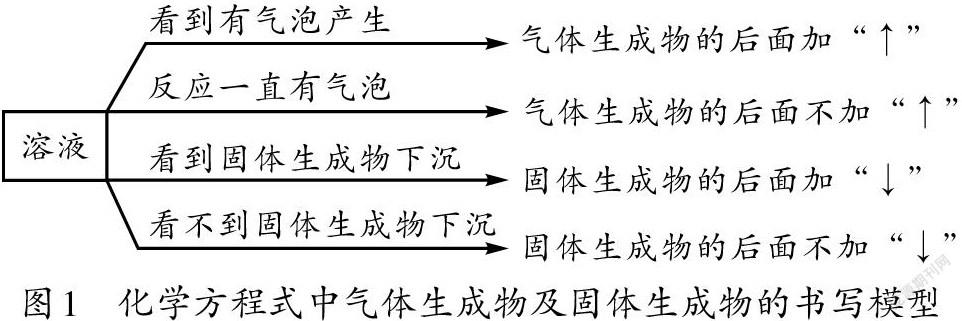
(一)構建化學方程式中氣體生成物符號“↑”和固體生成物符號“↓”的書寫模型
很多學生弄不清楚化學方程式中的氣體符號“↑”和固體符號“↓”的書寫規律,為此,教師可以在授課過程中幫助學生建立一個如圖1所示的直觀模型。首先,化學反應一般都是在溶液中進行。其次,反應物中不需要標記氣體或固體符號。再次,如果生成物中有氣體產生,應能看到液體中有向上的氣泡產生,故而要在氣體生成物的后面加上“↑”符號,但這需要一個前提,即反應物中無氣體;如果反應物中有氣體,則在化學反應過程中會一直有氣泡存在,就算生成物中也有氣體,很難區分哪些氣泡是反應物的、哪些氣泡是生成物的,于是氣體生成物的后面便不能加“↑”符號。最后,關于固體符號的書寫,與氣體符號書寫的道理相同:如果能看到液體中有固體生成物下沉,則應在固體生成物的后面加上“↓”符號;如果反應物中已有固體,在反應過程中不能看到固體生成物下沉,則固體生成物的后面不能加“↓”符號。
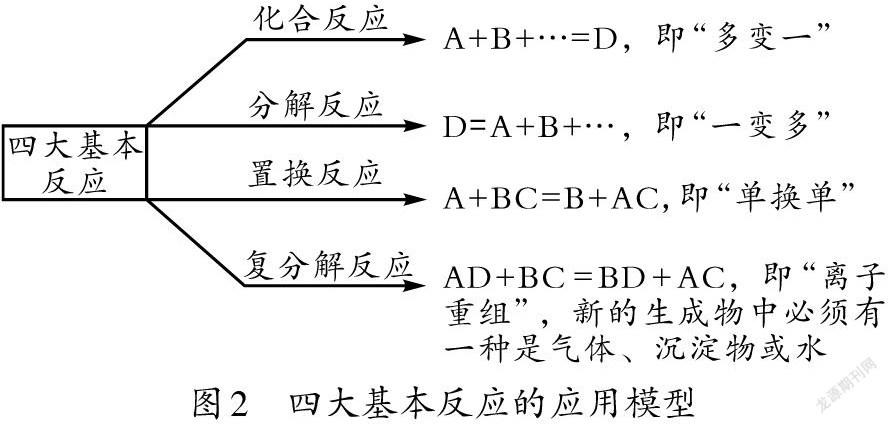
(二)四大基本反應的應用模型
初中所學的化學方程式較多,用模型思想來解釋和記憶,可梳理出化合反應、分解反應、置換反應、復分解反應四大基本反應及其反應模型,如圖2所示。
化合反應是通過化學變化將多種物質合成一種物質的反應,分解反應是通過化學變化將一種物質分解成多種物質的反應,二者的反應過程剛好相反,可借此促進學生形成互逆的關聯思維。例如:學習2H2+O2[點燃]2H2O這個化合反應后,可以想到通過分解H2O得到H2和O2,這樣,之后學到電解水的反應原理時就很容易理解2H2O[通電]H2↑+O2↑這個分解反應了。
置換反應的原理是一種單質去占取一種化合物中的某一個位置,把相應位置的另一種元素以單質的形式置換出來。為什么A單質可以去占取B的位置呢?原因在于,化學變化中能力強的物質往往會搶去能力弱的物質的位置。將該模型應用于理解金屬活動性順序表中排序的奧秘,可知:排在前面的活潑金屬可以將排在后面的不活潑金屬從它的鹽溶液中置換出來、使之變成單質;排在氫前面的金屬可以與酸反應置換出氫氣,而排在氫后面的金屬不能與酸反應。
復分解反應是兩種物質都分解后再重新組合,強調的是分解的過程,所以反應物必須是化合物,且反應物、生成物往往都是酸、堿、鹽。復分解反應的本質在于:反應物先在水溶液中解離成陰、陽離子,這些陰、陽離子再重新組合,形成新的物質,新的物質中必定有一種物質是固體、氣體或水,這個復分解反應才可能發生。教師可引導學有余力的學生思考強酸制弱酸、強堿制弱堿的反應原理,強化初中、高中化學知識的銜接。
(三)不同類型化學方程式的配平模型
所有化學變化都符合質量守恒定律,即參加反應前各物質的質量總和等于反應后生成物各物質的質量總和,也就是說,化學反應前后原子的種類、數目和質量都沒有改變。因此,配平化學方程式的過程便是清楚地體現這種“質量守恒”的過程。
1.奪氧式反應的化學方程式配平模型
初中化學介紹了用熱還原法還原金屬礦物從而得到金屬材料的知識,這一類反應的本質是奪取化合物中的氧原子,可簡稱為奪氧式反應。此類反應通常需要高溫條件支持,常用的還原劑有一氧化碳、氫氣和碳。
以CO還原FeO為例,其化學反應式是CO+FeO—Fe+CO2,微觀過程如下:1個CO分子需要得到1個O原子變成1個CO2分子,而FeO剛好可以提供1個O原子后將自身變為1個Fe原子,從而完成該化學反應方程式的配平,CO+FeO[高溫]Fe+CO2。再如CO還原Fe2O3,其化學反應式是CO+Fe2O3—Fe+CO2,微觀過程如下:1個Fe2O3中有3個O原子和2個Fe原子,3個O原子需要3個CO分子來奪取,所以CO前需要配個3;相應地,CO2前也要配個3,即3CO+Fe2O3[高溫]2Fe+3CO2。于是,教師可以為學生建構如圖3所示的以CO為還原劑的熱還原法制取金屬單質的化學方程式配平模型。
換成是用氫氣或碳作為還原劑,其微觀分析及建模類似,此處不再贅述。
運用模型建構的方法展開課堂教學,可以激發學生的學習興趣,降低學生的學習難度,發展學生的化學建模思維。
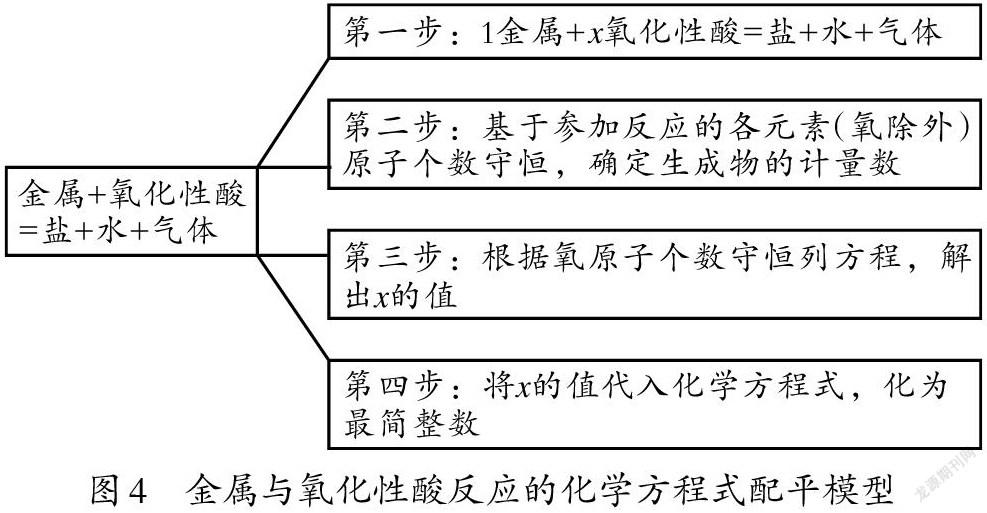
2.金屬與氧化性酸反應的化學方程式配平模型
眾所周知,金屬與酸反應一定有對應的鹽生成,其中:H+如果不變成H2就會生成水;酸根離子則生成對應的氣體,如濃硫酸生成二氧化硫、濃硝酸生成二氧化氮、稀硝酸生成一氧化氮。為這類化學方程式建模,即金屬+氧化性酸=鹽+水+氣體。用觀察法配平此類方程式比較困難,加上此時學生還沒有學習利用氧化還原反應配平化學方程式的方法,教師可以指導學生借用數學建模的方法完成對此類化學方程式的配平。假設有兩種反應物,設簡單反應物的化學計量數為1、復雜反應物的計量數為x,其配平過程如圖4所示。
以配平Cu+HNO3(稀)—Cu(NO3)2+NO+H2O為例:第一步,設Cu的計量數為1,HNO3(稀)的計量數為x,則1Cu+xHNO3(稀)—Cu(NO3)2+NO+H2O。第二步,根據Cu原子守恒,則Cu(NO3)2的計量數為1;根據N原子守恒,NO的計量數為x-2;根據H原子守恒,H2O的計量數為x/2。于是可得:1Cu+xHNO3(稀)—1Cu(NO3)2+(x-2)NO+(x/2)H2O。第三步,根據O原子個數守恒列方程3x=6+(x-2)+(x/2),解得x=8/3。第四步,將x=8/3代入化學方程式并化簡成整數,得3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O。
其實,運用數學建模方法可以配平所有的化學方程式,且更易于學生理解化學方程式中“=”的意義。
3.多氧化合物反應的化學方程式配平模型
以多氧化合物K2O2、KO2、KO3與H2O反應的化學方程式為例,對比K2O2+H2O—KOH+O2,KO2+H2O—KOH+O2和KO3+H2O—KOH+O2可發現,它們的基本模型是K2O+H2O=2KOH,四個反應中都生成了KOH,只是前三個反應的生成物中還生成了O2,O2來自K2O2、KO2、KO3這些多氧化合物,把這些多氧化合物與基本模型中的K2O比較,存在這樣一條規律:K2O2比K2O多1個氧原子,因此1個K2O2與H2O反應就產生1個O;2個KO2比K2O多3個氧原子,因此2個KO2與H2O反應就產生3個O;2個KO3比K2O多5個氧原子,因此2個KO3與H2O反應就產生5個O。于是,上述三個反應就非常容易配平了。
K2O2+H2O=2KOH+1/2O2↑
2KO2+H2O=2KOH+3/2O2↑
2KO3+H2O=2KOH+5/2O2↑
再把上述三個方程式的化學計量數化為整數,可得:
2K2O2+2H2O=4KOH+O2↑
4KO2+2H2O=4KOH+3O2↑
4KO3+2H2O=4KOH+5O2↑
歸類整理多氧化合物反應的化學方程式配平方法,可以得出如圖5所示的配平模型。
化學方程式的書寫是整個中學化學學習的重點和難點,模型思想是化學學科的核心思想之一,用模型建構的方法培養學生化學方程式書寫中的系統性思維,進而提高其研究和解決問題的能力,是核心素養導向下的初中化學教學改革的基本方向。
參考文獻
[1]雷范軍.新課程教學中強化訓練化學模型方法初探.化學教育,2006,27(4):16-18,27.
[2]美國國家研究理事會.美國國家科學教育標準[M].戢守志,金慶和,梁靜敏,等,譯.北京:科學技術文獻出版社,1999:76.
[3]查有梁.教育建模[M].南寧:廣西教育出版社,1998.
[4]周正祥,楊玉琴.指向“證據推理與模型認知”的教學設計:以“原子結構模型的演變”為例.化學教育(中英文),2018,39(23):25-30.
注:本文系廣西教育科學“十三五”規劃A類課題“基于化學學科核心素養的初高中銜接教學策略研究”(2019A048)的階段研究成果。
作者簡介:廖小正(1967— ),廣西全州人,高級教師,主要研究方向為中學化學教學。
(責編 白聰敏)

