ZBED6基因敲除豬腎臟轉錄組分析
田文杰,王丹丹,王圣楠,馬月輝,蔣 琳,宋子儀
(1.廣西大學動物科學技術學院,南寧 530000;2.中國農業科學院北京畜牧獸醫研究所,北京 100193)
鋅指BED結構域結合蛋白6(zinc finger BED domain-containing protein 6,ZBED6)是近些年發現的胎盤類哺乳動物特有、序列高度保守的轉錄調控因子[1]。在家豬體內研究發現,胰島素樣生長因子2(insulin-like growth factor 2,IGF2)基因內含子3發生了G→A的突變,破壞了ZBED6對IGF2表達量的抑制,因此家豬中IGF2基因表達量增高,從而影響了內臟器官、肌肉及脂肪的生長發育[2-3]。研究顯示,ZBED6基因編輯巴馬香豬和兩廣小花豬的IGF2基因表達量上調,產肉量增多[4-6];ZBED6基因敲除小鼠IGF2基因表達量升高,肌肉增多[7];ZBED6基因可抑制黃牛IGF2基因表達及肌肉發育[4-5];ZBED6基因的遺傳變異與綿羊眼肌面積、尾脂重、背部肌肉厚及背最長肌重等主要胴體性狀顯著相關[6];在小鼠和牛肌原細胞中沉默ZBED6基因,結果顯示IGF2基因高表達,促進成肌細胞的增殖和分化[8-9],以上研究均說明了ZBED6-IGF2軸對肌肉發育的重要作用。
目前,ZBED6基因在豬上的研究主要集中于生長發育調控,對于豬腎臟代謝作用的研究鮮見報道。Markljung等[1]對ZBED6基因KO小鼠腎臟轉錄組研究發現,差異基因主要集中于磷酸化等代謝通路。Younis等[7]利用染色質免疫共沉淀(chromatin immunoprecipitation,ChIP)技術對小鼠C2C12細胞進行測序分析發現,在ZBED6約1 200個潛在靶基因(包含IGF2基因)中,有約22%的靶基因編碼其他各種轉錄因子,由此推測除生長發育外,ZBED6可能具有其他復雜的生理功能。
本研究以前期通過CRISPR/Cas9技術構建成功的ZBED6 KO巴馬香豬[10]與WT巴馬香豬為研究對象,采集腎臟組織進行轉錄組分析,篩選在ZBED6 KO和WT巴馬香豬腎臟組織中差異表達基因并分析相關功能,以期為進一步揭示ZBED6基因的分子調控機制提供參考依據。
1 材料與方法
1.1 樣品采集
試驗豬選自中國農業科學院北京畜牧獸醫研究所大興豬場實驗基地,利用CRISPR/Cas9技術完成ZBED6基因敲除。選擇8月齡ZBED6基因敲除雌性巴馬香豬(編號為1、3、6)和野生型對照同性別巴馬香豬(編號為2、4、5)各3頭屠宰,采集腎臟(ZBED6 KO:腎臟1、腎臟3、腎臟6;WT:腎臟2、腎臟4、腎臟5),迅速投入液氮中保存備用。
1.2 主要試劑及儀器
RNAsimple總RNA提取試劑盒購自天根生化科技(北京)有限公司;RT-PCR試劑盒、SYBR Green試劑盒均購自TaKaRa公司;TruSeq試劑盒購自Illumina公司。Agilent 2100生物分析儀和ABI7500實時熒光定量儀均購自ABI公司。
1.3 實時熒光定量PCR檢測ZBED6基因敲除對豬腎臟組織中IGF2基因表達量的影響
使用RNAsimple總RNA提取試劑盒提取腎臟組織總RNA,使用Agilent 2100生物分析儀檢測RNA濃度,1.5%瓊脂糖凝膠電泳檢測RNA完整性,質量合格的RNA樣品于-80 ℃保存備用。
使用RT-PCR試劑盒對RNA進行反轉錄得到cDNA。選用GAPDH作為內參基因,使用Primer Premier 5.0軟件選擇目的基因CDS區來設計引物,引物序列見表1。引物均由華大基因有限公司合成。
PCR反應體系20 μL:上、下游引物各0.4 μL,cDNA模板3 μL,ddH2O 7 μL,SYBR Green Mix 10 μL。PCR反應程序:95 ℃預變性30 s;95 ℃變性5 s,60 ℃退火34 s,72 ℃延伸15 s,共40個循環。每個樣品設置3個生物學重復,采用2-ΔΔCt方法進行計算。

表1 引物信息
1.4 轉錄組測序分析
1.4.1 RNA-Seq測序 將RNA樣品(濃度>100 ng/μL,總量>2.0 μg,且RIN值>8.0)送至北京貝瑞和康生物科技股份有限公司進行cDNA文庫構建及高通量測序。使用Illumina Hiseq 2500測序平臺分別對上述樣品進行讀長為150 bp的雙末端測序。
1.4.2 原始數據的質控 采用FastQC對下機后數據(raw reads)質量進行基本統計;使用fastp軟件截去測序數據的測序接頭和低質量片段,從而獲得高質量的clean reads。具體操作為:去除含有索引接頭的reads;去除低質量的reads(包含N的比例>10%的reads和低質量堿基QPhred值≤10的堿基數占總堿基數量50%以上的reads);去除過濾后長度<25 bp的reads。
1.4.3 clean reads分析 參考基因組和注釋文件分別采用來自Ensemble數據庫的Susscrofa11.1和gtf100(https:∥asia.ensembl.org/index.html)。通過軟件TopHat、Cufflink、Cuffmerge和Cuffdiff對clean data分別進行參考基因組比對、表達量的量化、轉錄本組裝及差異表達基因分析;用FDR法對P值進行多重校正得到調整后P值,差異表達基因的篩選標準為:P<0.05和log2|FoldChange|>2。
1.5 差異表達基因的層次聚類和KEGG通路富集分析
通過R包繪制火山圖及熱圖,顯示差異表達基因的分布及在ZBED6 KO和WT豬腎臟中的表達;根據檢測到的所有表達基因的FPKM值,對6個腎臟樣品進行主成分分析(PCA)。檢測樣品相關性;對差異表達基因進行KEGG通路富集分析(https:∥biit.cs.ut.ee/gprofiler/gost),根據Fold-enrichment和調整后P值來篩選ZBED6潛在的互作基因。
1.6 實時熒光定量PCR驗證差異表達基因
根據轉錄組測序的結果隨機選取7個差異表達基因(表1),采用實時熒光定量PCR方法驗證測序結果的可靠性,方法同1.3。
1.7 統計分析
組間采用t檢驗分析差異性,數據以平均值±標準誤表示,以P<0.05為差異顯著性判斷標準,利用GraphPad軟件進行繪圖。
2 結 果
2.1 實時熒光定量PCR檢測IGF2基因表達量
通過實時熒光定量PCR檢測IGF2基因在ZBED6 KO和WT豬腎臟組織中的相對表達量,結果見圖1。由圖1可知,敲除ZBED6基因后,豬腎臟中IGF2基因表達量顯著上調(P<0.05),表明ZBED6基因能夠抑制豬腎臟IGF2基因的表達。

*,差異顯著(P<0.05),**,差異極顯著(P<0.01)。圖6同*,Significant difference(P<0.05);**,Extremely significant difference (P<0.01).The same as fig.6圖1 敲除ZBED6基因后豬腎臟中IGF2基因相對表達量Fig.1 Relative expression of IGF2 gene in porcine kidney after ZBED6 gene knockout
2.2 轉錄組測序數據的質量評估及比對
對ZBED6 KO和WT豬腎臟組織總RNA利用轉錄組測序技術進行分析,結果見表2。由表2可知,6個樣品測序共獲得78 G數據量,各樣本質控率和Q30數據均在90%以上,比對率在87%以上,說明測序數據質量良好,可用于下一步生物信息學分析。
2.3 差異表達基因分析
在腎臟組織中利用RNA-Seq測序共鑒定到25 213個基因,與WT豬相比,ZBED6 KO豬中共篩選到299個差異表達基因,其中103個基因上調表達,196個基因下調表達(圖2),IGF2基因同樣在ZBED6 KO豬腎臟中上調表達,與實時熒光定量PCR檢測結果一致。用熱圖展示差異表達基因在所有樣品中表達量的分布情況,結果見圖3。由圖3可知,2組樣品組內均一性較好,但ZBED6 KO和WT豬腎臟中基因表達量存在明顯差異。
根據所有基因表達量FPKM值進行主成分分析,結果見圖4。由圖4可知,WT和ZBED6 KO豬腎臟中表達模式組內相似,但組間截然不同,證明采樣和測序數據可靠。
2.4 差異表達基因KEGG通路富集分析
對獲得的差異表達基因進行KEGG通路富集分析,結果顯示,差異表達基因顯著富集在視黃醇代謝、化學致癌、甲流、藥物代謝、補體和凝聚級聯6條通路中,大多數均與代謝活動相關(圖5),其整體通路結果與腎臟代謝的功能相符。KEGG通路富集分析最顯著的通路為視黃醇代謝通路,其中經典的生物代謝關鍵酶CYP1A1基因同時被富集在視黃醇和細胞色素P450對外源性藥物兩條代謝通路中,說明ZBED6基因敲除對巴馬香豬腎臟組織代謝活動具有重要調控作用。
2.5 差異表達基因實時熒光定量PCR驗證
隨機選擇7個差異表達基因CYP2C42、AOX1、RDH16、CYP2A19、CYP26B1、CYP1A1和RDH5,利用實時熒光定量PCR技術進行RNA-Seq測序數據準確性的驗證,結果見圖6。由圖6可知,與WT豬相比,ZBED6 KO豬腎臟中CYP2C42、CYP2A19、RDH16、CYP1A1和RDH5基因表達量極顯著或顯著下調(P<0.01;P<0.05),AOX1和CYP26B1基因表達量極顯著或顯著上調(P<0.01;P<0.05),與RNA-Seq測序結果相一致,證實了RNA-Seq測序分析結果的準確性。

表2 測序數據質控和比對分析
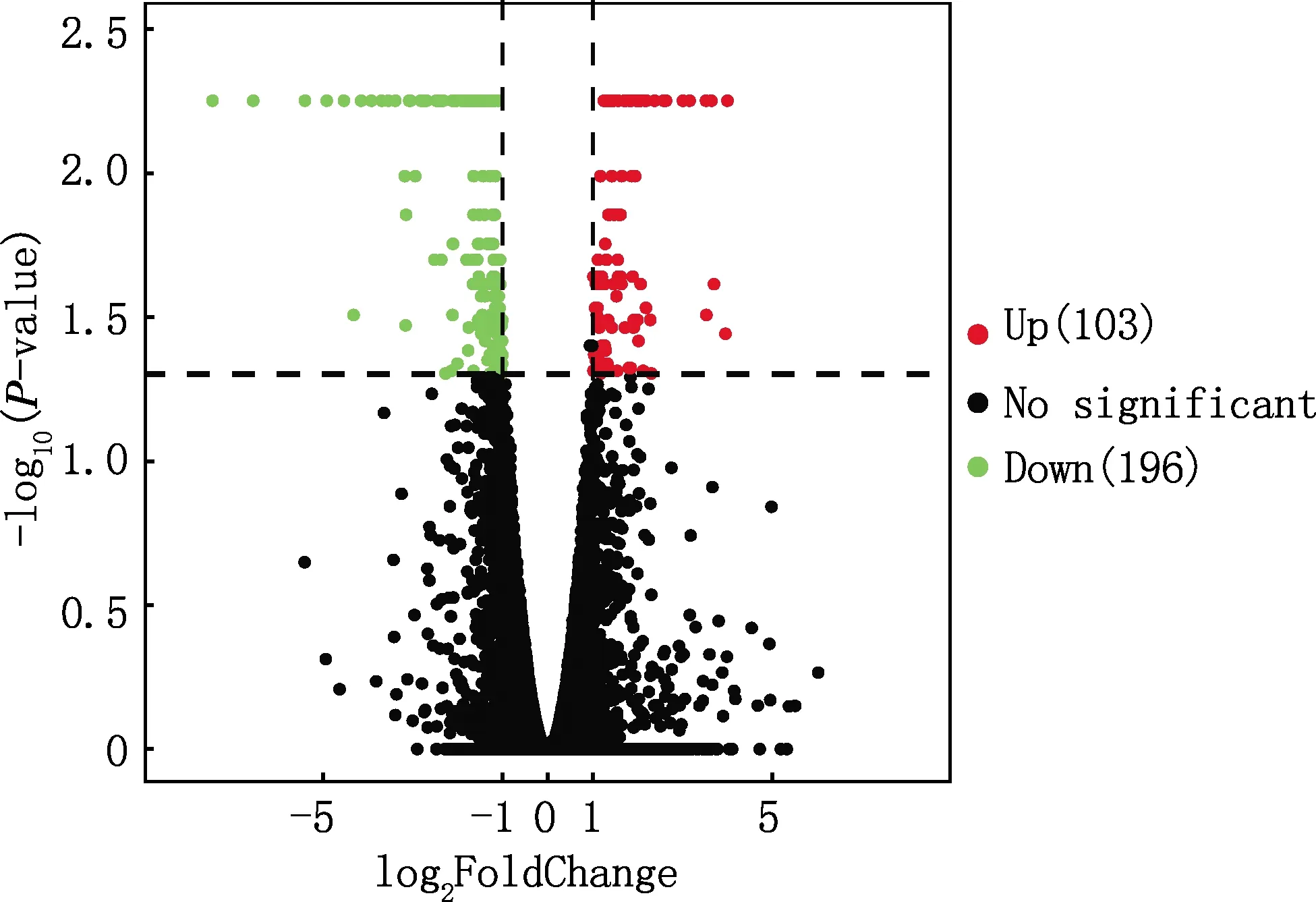
橫虛線為P-value為0.05的閾值;橫虛線往上右邊表示上調基因(103),往上左邊表示下調基因(196);往下表示非顯著差異表達基因Horizontal dotted line was the threshold of P-value=0.05 in the diagram;Above the horizontaldashed line,right represents up-regulated genes(103),left represents down-regulated genes(196),below the horizontal dotted line represents non-significantly differentially expressed genes圖2 差異表達基因火山圖Fig.2 Volcano map of differentially expressed genes
3 討 論
近年來,利用分子生物技術研究基因功能及調控機制已經成為主要途徑。ZBED6是2009年發現并命名的轉錄因子,其序列在多種胎盤類哺乳動物中高度保守[1]。研究發現,ZBED6基因除影響肌肉發育外,在調控小鼠糖脂代謝[11-13]、腸癌細胞生長發育[14]等方面也發揮著重要作用。Younis等[7]利用RNA-Seq技術對ZBED6基因敲除(ZBED6 KO)小鼠腎臟組織分析發現,其差異表達基因主要富集在氧化磷酸化、運輸活動等與代謝相關通路中,表明ZBED6基因敲除除能夠促進肌肉生長外,對小鼠腎臟代謝反應同樣具有重要作用。然而,關于ZBED6基因對豬腎臟代謝調控的研究鮮見報道。
本研究中,實時熒光定量PCR結果顯示,ZBED6基因敲除后豬腎臟組織中IGF2基因表達量顯著上調;RNA-Seq分析結果發現,ZBED6 KO豬腎臟組織中表達上調的103個基因中也包含IGF2基因,與Younis等[7]結果相一致,說明ZBED6同樣能夠抑制豬腎臟中IGF2基因的表達。近年來研究發現,小鼠ZBED6基因還可通過影響胰腺β細胞功能、胰島素產生進而調控糖脂代謝[11-13]。本研究中,差異表達基因顯著富集在6條與代謝相關的通路上,分別為視黃醇代謝、化學致癌、甲流、 藥物代謝、補體和凝聚級聯。

圖3 差異表達基因熱圖Fig.3 Heat map of differentially expressed genes

圖4 主成分分析圖Fig.4 Principal component analysis map
提示在豬中ZBED6基因除通過抑制IGF2基因而影響肌肉生長發育外,可能同樣對腎臟代謝發揮著重要作用。KEGG通路富集分析中最顯著的通路為視黃醇代謝通路,視黃醇又稱維生素A,是多種生物過程必需的微量營養素,包括視覺、胚胎發育、細胞分化、生長發育及免疫系統的調節[15-16]。腎臟是視黃醇一個重要的儲存器官[17],通過其代謝功能維持視黃醇穩態和運轉[18-19]。視黃醇利用乙醇脫氫酶(ADH)[20]、短鏈脫氫酶/還原酶(SDR)[21]、醛酮基還原酶(AKR)[22]和醛脫氫酶 (ALDH)[23]這4個家族成員代謝轉化為視黃酸(RA)進而發揮作用。因此,視黃醇代謝是腎臟組織主要的代謝功能,為ZBED6基因調控豬腎臟代謝提供了有力支撐。

圖5 差異表達基因KEGG通路富集分析Fig.5 KEGG pathway enrichment analysis of differentially expressed genes
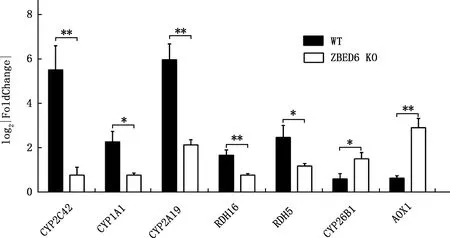
圖6 7個差異表達基因實時熒光定量PCR驗證Fig.6 Real-time quantitative PCR verification of 7 differentially expressed genes
聚乙二醇化姜黃素衍生物Curc-mPEG454通過上調醛氧化酶1(AOX1)、下調細胞色素P45026A1(CYP26A1)和細胞色素P45026B1 (CYP26B1),從而恢復肝臟RA水平。
CYP26B1作為視黃酸清除酶,通過氧化代謝來調節細胞中視黃酸的濃度[24],有助于哺乳動物和其他脊索動物的視黃酸代謝和體內平衡。研究表明,小鼠CYP26B1基因全身敲除會導致胚胎致死,而對出生后小鼠敲除CYP26B1基因雖不致死,但表現出壽命縮短、脂肪萎縮及視黃酸濃度增加[25]。這些結果證明,CYP26B1在視黃酸代謝中發揮著重要的作用[26]。本研究中,ZBED6 KO豬腎臟中AOX1和CYP26B1基因均顯著富集到視黃醇代謝通路上,轉錄組分析與實時熒光定量PCR結果發現,AOX1和CYP26B1基因顯著上調,推測ZBED6基因可能通過同時上調AOX1和CYP26B1基因來調控腎臟組織中視黃酸代謝的動態平衡。
視黃醇能夠合成視黃醛,進而轉化為視黃酸,轉化后的視黃酸會與其靶蛋白進行結合,從而發揮作用。視黃醇脫氫酶5、16(RDH5、RDH16)都是一種蛋白質編碼基因,與視黃醇代謝高度相關[27],其相關途徑包括脂溶性維生素代謝和視黃酸生物合成。研究證明,神經生長因子(NGF)調控RDH16的從頭合成并影響了視黃醇代謝途徑[28]。RDH5基因作為短鏈脫氫酶/還原酶(SDR)家族的成員,具有催化視黃醇合成視黃醛的功能[29]。RDH5基因敲除小鼠可以存活,但在黑暗環境中的反應比較遲緩,說明RDH5基因的缺失導致小鼠體內視黃醇轉化視黃醛減少,視覺能力減緩的性狀一致[30-31]。此外,RDH5基因突變會導致人類患有夜盲癥,證明RDH5基因具有產生視黃醛的功能[32]。本研究發現,RDH5和RDH16基因的表達量在ZBED6 KO豬腎臟組織中顯著下調,提示ZBED6 KO可能通過下調RDH5和RDH16基因表達減少視黃醇轉化為視黃醛。 研究發現,細胞色素P4501A1 (CYP1A1)作為生物代謝的關鍵酶之一,可以將小鼠和人的視黃醛催化為視黃酸[33-34],CYP1A1的誘導劑和抑制劑也會影響小鼠上皮組織中視黃酸的合成[35]。CYP1A1被富集在細胞色素P450對外源性藥物的代謝作用中,早期研究發現,CYP1A1影響一些酶的活性,進而影響大鼠肝臟和腎臟對藥物代謝的效率[36]。本研究中,CYP1A1基因同時被富集在視黃醇代謝和細胞色素P450對外源性藥物的代謝作用2條通路中,CYP1A1基因表達量在ZBED6 KO豬腎臟組織中顯著下調。 因此,ZBED6基因可能通過下調RDH5、RDH16和CYP1A1基因表達,同時上調AOX1與CYP26B1基因的表達在視黃醇-視黃醛-視黃酸的體內代謝和動態平衡調控中發揮重要功能。
4 結 論
本研究發現,ZBED6基因敲除顯著上調了豬腎臟組織中IGF2基因表達量,共篩選到包括IGF2基因在內的103個上調基因和196個下調基因,CYP2C42、CYP1A1、CYP2A19、RDH16、RDH5、CYP26B1及AOX1基因是ZBED6基因調控巴馬香豬腎臟視黃醇代謝的重要靶基因。

