基于網絡藥理學研究連翹葉提取物通過AMPK抗恩諾沙星誘導肝損傷的作用
安志霞,潘陽陽,范碧玥,馬小燕,葉得河,張治杰,邱山桐,姚亞樂,王 萌
(甘肅農業大學動物醫學院,蘭州 730070)
恩諾沙星(enrofloxacin,ENR)又稱乙基環丙沙星、恩氟沙星,屬于第三代氟喹諾酮類抗菌藥,具有廣譜抗菌活性,因此被廣泛應用于畜牧業,是動物專用的抗菌藥[1]。ENR的抗菌機制是抑制細菌DNA旋轉酶,干擾細菌DNA的復制、轉錄和修復重組,使細菌不能正常生長繁殖而發揮殺菌作用[2]。ENR進入體內的代謝產物為環丙沙星。研究表明,人攝入大劑量或長期攝入含有環丙沙星的動物源性食品可能會引起肝損傷[3]。氟喹諾酮類藥物對肝臟的損傷可能是通過產生過氧化物和自由基誘導氧化應激產生的[4-6]。ENR在SD大鼠[7]、施氏鱘[8]、雞[9]等動物模型中均有一定的肝毒性,使試驗動物血清中的谷丙轉氨酶(alanine transferase,ALT)和谷草轉氨酶(aspartate transferase,AST)活性顯著上升[7-9]。
中藥在肝損傷疾病的防治中扮演著越來越重要的角色[10],目前有許多中藥已被證實有良好的保肝效果。連翹是木犀科連翹屬植物,其主要以果實入藥,主要成分有苯乙醇苷類、黃酮類和木脂素類等[11],具有抑菌、抗炎、抗氧化衰老及保肝的藥理活性[12]。趙晨棟等[13]通過試驗發現連翹提取物可能通過抗氧化作用及抑制CYP2E1酶活性,緩解對乙酰氨基酚誘導的肝損傷。連翹葉為木犀科植物連翹的干燥葉,也可供藥用。連翹葉為非藥用部位,一般多被丟棄,對連翹葉的開發利用較少。研究表明,連翹葉的成分主要為黃酮類、多糖類、有機酸類和木脂素類等[14]。據相關分析,連翹葉中的化學成分與連翹果實十分相似,甚至有些成分還高于連翹果實,如連翹苷和連翹脂苷A[15-17]。連翹葉含多種藥理活性,如抗氧化、抑菌及肝保護作用[18-19]。劉靜[20]研究發現,連翹葉提取物(Forsythiasuspenseleaves extract,FSLE)對CCl4誘導的肝損傷具有良好的保護作用;白美美[19]研究發現,連翹葉紅茶對CCl4誘導的肝損傷具有良好的保護作用;朱淑云[21]研究發現,FSLE對四氧嘧啶所致的肝損傷有明顯的保護作用。
網絡藥理學基于系統生物學理論,研究模式為“多成分網絡靶點作用”,為中藥的治療機制、新用途等方面的研究提供了新的研究思路和方法,也廣泛應用于中獸藥的研發。本研究基于連翹葉多成分、多靶點作用的研究思路,應用網絡藥理學技術,通過對FSLE成分、靶點、生物功能及通路分析,探討FSLE治療ENR誘導的肝損傷(ENR-induced liver injury,EILI)的機制,以期為肝損傷的治療提供候選藥物和理論依據。
1 材料與方法
1.1 材料
1.1.1 試驗動物 48只4周齡潔凈級昆明小鼠,體重25 g±3 g,雌雄各半,購自中國農業科學院蘭州獸醫研究所。動物飼養于甘肅農業大學動物醫學院實驗室,自由進食飲水。動物試驗經甘肅農業大學倫理委員會批準(GAU-LC-2020-33)。
1.1.2 主要試劑及儀器 FSLE、生理鹽水、羧甲基纖維素鈉(carboxymethylcellulose sodium,CMC)和ENR(生物技術級)均購自上海源葉生物科技有限公司;AST、ALT、丙二醛(malondialdehyde,MDA)、還原型谷胱甘肽(glutathione,GSH)、過氧化氫(hydrogen peroxide,H2O2)和總超氧化物歧化酶(superoxide dismutase,SOD)檢測試劑盒均購自南京建成生物工程研究所;RIPA裂解液、苯甲基磺酰氟(PMSF)、5×蛋白上樣緩沖液、BCA蛋白試劑盒和超敏ECL化學發光即用型底物均購自北京索萊寶科技有限公司;AMPK多克隆抗體購自上海碧云天生物技術有限公司;β-actin抗體和羊抗兔二抗均購自北京博奧森生物技術有限公司;反轉錄試劑盒和熒光定量試劑盒均購自南京諾唯贊生物科技股份有限公司;TolsZel UP購自北京全式金生物技術有限公司。
YRE2000A旋轉蒸發儀購自鞏義市予華儀器有限責任公司;CT15RE日立微量高速冷凍離心機購自株式會社日立制作所;SpectraMax i3x多功能酶標測定儀購自Molecular Devices公司;Amersham Imager600全自動化學發光成像系統購自GE公司;LightCycler96熒光定量PCR儀購自羅氏集團;蛋白電泳儀及轉膜裝置購自Bio-Rad公司;Scientz-48L冷凍型高通量組織研磨器購自寧波新芝生物科技股份有限公司;Alpha1-2冷凍干燥機購自CHRIST公司;Leica ASP300S自動組織脫水機、HistoCore Arcadia H石蠟包埋機和HistoCore MULTICUT輪轉式切片機均購自萊卡公司。
1.2 FSLE制備及其有效成分鑒定
1.2.1 連翹葉來源及提取物的制備 2020年8月中旬于甘肅省天水市秦嶺鎮采摘連翹葉,于通風處自然晾干,并儲存至陰涼干燥處,使用前將連翹葉研制為粉末。
稱取30 g連翹葉粉末,按照料液比1∶8加入60%乙醇,浸泡20 min,60 ℃水浴回流1 h,抽濾,收集濾液,濾渣中加入60%乙醇240 mL,纖維素酶0.15 g,50 ℃水浴回流2 h,抽濾,合并2次濾液,于50 ℃旋轉蒸發,旋轉蒸發后置于冷凍干燥機凍干,收集FSLE凍干后的產物,并將其研制為粉末,置于陰涼干燥處。
1.2.2 FSLE有效成分鑒定及初步篩選 將1 g凍干后的FSLE粉末送至南京集思慧遠生物科技有限公司使用液相-質譜法(LC-MS)檢測成分。
LC-MS條件:液相色譜柱,Waters ACQUITY UPLC HSS T3(2.1 mm×100 mm,1.8 μm);液相色譜A相為水相,含5 mmol/L乙酸銨和5 mmol/L乙酸,B相為乙腈;樣品盤溫度,4 ℃;進樣體積,3 μL;分析時間,15 min。
質譜參數:鞘氣流速,30 Arb;輔助器流量,10 Arb;毛細管溫度,350 ℃;碰撞能量,NCE模式下10/30/60;噴霧電壓,正離子模式4.0 kV,負離子模式-3.8 kV。
1.3 網絡藥理學分析
1.3.1 FSLE活性成分篩選 將FSLE主要有效成分的CAS號輸入到PubChem(https:∥pubchem.ncbi.nlm.nih.gov/)中,下載2D結構,將下載好的結構導入到Swiss ADME數據庫(http:∥www.swiss adme.ch/)中,以胃腸吸收為“High”,類藥性大于2個“YES”為依據篩選FSLE活性成分。
1.3.2 FSLE活性成分靶點與肝損傷靶點的獲取 將篩選后的活性成分導入到Swiss Target Prediction網站中(http:∥www.swiss target prediction.ch/),預測FSLE相關靶點,并進行整理,去重。
在GeneCards(http:∥www.genecards.org/)數據庫中輸入“Drug-induced liver injury”,作為EILI靶點,并對數據進行整理,去掉分數較低的靶點。
1.3.3 FSLE治療EILI核心靶點的篩選 將FSLE及EILI的活性成分靶點分別導入到STRING(https:∥cn.string-db.org/)數據庫,獲得各自的蛋白互作網絡,通過Cytoscape 3.8.0軟件中的Merge交集功能篩選核心靶點。
1.3.4 FSLE治療EILI的GO功能、KEGG通路富集分析 取FSLE和EILI靶點的交集靶點,使用Metascape(https:∥metascape.org/)在線分析工具進行FSLE治療EILI的GO功能和KEGG通路富集,物種選擇為Homosapiens。通過微生信在線網站(http:∥www.bioinformatics.com.cn/)進行繪圖。
1.3.5 成分-靶點-信號通路可視化網絡的構建 將篩選得到的FSLE活性成分-疾病交集靶點及通路整理為nextwork.xsml文件,并編輯好type文件導入到Cytoscape 3.8.0軟件,構建“成分-靶點-信號通路”可視化網絡。
1.4 動物模型體內驗證
1.4.1 動物分組及給藥 取2 g FSLE溶于生理鹽水中,分別配制成200、400和600 mg/kg的藥液,將ENR溶于0.5% CMC溶液中配制為350 mg/kg的藥液,4 ℃保存備用。適應性飼喂1周后,將48只昆明小鼠隨機分為6組:空白組(NC組)、FSLE對照組(FSLE組,600 mg/kg)、EILI模型組(LD組)、連翹葉低劑量治療組(LFSLE+LD組,200 mg/kg)、連翹葉中劑量治療組(MFSLE+LD組,400 mg/kg)、連翹葉高劑量治療組(HFSLE+LD組,600 mg/kg)。其中NC組灌胃0.5% CMC溶液,FSLE組灌服600 mg/kg FSLE;除NC組與FSLE組外,其余組小鼠均給予等量的ENR 350 mg/kg,每日2次連續4 d,在給藥4 d后,LFSLE+LD、MFSLE+LD和HFSLE+LD組分別按200、400和600 mg/kg的劑量灌胃給予FSLE藥液,每日2次,連續3 d,其余各組灌胃給予等量的0.5% CMC溶液。
1.4.2 小鼠肝臟功能指標的測定 在試驗第7天給藥后禁食12 h,不限制飲水,小鼠眼眶靜脈叢采血,室溫條件下靜置30 min,4 ℃、3 000 r/min離心10 min分離血清,嚴格按照試劑盒說明書測定ALT及AST的活性。
1.4.3 小鼠肝臟組織病理形態學觀察 采集各組小鼠肝臟同一部位組織,固定于4%多聚甲醛中,固定24 h以上,經過脫水、浸蠟、透明、包埋、切片后HE染色,于光學顯微鏡下觀察各組小鼠肝臟組織的病理形態學特征。
1.5 FSLE對小鼠肝損傷關鍵靶點AMPKα1和AMPKα2表達的影響
1.5.1 小鼠肝臟AMPKα1和AMPKα2基因表達 采用Trizol法提取小鼠肝臟總RNA,反轉錄為cDNA,采用實時熒光定量PCR檢測AMPK通路關鍵基因AMPKα1和AMPKα2表達,以β-actin為內參,引物信息見表1。引物均由生工生物工程(上海)股份有限公司合成。

表1 實時熒光定量PCR引物序列
1.5.2 小鼠肝臟組織AMPKα1和AMPKα2蛋白表達 稱取小鼠肝臟組織80 mg左右,加入1 mL含蛋白酶抑制劑的RIPA裂解液,充分裂解30 min后28 820 r/min離心5 min,取上清液,BCA法測定蛋白濃度,按蛋白上樣緩沖液∶蛋白樣1∶4的比例加入5×蛋白上樣緩沖液,100 ℃水浴10 min,進行10% SDS-PAGE、轉膜、封閉,加入一抗(AMPK多克隆抗體,稀釋比1∶900,β-actin(單克隆抗體,1∶4 000稀釋),4 ℃孵育過夜。PBST清洗30 min后,加入二抗(羊抗兔,1∶5 000稀釋)室溫孵育2 h,PBST清洗60 min,ECL顯影成像,Image J軟件分析條帶。
1.6 小鼠肝臟氧化應激指標測定
取適量肝臟樣品制成10%勻漿,4 ℃、2 500 r/min離心10 min取上清液備用。按照試劑盒說明書測定SOD活性及GSH、MDA和H2O2含量。
1.7 數據處理與統計分析
試驗數據應用統計學軟件GraphPad Prism 9.0進行t檢驗和單因素方差分析(One-way ANOVA)考察組間差別,試驗結果以平均值±標準差表示,P<0.05表示差異顯著。
2 結 果
2.1 FSLE有效成分初步鑒定
由圖1可知,FSLE成分較多且較復雜,由獲得的精確分子質量及相關文獻報道,并結合本課題組研究,對FSLE的主要有效成分進行初步篩選。主要篩選具有保肝作用的成分,具體成分見表2。初步鑒定得到31種活性成分,主要為30種黃酮類化合物和1種五環三萜類化合物熊果酸,其余成分主要為萜類、木脂素及有機酸。
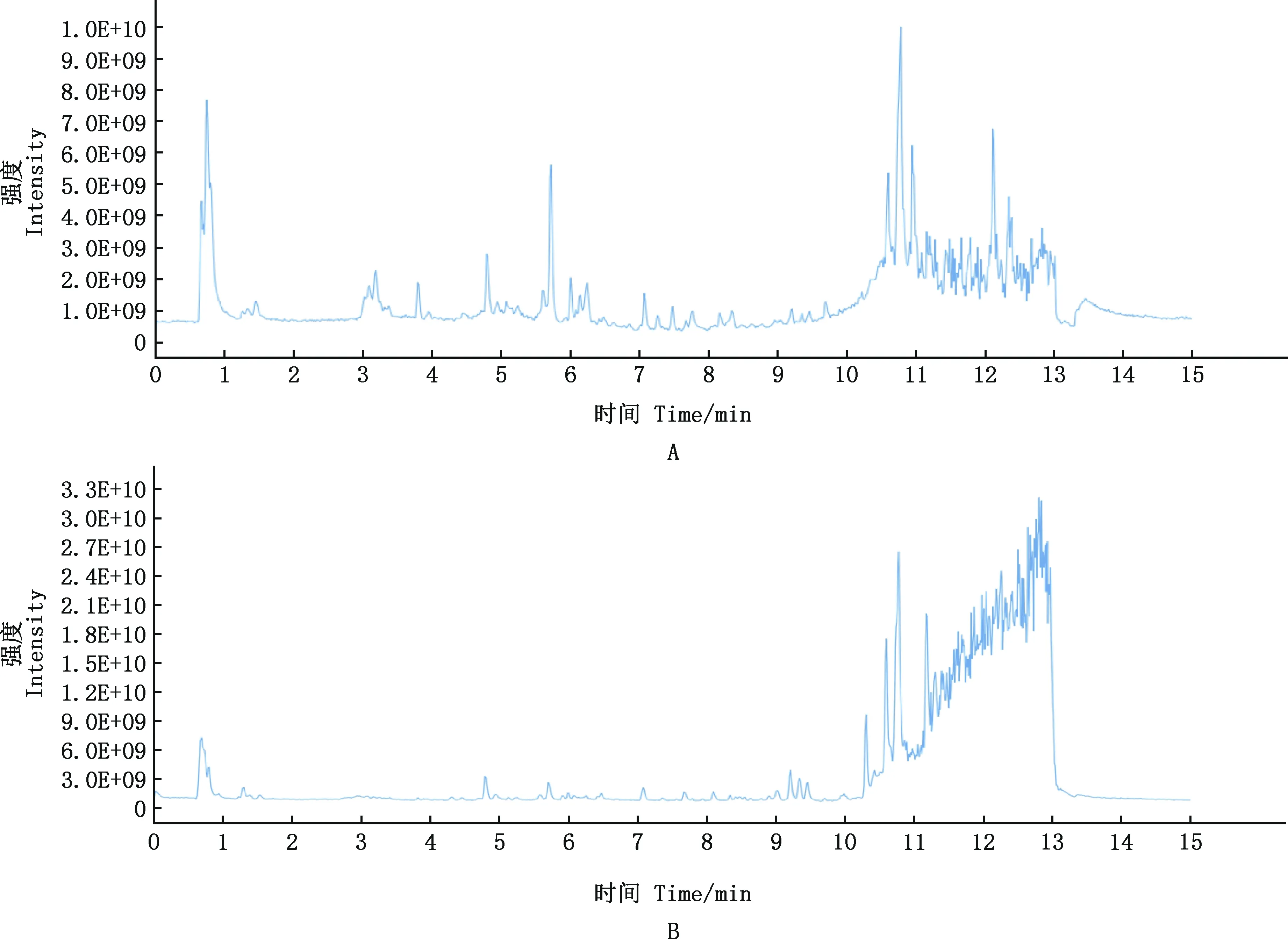
A,FSLE正離子流色譜圖;B,FSLE負離子流色譜圖A,Positive flow chromatography of FSLE;B,Negative flow chromatography of FSLE圖1 FSLE離子流色譜圖Fig.1 Total ion current chromatogram of FSLE
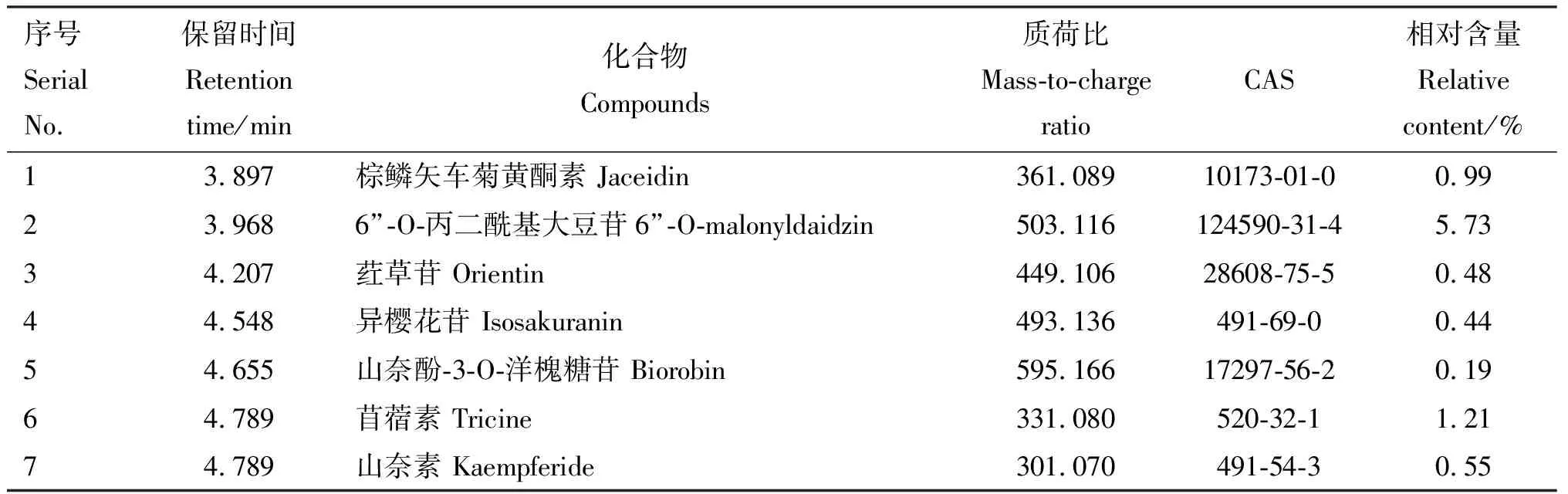
表2 FSLE主要有效成分
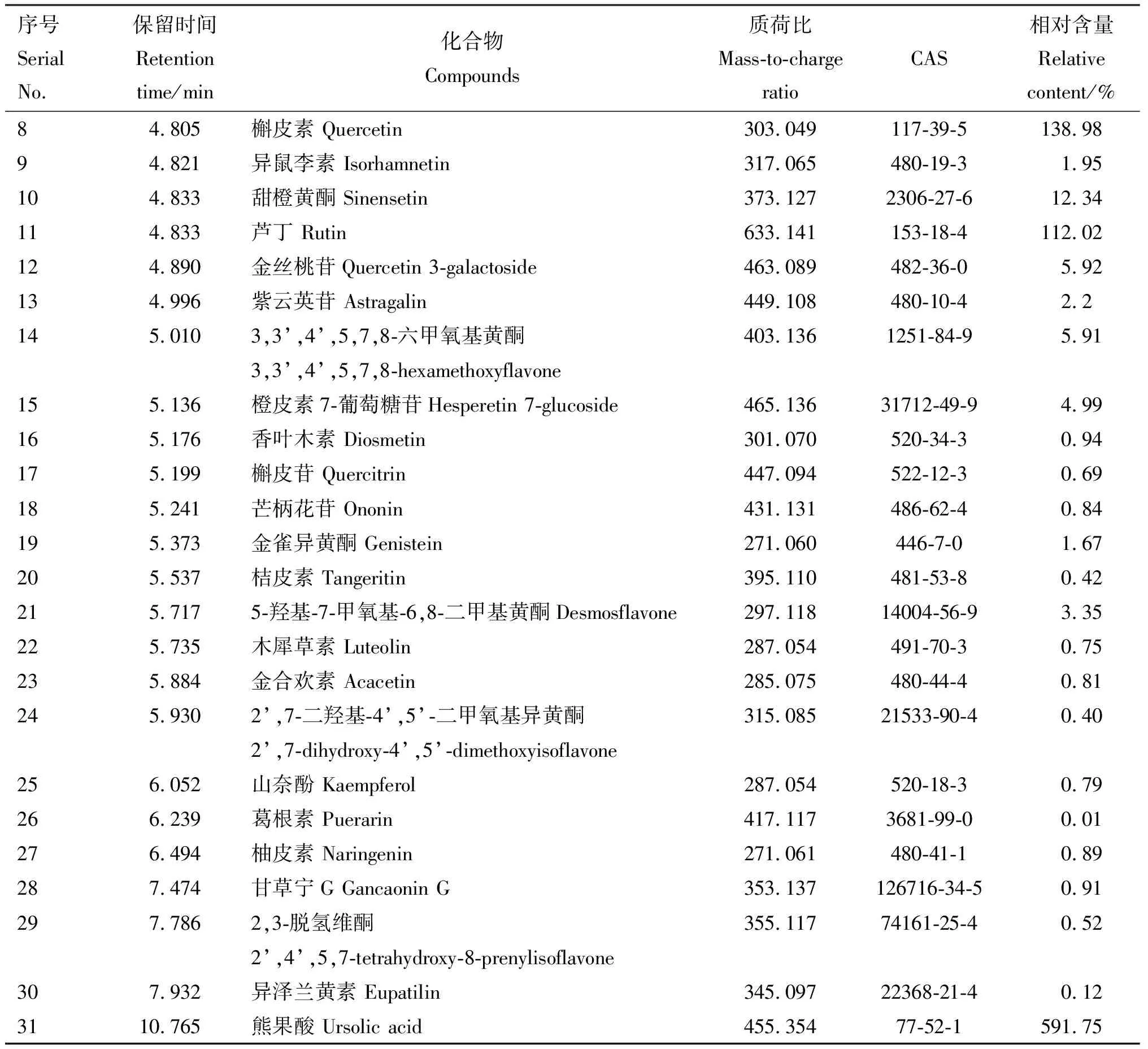
續表
2.2 網絡藥理學分析
2.2.1 FSLE活性成分篩選 將31種成分根據胃腸吸收及類藥性進行篩選,得到20種活性成分,包含19種黃酮類化合物及1種五環三萜類化合物(表3)。 熊果酸的胃腸吸收較低,但由于其含量較高,且有明確的保肝作用,因此也選為活性成分。
2.2.2 FSLE活性成分及疾病靶點預測 將所選活性成分導入到Swiss Target Prediction中,整理去重后得到相關藥物成分靶點338個。通過GeneCards數據庫搜索“Drug-induced liver injury”作為EILI的靶點,整理去掉分值較低的靶點后共篩選出913個疾病靶點,作為候選靶點。
2.2.3 FSLE治療肝損傷核心靶點篩選 通過STRING在線網站及Cytoscape 3.8.0軟件中的Merge功能進行篩選,得到12個核心成分靶點(圖2)。FSLE可能通過作用于MAPK1、MAPK3、ESR1、PIK3CA、HSP90AA1、SRC、APP、PIK3R1、MAPK8、EGFR、VEGFA和AKT1靶點治療EILI。
2.2.4 FSLE治療EILI的GO功能和KEGG通路富集分析 在Excel表格中取FSLE與EILI的交集,即得124個交集靶點。將交集靶點輸入到Metascape中進行GO功能和KEGG通路富集分析。GO功能分析繪制為柱狀圖(圖3),其中,生物過程涉到細胞對化學應激的作用、對無機物的作用、細胞對氮化合物的作用和激酶活性的正調控的過程等;細胞組分涉及到膜筏、囊泡腔、受體復合體和膜面等成分;分子功能涉及到蛋白激酶活性、磷酸酶結合、蛋白絲氨酸/蘇氨酸激酶活性和核受體活性等。根據P<0.05,篩選出排名前20的KEGG通路富集分析并繪制成氣泡圖(圖4)。KEGG通路富集分析顯示,FSLE治療EILI的通路主要富集在癌癥通路、流體剪切應力與動脈粥樣硬化通路、癌癥中的microRNA通路、膀胱癌、癌癥中的轉錄失調、5-HT神經突觸、AMPK信號通路、卵巢類固醇生成、軸突導向、鈣信號通路、細胞因子與細胞因子受體相互作用、藥物代謝等。去掉與癌癥相關及與肝損傷無關的通路,FSLE治療肝損傷的直接通路有:AMPK信號通路、細胞因子與細胞因子受體的相互作用、藥物代謝、補體和凝血級聯、p53信號通路、膽汁分泌、酪氨酸代謝、PPAR信號通路和色氨酸代謝。
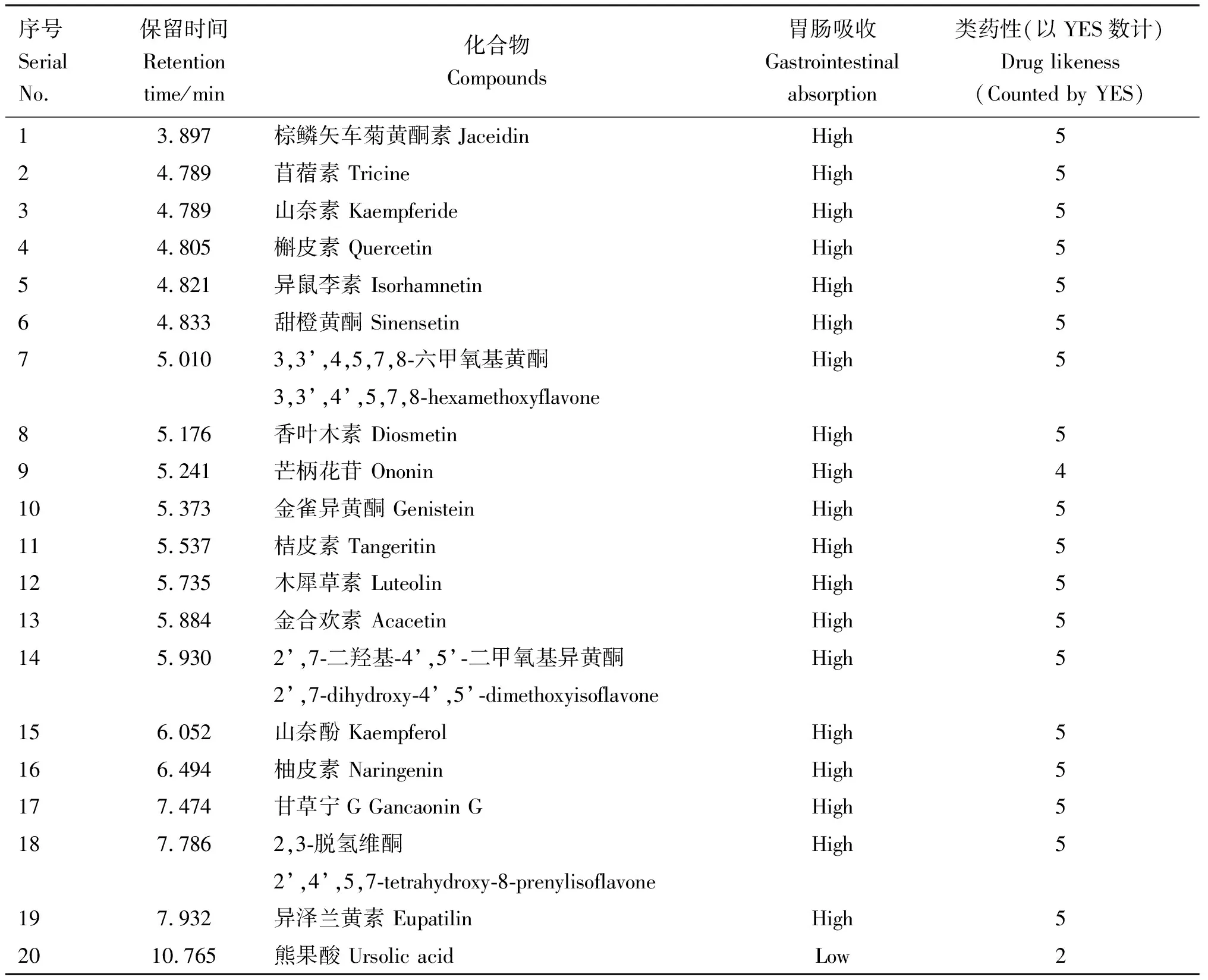
表3 FSLE活性成分
2.2.5 成分-靶點-信號通路可視化網絡 將FSLE活性成分靶點、藥物與疾病交集靶點和通路相關靶點導入到Cytoscape 3.8.0軟件繪制“成分-靶點-信號通路”可視化網絡(圖5)。采用Network Analyzer計算網絡拓撲參數,結果顯示,該網絡的節點數為378,邊數為1 915。可看出FSLE治療EILI各靶點之間密切連接。FSLE中成分的平均度值(Degree)為69.80,其中高于平均Degree值的成分有13種,Degree值排名前5的分別為棕鱗矢車菊黃酮素、甜橙黃酮、桔皮素、異澤蘭黃素和山奈素;信號通路的平均Degree值為11.31,其中高于平均Degree值的通路有5條,分別為癌癥通路、癌癥中的microRNAs通路、流體剪應力和動脈粥樣硬化、癌癥中的轉錄失調和AMPK信號通路。除去癌癥相關通路,FSLE治療EILI的關鍵通路為AMPK信號通路,故FSLE可能通過AMPK通路發揮治療EILI的作用。
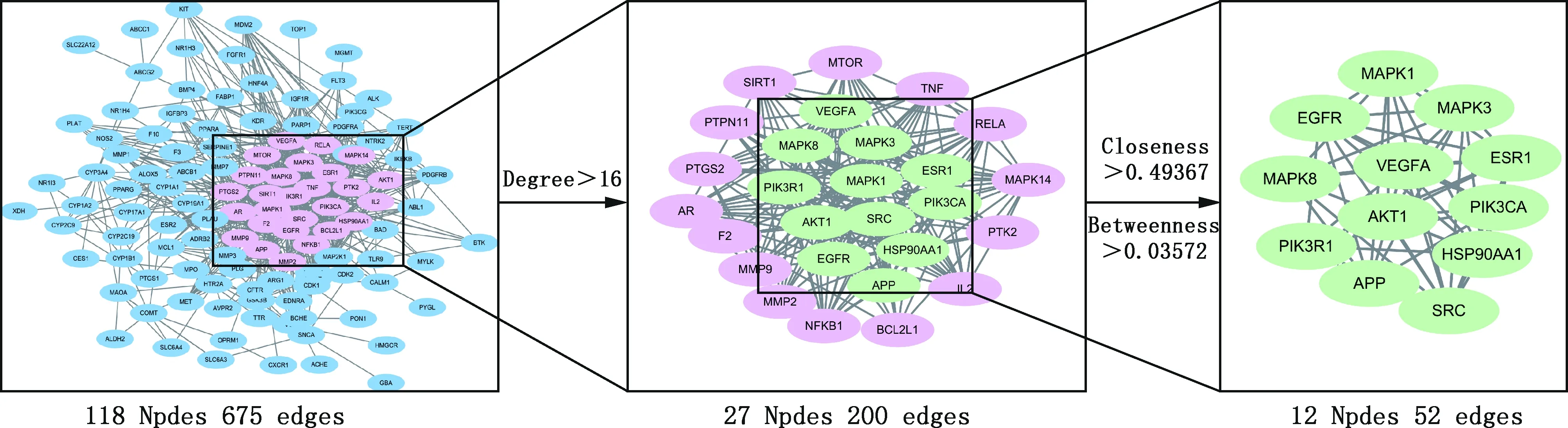
圖2 核心靶點篩選Fig.2 Core target screening
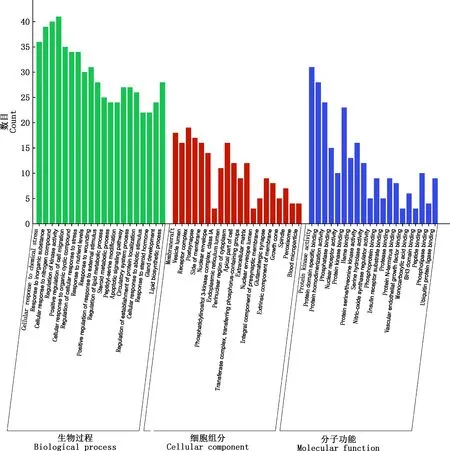
圖3 GO功能分析柱狀圖Fig.3 Chart histogram of GO function analysis
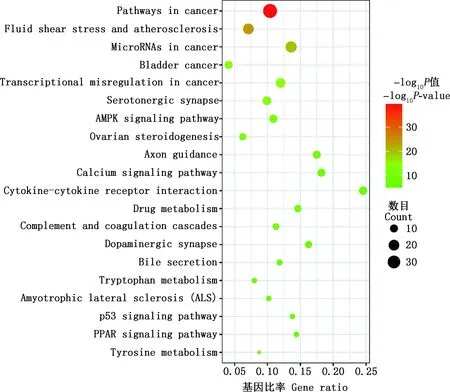
圖4 KEGG通路富集分析氣泡圖Fig.4 Bubble diagram of KEGG pathway analysis
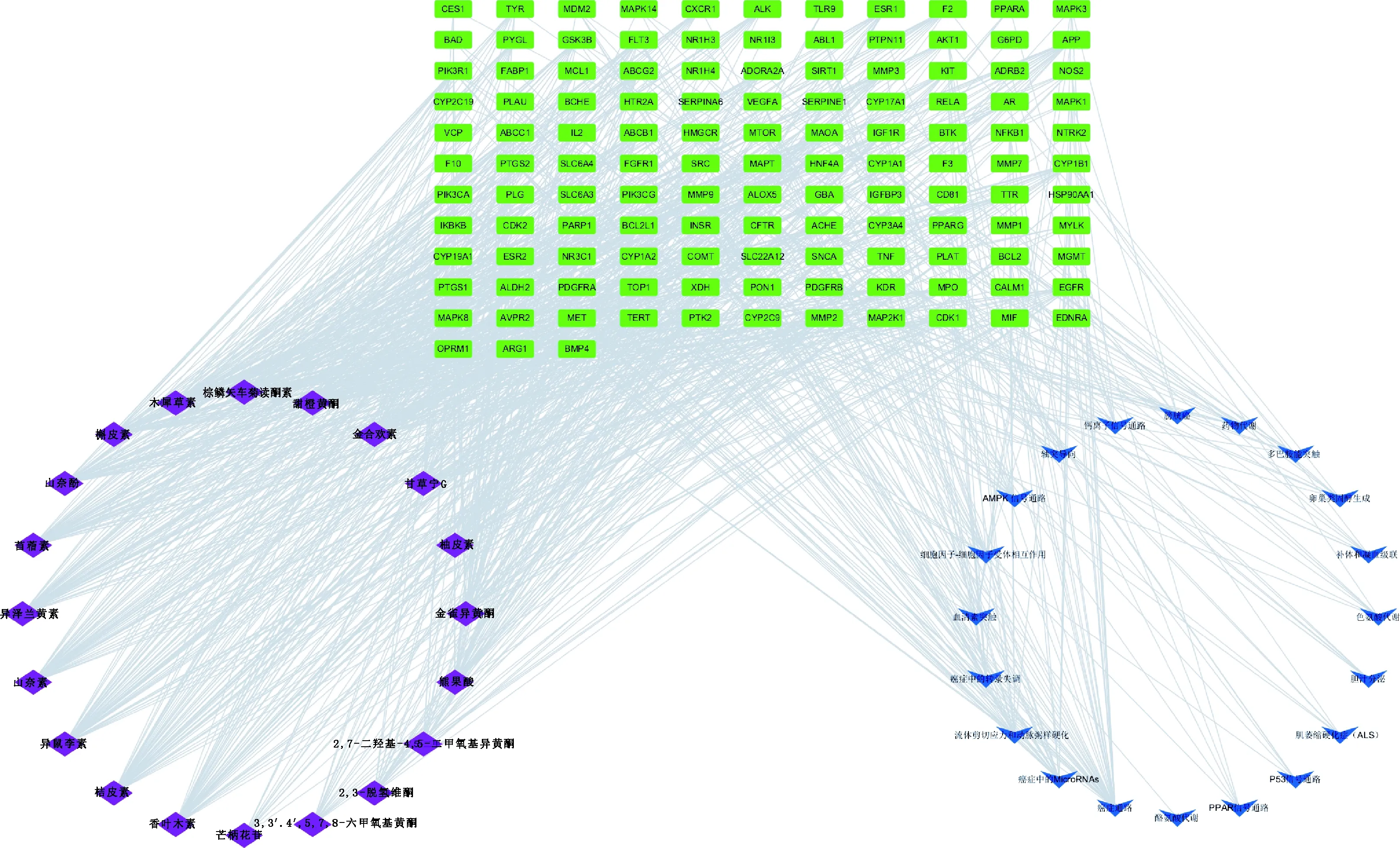
菱形代表成分;長方形代表靶點;箭頭代表通路Diamond represents components;Rectangle represents targets;Arrow represents pathways圖5 成分-靶點-信號通路Fig.5 Component-target-signal pathway network
2.3 FSLE抗EILI的體內驗證
2.3.1 FSLE對小鼠血清ALT和AST水平的影響 由圖6可知,與NC組相比,LD組小鼠血清ALT和AST活性顯著升高(P<0.05),提示EILI造模成功;與LD組相比,HFSLE+LD、MFSLE+LD和LFSLE+LD組小鼠血清AST活性均顯著降低(P<0.05),HFSLE+LD組小鼠血清ALT活性顯著降低(P<0.05),說明FSLE可有效減輕EILI。
2.3.2 FSLE對小鼠肝臟組織病理變化的影響 HE染色結果顯示,NC組的小鼠肝臟組織細胞形態正常,細胞結構完整,細胞間隙致密,肝臟組織以中央靜脈為中心呈放射狀排列、結構完整,無炎性細胞浸潤(圖7A);LD組小鼠肝臟組織肝細胞結構較為紊亂,肝索基本消失,界限不清,肝細胞出現水腫現象,有部分核溶解現象,并伴有少量出血和炎性細胞(圖7C),表明小鼠EILI模型成功建立;與LD組相比,HFSLE+LD組細胞完整,排列整齊,水腫現象減少,肝索清晰,無大量炎性細胞及壞死灶(圖7D);MFSLE+LD組肝細胞形態出現好轉,水腫現象減輕(圖7E);LFSLE+LD組小鼠肝臟組織形態好轉,雖有水腫現象但水腫減輕,無核溶解現象,細胞排列較為緊密(圖7F)。
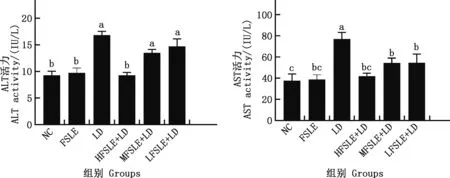
肩標不同字母表示差異顯著(P<0.05);肩標相同字母表示差異不顯著(P>0.05)。下同Values with different letter superscripts mean significant difference (P<0.05);While with the same letter superscripts mean no significant difference (P>0.05).The same as below圖6 FSLE對小鼠血清AST和ALT活性的影響Fig.6 Effect of FSLE on the activity of serum AST and ALT in mice
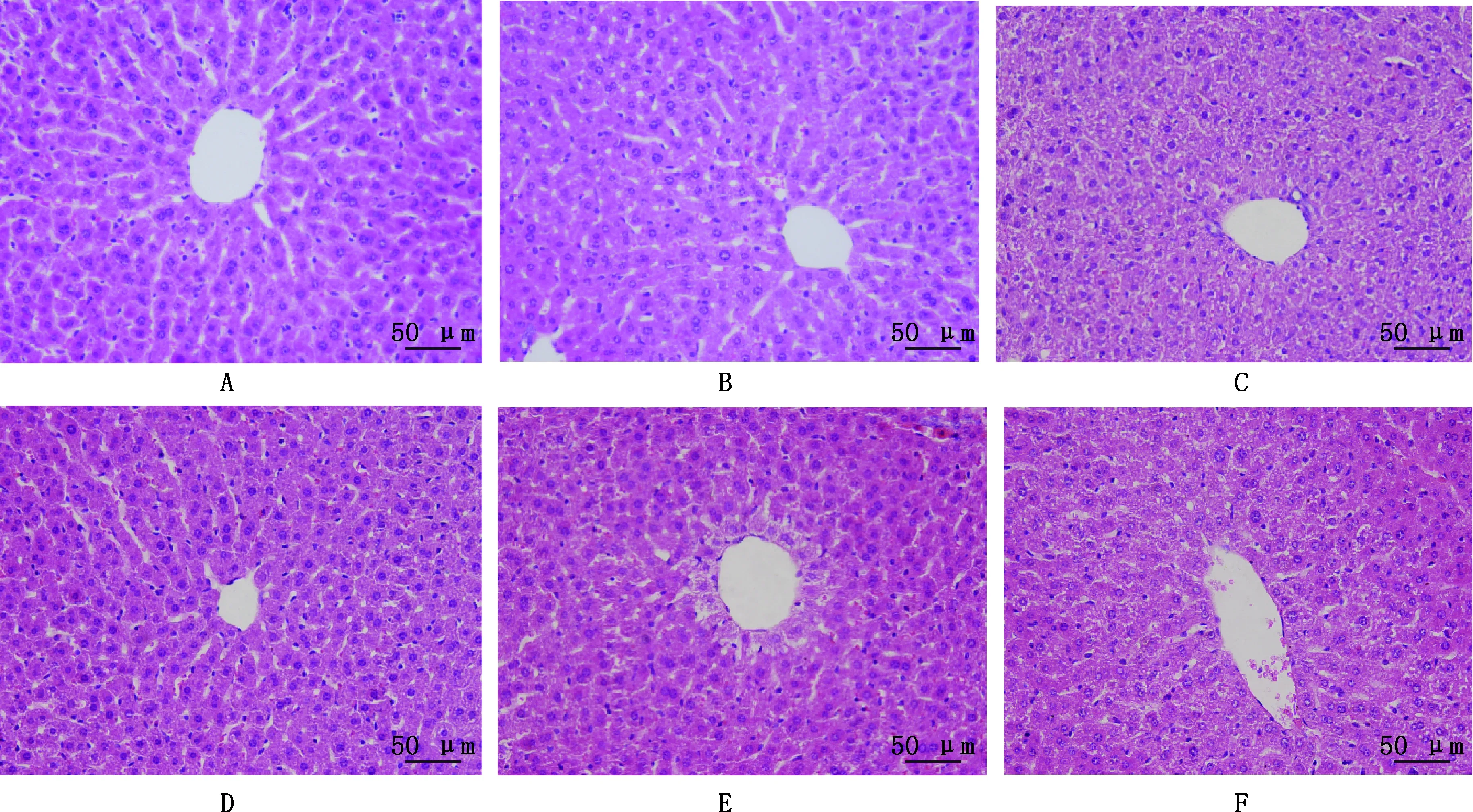
A~F,分別為NC、FSLE、LD、HFSLE+LD、MFSLE+LD和LFSLE+LD組A-F,NC,FSLE,LD,HFSLE+LD,MFSLE+LD and LFSLE+LD groups,respectively圖7 FSLE對小鼠肝臟組織病理學變化的影響(HE,400×)Fig.7 Effect of FSLE on histopathological changes of mouse liver (HE,400×)
2.4 FSLE對小鼠肝損傷關鍵靶點AMPKα1和AMPKα2表達的影響
2.4.1 FSLE對小鼠肝損傷AMPKα1和AMPKα2基因表達的影響 由圖8可知,與NC相比,LD組AMPKα1和AMPKα2基因mRNA表達量均顯著下降(P<0.05);與LD組相比,HFSLE+LD組可顯著上調AMPKα1和AMPKα2基因mRNA表達量(P<0.05)。
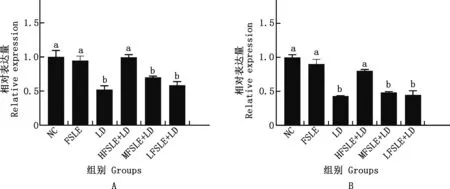
圖8 FSLE對AMPKα1(A)和AMPKα2(B)基因mRNA表達水平的影響Fig.8 Effects of FSLE on AMPKα1 (A) and AMPKα2 (B) genes mRNA expression levels
2.4.2 FSLE對小鼠肝損傷關鍵靶點AMPK蛋白表達的影響 由圖9可知,與NC組相比,LD組小鼠肝臟的AMPK蛋白表達量顯著下降(P<0.05);與LD組相比,HFSLE+LD組可顯著提高AMPK的蛋白表達量(P<0.05)。
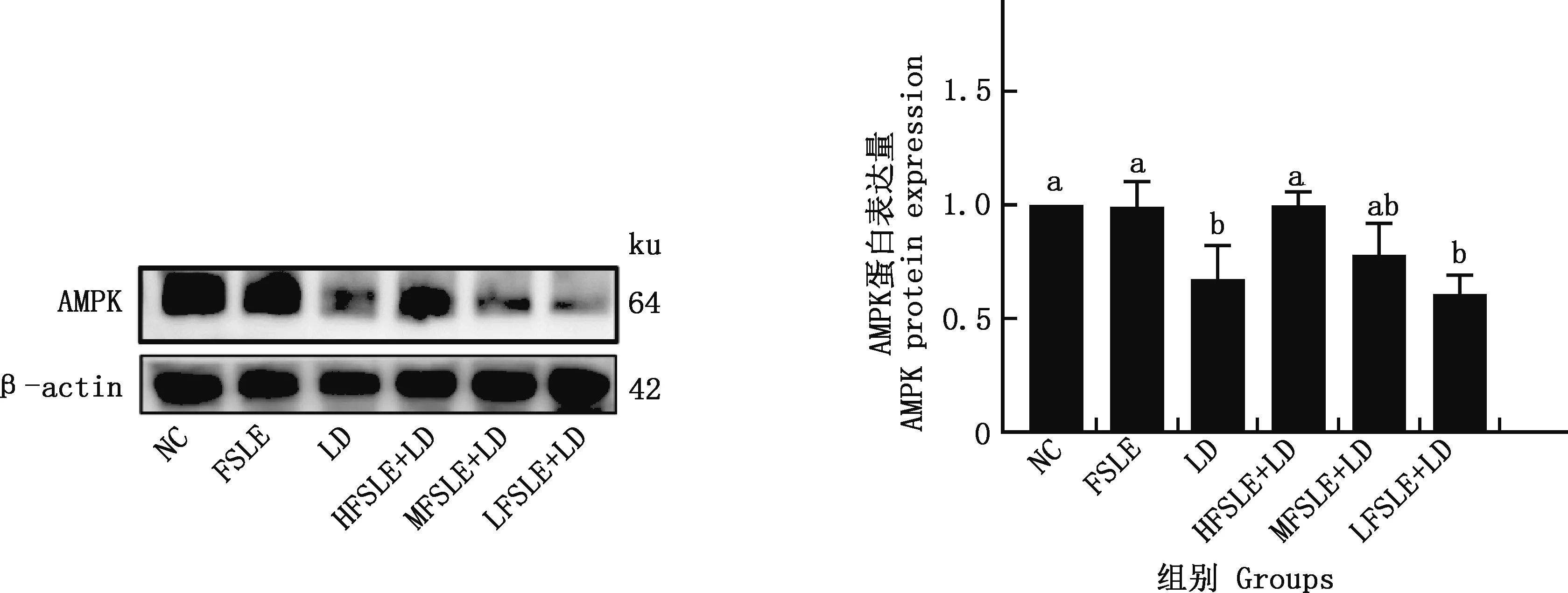
圖9 FSLE對AMPK蛋白表達水平的影響Fig.9 Effects of FSLE on AMPK protein expression levels
2.5 FSLE對小鼠肝臟氧化應激水平的影響
由圖10可知,與NC組相比,LD組小鼠肝臟SOD活性及GSH含量顯著降低(P<0.05),小鼠肝臟MDA及H2O2含量顯著升高(P<0.05);與LD組相比,HFSLE+LD組小鼠肝臟SOD活性及GSH含量顯著上升(P<0.05),HFSLE+LD、MFSLE+LD小鼠肝臟MDA及H2O2含量顯著降低(P<0.05),且HFSLE+LD組基本達到正常水平。表明FSLE對ENR誘導的小鼠肝損傷的保護作用可能與其提高機體抗氧化應激水平有關。
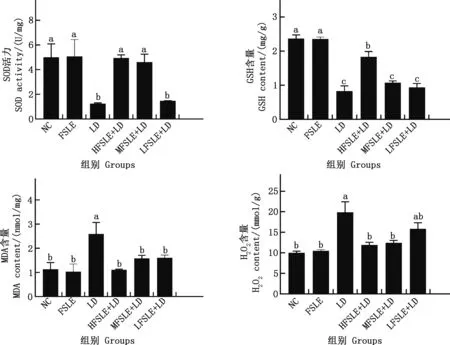
圖10 FSLE對小鼠肝臟氧化應激水平的影響Fig.10 Effect of FSLE on the level of oxidative stress in mouse liver
3 討 論
本研究基于LC-MS分析及網絡藥理學,對FSLE治療EILI進行研究。通過LC-MS分析鑒定出30種黃酮類化合物和1種萜類化合物。研究表明,黃酮類化合物和萜類化合物均有顯著的肝臟保護作用[22-23]。根據胃腸吸收和類藥性,篩選出20種活性較高的成分參與調控EILI,排名靠前的主要包括甜橙黃酮、山奈素和桔皮素。通過網絡藥理學篩選出核心靶點12個,即MAPK1、MAPK3、ESR1、PIK3CA、HSP90AA1、SRC、APP、PIK3R1、MAPK8、EGFR、VEGFA和AKT1。FSLE治療EILI可能是通過這些核心靶點來實現的。通過KEGG通路富集分析并構建“成分-靶點-信號通路”可視化網絡顯示,AMPK信號通路[24]、p53信號通路[25]和PPAR信號通路[26]都與肝損傷密切相關。其中AMPK信號通路具有多種重要的生物學功能,其生物功能主要包括蛋白質合成、核糖體蛋白翻譯、脂肪酸合成、線粒體生物合成氧化代謝、脂肪酸氧化和脂肪酸攝取[27],在酒精性脂肪肝損傷[28]、氧化應激造成的肝損傷[29]及藥物性肝損傷[30]的治療中都發揮著重要作用。
在肝臟中,ALT主要存在于細胞漿內,AST主要存在于肝細胞線粒體中,當肝細胞受到損害時,細胞內的ALT和AST會釋放到血液中,故血清中的ALT和AST水平會增加,因此ALT和AST為評價肝損傷的常用指標[31]。本試驗結果顯示,ENR可顯著提高小鼠血清中ALT和AST的活性,結合病理切片結果,如肝細胞水腫、核溶解、壞死及炎性細胞浸潤等,說明EILI模型成功建立。FSLE可顯著降低小鼠血清中ALT和AST活性,改善肝細胞水腫和壞死等現象,提示FSLE能有效恢復EILI小鼠的肝臟功能指標。劉靜[20]通過腹腔注射CCl4誘導的小鼠急性肝損傷模型中,小鼠血清ALT和AST活力顯著升高,當給予FSLE后,小鼠血清ALT和AST活力顯著降低,這與本試驗結果一致。
AMPK是一種調節能量穩態及代謝應激的能量傳感器,在熱休克、氧化應激和缺血的條件下被激活[32]。研究表明,AMPK在線粒體合成、線粒體氧化應激中發揮重要的作用[33]。AMPK的激活通過上調線粒體抗氧化酶表達[34],加速線粒體更新[35],維持正常線粒體形態[36],導致細胞線粒體活性氧(reactive oxygen species,ROS)生成減少,減輕氧化應激。在本試驗中,FSLE可顯著上調EILI小鼠肝臟AMPK基因和蛋白的表達。這與王春麗[37]發現的菊花提取物通過激活AMPK通路緩解氧化應激、減輕肝損傷的結果基本一致。
肝臟是機體內以代謝和合成功能為主的器官,每個肝細胞中含上千個線粒體,線粒體是產生ROS的主要細胞器[38]。因此,肝臟既易產生ROS,但也易受ROS的攻擊。研究表明,ROS可導致蛋白質修飾、脂質過氧化和核酸損傷。脂質過氧化一旦開始,即會進行鏈式反應,直到生成脂質過氧化產物,如MDA[39]。MDA是一種常用的生物標記物,用于評價生物體內的氧化應激水平,間接反映細胞損傷的程度[40]。SOD是一種重要的抗氧化酶,SOD活力的高低間接反映了機體清除氧自由基的能力[41]。SOD通過歧化反應,將氧自由基轉化為H2O2與O2,故在一定程度上SOD活力的高低可說明機體對抗氧化應激的能力。GSH是細胞內天然的抗氧化酶,對維持細胞的氧化還原平衡十分重要[42]。GSH耗竭后可導致脂質的過氧化,引起肝細胞損傷[43]。在本試驗中與LD組相比,FLSE顯著提高EILI小鼠肝臟中SOD活力和GSH含量,降低H2O2和MDA含量。LFSLE+LD組MDA濃度顯著降低,可能是FSLE對MDA的敏感性較高,這可能與連翹葉清除脂質能力有關[44]。朱淑云[21]通過四氧嘧啶誘導小鼠產生氧化損傷,致使小鼠肝臟中MDA顯著升高,SOD顯著降低,當給予FSLE后,MDA顯著降低,SOD顯著升高,與本試驗結果基本一致。
4 結 論
本研究通過網絡藥理學篩選到FSLE可能主要通過AMPK信號通路發揮抗EILI的作用。動物體內試驗表明,FSLE可顯著降低小鼠血清ALT和AST活力,可能通過上調AMPK基因和蛋白的表達來減輕肝臟的氧化應激,從而發揮抗EILI的作用。

