馬達里亞加病毒TaqMan RT-PCR檢測方法的建立
殷啟凱,劉文婧,王國瑋,張維嘉,付士紅,韓 坤,許崇曉,許松濤,李 樊,劉亞寧,何 英, 王振海, 聶 凱, 王環宇
馬達里亞加病毒(Madariaga virus, MADV)屬于披膜病毒科,甲病毒屬,過去被認為是東方馬腦炎病毒(Eastern equine encephalitis virus, EEEV)的南美洲分支,又稱南美東方馬腦炎病毒[1]。東方馬腦炎病毒最開始分為4個亞型(Ⅰ~Ⅳ),Ⅰ型常見于美洲北部,被稱為North America(NA)型,Ⅱ-Ⅳ型主要分布于美洲南部和中部,被稱為South America(SA)型[2],由于兩者在基因組、生態學和致病機制上具有顯著差異,后直接將SA型單獨定義為MADV[3],2020年ICTV將其分類為一個獨立的病毒。MADV為直徑70 nm左右、表面有纖突的球形包膜病毒,基因組大小約11.7 kb,為單股正鏈RNA病毒[4]。目前認為MADV的傳播媒介主要是庫蚊,而且 MADV感染與寨卡病毒(Zika virus, ZIKV)、登革病毒(Dengue virus, DENV)具有相似的臨床表現,往往造成嚴重的后遺癥[2]。近年來,MADV在巴西[5]、海地[2]、巴拿馬[6]等拉丁美洲國家時常暴發,雖然我國目前尚未發現MADV的感染與傳播,但隨著經濟全球化進程的推進和國家“一帶一路”重大戰略的實施,國外媒介傳播病原體傳入我國的風險日益增高,建立相應的高效快速檢測方法日趨迫切。本研究基于TaqMan RT-PCR技術針對MADV建立了早期、快速檢測方法,為MADV的檢測、監測及相關研究提供實驗室支持。
1 材料與方法
1.1 引物、探針的設計與合成 從GenBank中下載MADV的全部序列,通過Clustal X進行多序列比對分析,使用Primer Express(ABI公司,Ver:3.0)選擇MADV保守性較高的NSP1區段,根據引物設計原則[7]設計特異性引物及TaqMan探針,引物和探針由北京擎科新業生物技術有限公司合成。
1.2 MADV RNA標準品的制備 根據多序列比對分析的結果,選擇將MADV NSP1基因的保守區(134~208 bp,GI:MH359233.1)克隆至pUC57-Amp載體獲得pUC57-MADV質粒(蘇州泓迅生物科技股份有限公司)。以線性化的pUC57-MADV質粒為模板進行RNA體外轉錄(Promega公司,RiboMAXTMLarge Scale RNA Production System-T7),RNA產物通過熒光染料法進行濃度定量(Invitrogen公司,QubitTMRNA BR Assay Kit),根據公式計算拷貝數:單位體積RNA拷貝數(copy/mL)=6.02×1023×RNA濃度(g/mL)/(RNA轉錄產物堿基數×340),獲得RNA標準品-20 ℃保存備用。
1.3 TaqMan RT-PCR檢測體系的建立 建立MADV實時熒光定量檢測方法的反應體積為20 μL,其反應體系包括:4×TaqPathTM1-Step Multiplex Master Mix 5μL,(ABI公司,TaqPathTM1-Step Multiplex Master Mix No ROX),10 μmol/L 的上、下游引物與5 μmol/L 的探針各1 μL,RNA 模板2 μL,無核酸酶水10 μL。配制好的反應體系在CFX96實時熒光定量PCR儀(Bio-Rad公司)進行擴增,采集FAM通道熒光信號進行檢測,根據試劑盒說明書設置擴增反應條件為:25 ℃ 2 min;53 ℃ 10 min;95 ℃ 2 min,95 ℃ 3 s,60 ℃ 30 s,共40個循環。
1.4 特異性評估 用披膜病毒科甲病毒屬蓋塔病毒、辛德畢斯病毒,黃病毒科黃病毒屬西尼羅病毒、乙型腦炎病毒、寨卡病毒、登革病毒、黃熱病毒,布尼亞病毒目Tahyna病毒,呼腸孤病毒科東南亞十二節段RNA病毒屬Kadipiro病毒等4科9種蟲媒病毒(病毒毒株均來源于本實驗室保存)的RNA與MADV的RNA標準品按照建立的檢測體系同時進行反應,評估該方法的特異性。
1.5 靈敏度評估 將MADV 的RNA標準品進行10倍梯度稀釋,選擇8個不同濃度(101~108拷貝/反應)的RNA作為模板進行反應確定該檢測方法的靈敏度。使用CFX Manager(Bio-Rad 公司,Ver:3.0)軟件,根據各樣品的RNA拷貝數(X軸)和實時熒光定量PCR反應Ct值(Y軸)進行計算分析,繪制靈敏度標準曲線。
1.6 重復性評估 以8個不同濃度(101~108拷貝/反應)的RNA樣品為模板,每個濃度進行3次平行重復實驗,計算每個稀釋度的標準差(S)與變異系數(CV),以評價該檢測體系的穩定性。
1.7 不明原因發熱病例及蚊蟲樣本篩查 用建立的TaqMan RT-PCR 檢測體系和反應條件篩查2019-2020年寧夏回族自治區、浙江省和云南省的共計81份不明原因腦炎病例急性期血清標本及161批庫蚊標本(血清和蚊蟲標本均由各省疾控中心經干冰運輸至本實驗室),用MADV RNA標準品作為陽性對照,DENV和ZIKV的RNA作為陰性對照,無核酸酶水作為空白對照。
2 結 果
2.1 MADV引物、探針和RNA標準品 GenBank中共有41條MADV序列,根據32條全基因組序列比對分析結果,設計合成MADV NSP1基因特異性引物與探針,其擴增片段長度為75 bp(表1)。經公式換算,RNA標準品的濃度為 1.65×1014copy/mL。

表1 TaqMan RT-PCR檢測MADV的引物與探針序列信息Tab.1 Information on primer and probe sequences for TaqMan RT-PCR for MADV detection
2.2 檢測體系特異性 利用建立的TaqMan RT-PCR方法將4科9種蟲媒病毒的RNA與MADV的RNA同時進行反應,僅MADV的RNA得到成功擴增,其它毒株RNA均無擴增(圖1)。

注:1.MADV,2.蓋塔病毒,3.辛德畢斯病毒,4. 西尼羅病毒,5. 乙型腦炎病毒,6. 寨卡病毒,7. 登革病毒,8. 黃熱病毒,9. Tahyna病毒,10. Kadipiro病毒,11.空白對照。圖1 MADV檢測體系特異性驗證結果Fig.1 Evaluation of the specificity of the TaqMan RT-PCR assay for MADV
2.3 檢測體系靈敏度和標準曲線 將8個不同濃度(101~108拷貝/反應)的MADV RNA利用所建方法同時進行檢測,最低檢測限為1.0×102拷貝/反應,實驗數據經CFX Manager軟件分析,獲得標準曲線方程為Y=-3.925 4X+41.208,R2=0.999 5(圖2)。
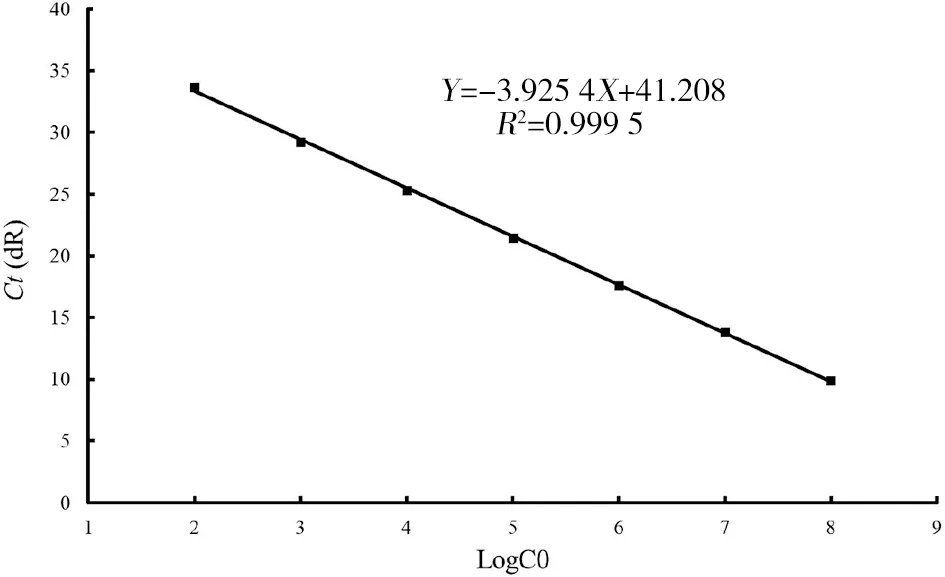
圖2 MADV病毒基因拷貝數定量分析標準曲線Fig.2 Standard curve of the MADV TaqMan RT-PCR assay based on the genomic copy number
2.4 檢測體系穩定性 8個不同濃度(101~108拷貝/反應)的MADV RNA各進行3次平行重復實驗,各稀釋度的Ct值的標準差S均<0.5,變異系數CV值均<1.5%(表2)。
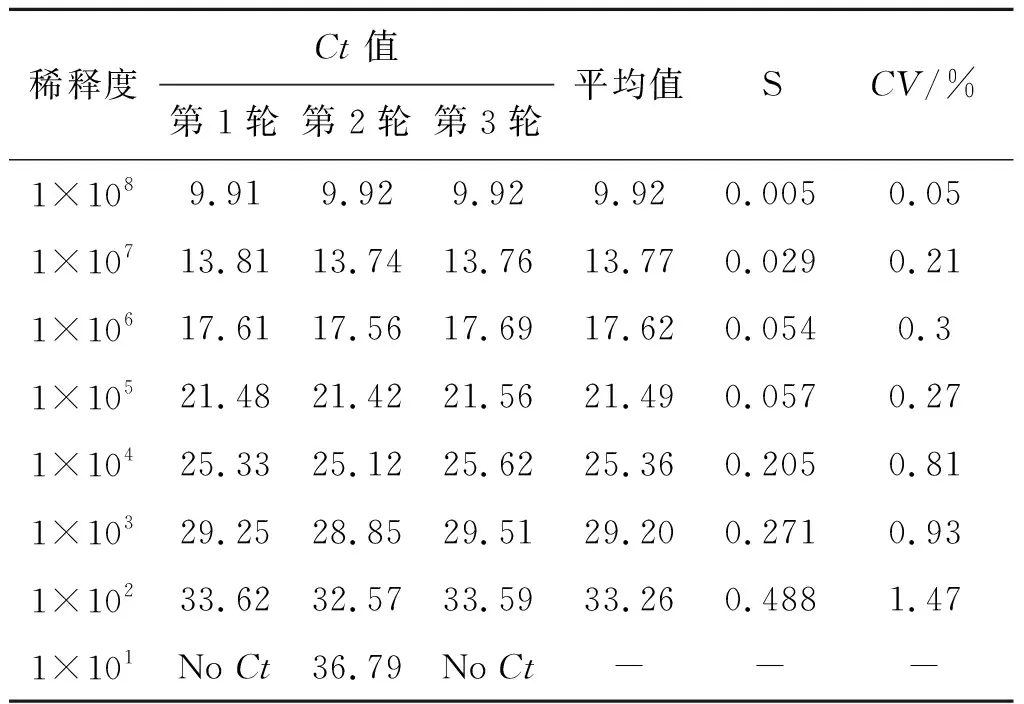
表2 MADV檢測體系重復穩定性實驗數據Tab.2 Stability testing of real-time PCR for MADV detection
2.5 不明原因發熱病例血清及蚊蟲樣本篩查 將2019-2020年寧夏回族自治區、浙江省和云南省的共計81份不明原因腦炎病例急性期血清標本(乙腦病毒IgM抗體檢測為陰性)及161批庫蚊標本提取RNA 后,利用建立的MADV TaqMan RT-PCR檢測體系和反應條件檢測,檢測結果均為陰性。
3 討 論
本研究建立的MADV TaqMan RT-PCR檢測方法,選用基因序列中較為保守的區域作為擴增目標片段,最低檢測限達到1.0×102拷貝/反應,變異系數(CV)均<1.5%,表明該檢測體系具有良好的敏感性和穩定性,用MADV的RNA與多種蟲媒病毒同時平行檢測無交叉反應,證明該檢測方法具有較高的特異性。用本研究所建立的方法篩查2019-2020年夏季在寧夏、浙江和云南3省的81份不明原因腦炎病例的急性期血清標本及161批庫蚊標本,結果均為陰性,表明我國以上3個省近兩年的蚊蟲標本和不明原因急性腦炎急性期血清標本目前尚無MADV檢出。
MADV作為在拉丁美洲流行的病原體,通過貝葉斯法構建系統進化樹發現MADV最早可追溯到346年前,而且該病毒很可能起源于巴西[8],主要能引起馬腦炎,2019年在巴西東北部Ceará州報道了由MADV引起的馬腦炎暴發[5],馬在感染MADV后會出現發熱、極度虛弱、步伐不穩、肌肉抽搐等癥狀,甚至死亡[9]。此前,在美洲中部和南部從未發現人類感染MADV[10],但2010年在巴拿馬首次確診了13位病人是MADV陽性,而且報道的病人主要是兒童,表明MADV具有致病性[6]。另外2016年,委內瑞拉在進行ZIKV篩查時發現一位12歲的小女孩癥狀與ZIKV感染十分吻合,但檢測結果為ZIKV陰性,平行檢測基孔肯雅病毒(Chikungunya virus,CHIKV)和DENV等結果均為陰性,最后經病毒基因序列測定后鑒定為MADV感染[11]。人感染MADV后的主要癥狀表現與其它蟲媒病毒感染類似,與登革熱表征尤其相似[9],患者會出現突然發熱,體溫可達(39~40 ℃),還會出現頭暈、惡心、乏力等癥狀,嚴重時會產生輕度偏癱,后遺癥嚴重,人群隱性感染率在2%~5%[12]。目前認為MADV的傳播媒介主要是庫蚊[13],拉丁美洲的偏遠地區的鼠和蝙蝠可能作為貯存宿主,但目前對于其傳播的模式仍不清楚。綜上所述,MADV能夠引起人類疾病,而且臨床癥狀與其它蟲媒病毒難以區分,此外,根據委內瑞拉[10]、海地[2]和巴西[14]等地對人類急性發熱病例中檢測MADV的報道,MADV近年來在拉丁美洲流行不斷,因此,建立快速、靈敏且特異的檢測方法十分必要。
TaqMan RT-PCR技術是當今應用最為廣泛的分子診斷方法之一,具有更高的敏感性、特異性和可重復性[15],雖然我國尚未發現MADV感染的病例,但隨著近年來國際交流日益密切,病原體的跨國傳播風險日益升高。由于缺乏特異性試劑盒,MADV的血清學檢測方法應用較少。目前發表的RT-PCR[10]、巢式RT-PCR[13,16]等分子生物學檢測方法均需結合一代測序才能完成鑒定。相關方法總實驗步驟多、檢測用時較長,而本研究建立的MADV實時熒光定量PCR檢測方法上機反應時間小于1.5 h,縮短檢測用時,提升實驗室檢測時效性。本方法不僅可應用于實驗室的早期檢測,還將為今后開展MADV監測及研究工作提供良好的技術支持。
利益沖突:無
引用本文格式:殷啟凱,劉文婧,王國瑋,等. 馬達里亞加病毒TaqMan RT-PCR檢測方法的建立[J].中國人獸共患病學報,2022,38(5):428-432. DOI:10.3969/j.issn.1002-2694.2022.00.057

