星形細胞瘤FLI-1蛋白表達及其與病人預后的關系
孫衍昶 劉達遠 許鵬翔 歐陽一彬 莫業和
星形細胞瘤占顱內腫瘤的13%~26%,多呈浸潤性生長,預后較差[1]。研究表明星形細胞瘤的發生、發展與多種因素有關,是多基因與蛋白異常表達共同作用的結果[2]。文獻報道Friend 白血病整合素1轉錄因子(Friend leukemia integration 1 transcription factor,FLI-1)對肝惡性血管源性腫瘤具有一定診斷價值[3]。Ahmed等[4]指出FLI-1在尤文肉瘤/外周原始神經外胚層腫瘤中表達異常,尤其與分化簇99聯合應用,對這類腫瘤的診斷陽性率更高。本文探討星形細胞瘤FLI-1的表達變化及其臨床意義。
1 資料與方法
1.1 研究對象 選取2015 年6 月~2018 年6 月手術切除并經術后病理檢查確診的星形細胞瘤標本112例,其中男68 例,女44 例;年齡26~58 歲,平均(46.23±10.07)歲。納入標準:經病理證實為星形細胞瘤,成年病人,術前無放療、化療等輔助治療。另選59 例顱腦損傷內減壓術獲得非腫瘤腦組織為對照,其中男36 例,女23 例;年齡21~60 歲,平均(47.19±11.54)歲。本研究獲醫院倫理委員會批準。
1.2 檢測方法 采用免疫組化法檢測星形細胞瘤、非腫瘤腦組織FLI-1 蛋白表達情況,同時檢測星形細胞瘤組織異檸檬酸脫氫酶1(isocitrate dehydrogenase1,IDH1)、p53蛋白表達情況。常規石蠟切片(厚4 μm)、烤片,經二甲苯脫蠟,行梯度酒精水化,PBS清洗3×3 min。微波抗原修復15 min,蒸餾水洗滌5 min。加入3%牛血清蛋白、10%羊血清混合液,37 ℃靜置40 min。加一抗4 ℃孵育過夜,PBS 清洗3×5 min。加二抗室溫反應30 min,PBS 清洗3×5min。DAB顯色后顯微鏡下觀察。隨機選取5個高倍視野(×400)觀察染色情況,胞漿與胞膜呈淡黃、棕黃、棕褐染色為陽性(圖1)[5]。IDH1 陽性率超過5%為IDH1突變[6]。
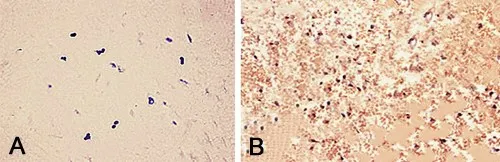
圖1 FLI-1蛋白表達的免疫組化染色(SP法,×400)
1.3 隨訪方法 術后1 d為隨訪起始時間,以2021年6月30 日為隨訪截止期,記錄無進展生存、總生存情況,其中無進展生存為預后良好,腫瘤進展或病人死亡為預后不良。
1.4 統計學方法 應用SPSS 20.0軟件分析,計量資料以±s表示,行t檢驗;計數資料行χ2檢驗;利用多因素logistic回歸模型分析星形細胞瘤生存預后的危險因素;采用Spearman 相關系數分析FLI-1 蛋白與IDH1、p53 蛋白表達的相關性;繪制Kaplan-Meier 生存曲線分析FLI-1 蛋白表達與病人生存預后的關系;P<0.05為差異有統計學意義。
2 結果
2.1 星形細胞瘤FLI-1的表達變化 星形細胞瘤FLI-1 表達陽性率[66.96%(75/112)]明顯高于對照組[16.95%(10/59);P<0.05]。
2.2 星形細胞瘤FLI-1表達與IDH1、p53表達的相關性 FLI-1 表達與IDH1 表達呈明顯負相關(r=-0.682,P<0.001),與p53表達呈正明顯相關(r=0.711,P<0.001)。
2.3 星形細胞瘤的預后情況及影響因素112 例中,預后良好62 例,預后不良50 例。單因素分析顯示,腫瘤病理分級、腫瘤大小、p53 表達、FLI-1 表達、腫瘤切除程度、IDH1 突變、術后放/化療與病人預后有關(P<0.05,表1)。多因素logistic 回歸分析顯示WHO 分級Ⅲ~Ⅳ級、腫瘤直徑≥3 cm、p53表達陽性、FLI-1表達陽性、腫瘤未全切除是星形細胞瘤預后不良的獨立危險因素(P<0.05,表2),IDH1 突變、術后放/化療是預后良好保護因素(P<0.05,表2)。
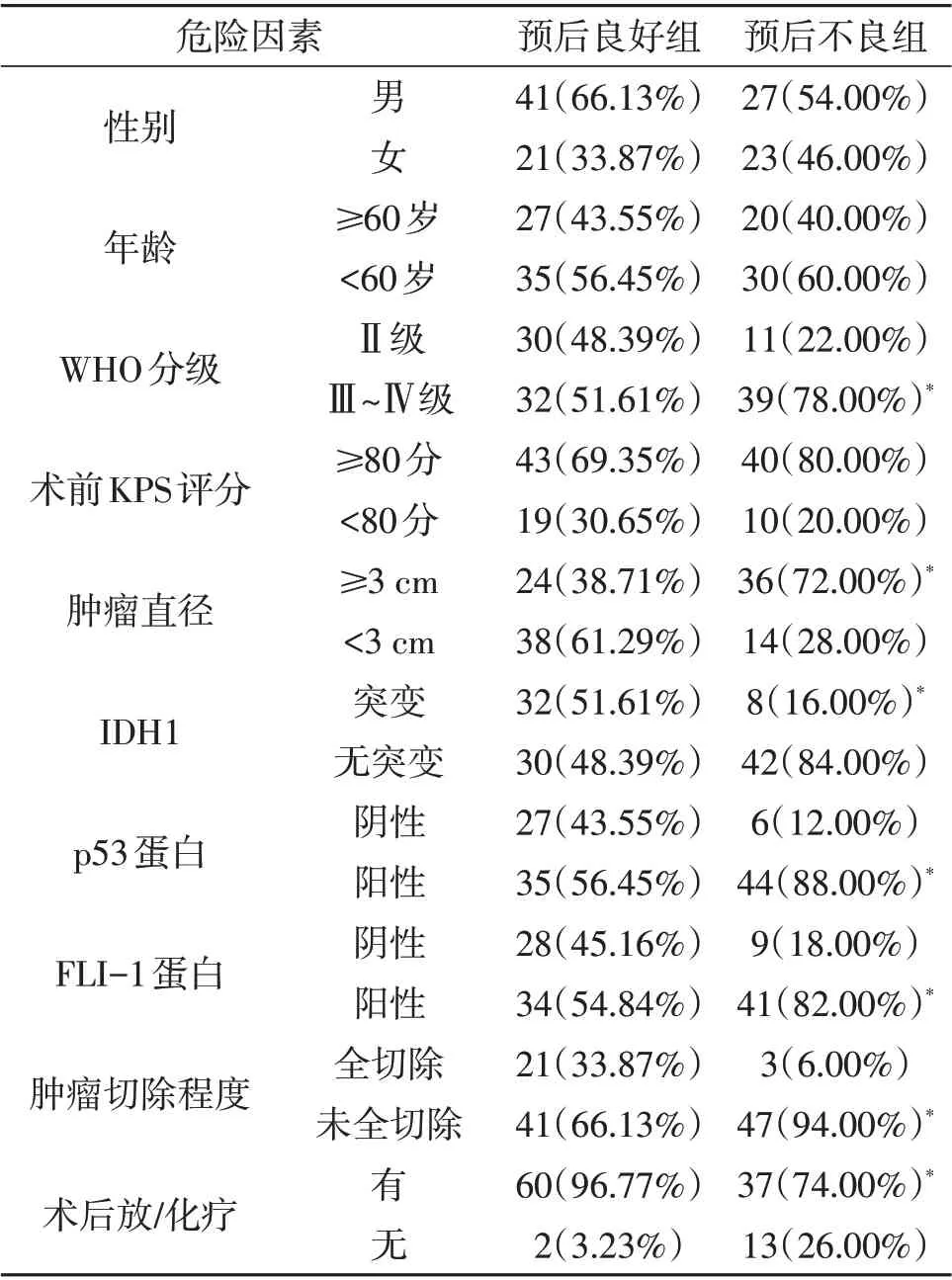
表1 本文星形細胞瘤預后影響因素的單因素分析(例)
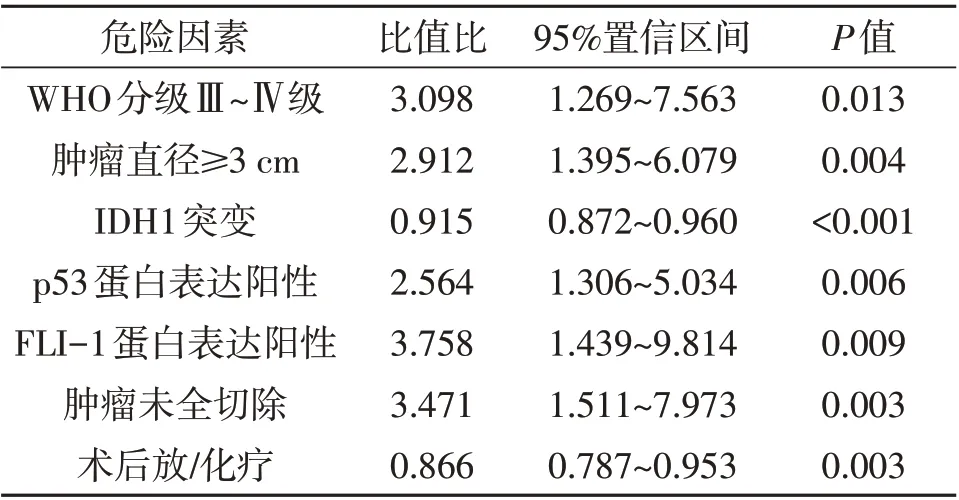
表2 本文星形細胞瘤預后影響因素的多因素logistic 回歸分析
2.4 FLI-1 表達與星形細胞瘤無進展生存率的關系生存曲線分析顯示,FLI-1表達陰性病人3年累積無進展生存率(75.68%)、3 年累積總生存率(81.08%)均明顯高于FLI-1表達陽性的病人(分別為45.33%、49.33%;圖2)。
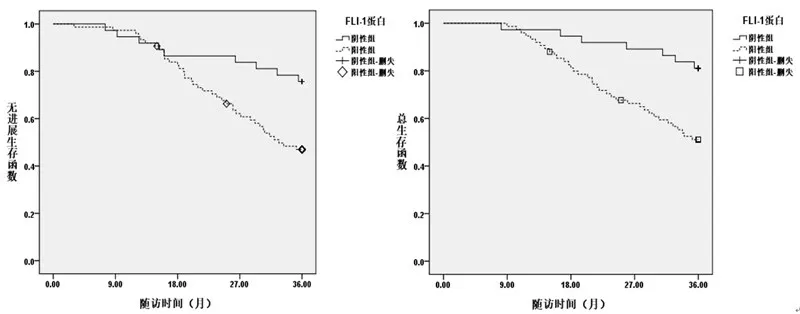
圖2 生存曲線分析FLI-1蛋白表達與星形細胞瘤生存預后的關系
3 討論
星形細胞瘤惡性程度高,預后非常差[1]。如何提升星形細胞瘤的診療效果,并優化治療方案,改善病人預后仍是臨床研究的重點課題。靶向治療是一種有潛力的治療方法,但目前仍缺乏理想的治療靶標。研究表明FLI-1 蛋白表達與血管生成密切相關,FLI-1缺失可導致血管生成活性受到抑制[7]。而新生血管生成在腫瘤進展過程中有重要作用,并且能夠促進腫瘤的浸潤以及轉移[8]。楊勇等[9]發現FLI-1 蛋白表達參與血管球瘤的進展。本文結果發現星形細胞瘤FLI-1 蛋白表達陽性率明顯增高。FLI-1 蛋白是Ets 轉錄因子家族的重要成員,在正常情況下,主要表達于血管內皮細胞、造血干細胞,對祖細胞與造血干細胞的分化及增殖有調節作用。當FLI-1蛋白呈過表達時,可促進實體腫瘤發病以及進展[10]。FLI-1在多種腫瘤中有促腫瘤作用,且調控機制較復雜。Yan等[11]發現FLI-1能促進乳腺癌進展,對不良預后有預測作用,沉默FLI-1 表達能抑制腫瘤細胞增殖。FLI-1在小細胞肺癌組織中表達上調,可通過激活miR-17-92 通路,促進腫瘤進展,敲除FLI-1 基因表達,能促使腫瘤細胞凋亡、抑制腫瘤細胞增殖[12]。
本文發現FLI-1蛋白陽性表達是星形細胞瘤預后不良的獨立危險因素。FLI-1 蛋白的促腫瘤進展的作用機制可能與其激活血管生成因子有關,從而促進新生血管生成,為腫瘤細胞的增殖與分化提供營養供給,導致病情惡化[13]。本文結果顯示星形細胞瘤FLI-1 表達與IDH1 表達呈負性相關,而與p53表達呈正相關。IDH1 突變能減弱腫瘤細胞線粒體葡萄糖氧化能力,對谷氨酰胺酶進行抑制,并阻止其轉化成谷氨酰酸酯,延緩腫瘤進展[14]。p53蛋白能削弱p53基因的抑癌作用,促進腫瘤細胞凋亡,促進病情進展[15]。本研究顯示FLI-1 蛋白陽性表達星形細胞瘤無進展生存率、總生存率明顯下降。這可能與FLI-1 蛋白的促腫瘤作用有關。FLI-1 能促進腫瘤細胞增殖,能提升腫瘤細胞的侵襲與轉移能力,促進腫瘤進展,增加腫瘤進展與死亡風險[16]。
綜上所述,星形細胞瘤組織FLI-1 蛋白呈陽性表達,是病人預后不良的獨立危險因素。

