結腸癌根治術中洛鉑腹腔灌洗化療預防術后復發的臨床研究
李若凡,高旭,孫立新
(首都醫科大學附屬北京潞河醫院普外科,北京 101149)
結腸癌是常見的消化系統惡性腫瘤之一,流行病學數據顯示,結腸癌發病率居第三位,嚴重威脅患者生命安全[1]。根治術是當前治療結腸癌的有效手段,隨著癌癥診斷及治療技術的發展,臨床可有效控制結腸癌病死率,但術后腫瘤會向肝臟、腹膜、肺部轉移,以及治療后腫瘤的復發問題,均是威脅患者生命安全的重要因素[2-3]。因此,采用科學、有效的方式對結腸癌患者進行干預,并預防術后復發是臨床研究重點。隨著醫療技術的發展,手術加化療的方式可在一定程度上對癌癥的轉移及復發進行預防,但靜脈全身化療副作用較大,在治療的同時,還會對機體其他臟器組織產生傷害,部分患者難以熬過化療周期,導致治療失敗[4]。采用腹腔化療治療可降低化療對機體的損傷,還可最大化清除殘余腫瘤細胞,改善患者生存質量[5]。洛鉑為第三代抑制腫瘤進展新藥,在化療中可有效發揮抑制胃腫瘤細胞的轉移、復發,且具有較低的毒副作用,但較少研究分析根治術聯合洛鉑治療結腸癌患者的臨床療效[6]。本研究擬探討根治術與洛鉑腹腔灌洗聯合治療結腸癌的效果。
1 資料與方法
1.1 一般資料
選取2019年1月至2020年1月在首都醫科大學附屬北京潞河醫院進行根治術治療的96例結腸癌患者為研究對象,根據不同化療方案分為觀察組及對照組,每組各48例。納入標準:(1)均符合結腸癌診斷標準[7],并經病理確診;(2)均經影像學檢查發現侵犯深度在T2及以上者。排除標準:(1)存在遠處轉移者;(2)合并其他惡性腫瘤者;(3)合并嚴重免疫功能障礙者。兩組一般資料比較,差異無統計學意義(P>0.05)。見表1。

表1 兩組一般資料比較
1.2 方法
兩組均給予根治術治療,受試者在關閉腹腔前采用1 000 mL溫熱蒸餾水將腹腔浸泡5 min后吸盡,留置腹腔引流管。觀察組關腹后將60 mg洛鉑+500 mL葡萄糖注射液(5%),并經引流管注射入腹腔中,夾閉腹腔,在術后6 h后打開。對照組行常規關腹腔操作。兩組均在恢復排氣后進食,并給予常規化療方案,CapeOX化療藥物為:第1天,靜脈注射130 mg/m2(體表面積)奧沙利鉑(艾恒,江蘇恒瑞醫藥),口服1 000 mg/m2(體表面積)卡培他濱片(江蘇恒瑞醫藥),2次/d,早晚口服,治療兩周后休息1周,即為1個完整的化療周期。術后兩組均化療兩個療程后評估效果。
1.3 觀察指標
(1)觀察并比較兩組胃腸功能恢復情況,包括腸道排氣時間、排便時間、拔管時間、術后住院時間、術后引流量。(2)在患者術前1 d、術后1 d及化療1周后抽取患者清晨空腹血,離心后采用酶聯免疫吸附測定(ELISA)法檢測炎癥因子水平,包括腫瘤壞死因子(TNF-α)、白細胞介素-6(IL-6)。(3)在患者術前、術后及化療后抽取患者清晨空腹血,離心后采用AU5800全自動生化分析儀檢測患者肝功能,包括谷草轉氨酶(AST)、總膽紅素(TBIL)、谷丙轉氨酶(ALT)。(4)在患者術前1 d、術后1 d及化療1周后抽取患者清晨空腹血,離心后采用ELISA法檢測腎功能指標,包括尿素氮(BUN)、血清肌酐(SCr)。(5)在患者術前1 d、術后1 d及化療1周后抽取患者清晨空腹血,離心后采用ELISA法檢測骨髓抑制指標變化情況,包括白細胞計數(WBC)、血紅蛋白、血小板計數。(6)記錄兩組術后并發癥發生率,包括吻合口漏、切口裂開者,兩組腹腔膿腫、腹腔出血、肺部感染、切口感染、下肢深靜脈血栓、黏連性腸梗阻。(7)采用電話、微信、復查等方式對患者進行為期兩年的隨訪,以患者死亡或隨訪時間結束為事件重點,記錄兩組術后6個月、術后1年、術后兩年復發率、術后兩年生存率及遠處轉移率。
1.4 統計學分析
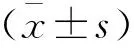
2 結果
2.1 兩組術后腸道功能恢復情況比較
兩組腸道排氣、排便、拔管、術后住院時間比較,差異無統計學意義(P>0.05);觀察組術后1 d引流量高于對照組,差異具有統計學意義(P<0.05)。見表2。
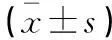
表2 兩組術后腸道功能恢復情況比較
2.2 兩組手術前后炎癥因子指標比較
術后1 d,兩組TNF-α、IL-6均升高,但在化療后又降低(P<0.05),但兩組在術前1 d、術后1 d及化療1周后同時間點以上指標比較,差異無統計學意義(P>0.05)。見表3。

表3 兩組炎癥因子指標比較
2.3 兩組手術前后肝功能指標比較
術前1 d、術后1 d、化療1周后,兩組AST、TBIL、ALT指標及SCr、BUN指標均無顯著變化(P>0.05),且組間同時間點各指標比較,差異均無統計學意義(P>0.05)。
2.4 兩組手術前后骨髓抑制情況比較
兩組WBC、血紅蛋白、血小板計數在術后及化療后均有所降低(P<0.05),術后1 d兩組以上指標比較,差異無統計學意義(P>0.05),化療1周后觀察組以上指標均低于對照組(P<0.05)。見表4。
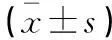
表4 兩組手術前后骨髓抑制情況比較
2.5 兩組術后并發癥比較
兩組均未出現吻合口漏、切口裂開者,兩組腹腔膿腫、腹腔出血、肺部感染、切口感染、下肢深靜脈血栓發生率比較,差異均無統計學意義(P>0.05),但觀察組黏連性腸梗阻發生率高于對照組(P<0.05)。見表5。

表5 兩組術后并發癥比較[n(%)]
2.6 兩組術后復發、兩年生存及遠處轉移比較
術后6個月,兩組復發率比較,差異無統計學意義(P>0.05)。術后1年、術后兩年,觀察組復發率均低于對照組,兩年生存率高于對照組(P<0.05),但兩組遠處轉移率比較,差異無統計學意義(P>0.05)。見表6。

表6 兩組術后復發、兩年生存及遠處轉移比較[n(%)]
3 討論
當前結腸癌根治術腫瘤清除率為50%~60%,且隨著腫瘤侵犯程度加重,手術清除率逐漸降低,單純采用手術切除,術后5年生存率不足50%,因此加強對結腸癌患者術后復發的治療是臨床亟待解決的問題[8]。
腹腔化療是一種新式化療手段,具備流體動力學及藥代動力學的優勢,可選擇性進行局部化療,是清除腹腔中微小病灶及游離癌細胞的最佳方案,當前用于胃腸的化療藥物主要為鉑類[4,9]。順鉑作為第一代鉑類藥物,在臨床治療中存在一定的胃腸道反應及肝腎毒性,臨床應用受限;卡鉑作為第二代鉑類藥物,可明顯減輕第一代藥物在治療中的胃腸道反應及肝腎毒性,但存在一定骨髓抑制反應,與順鉑有交叉耐受性[10];第三代鉑類藥物洛鉑,穩定性較佳,抗癌譜廣,臨床實踐價值較高。洛鉑抗癌機制主要是通過對癌細胞的DNA復制、轉錄進行干擾,誘導其凋亡,發揮抗癌作用[11]。本研究在術中應用洛鉑對結腸癌患者進行腹腔灌洗,發現與常規化療在腸道排氣時間、排便時間、拔管時間、術后住院時間方面比較無顯著差異,但增加了術后引流量,可能與觀察組增加了500 mL葡萄糖注射液(含洛鉑)有關,但兩組在拔管時間上無顯著差異,提示引流量的增加不會對患者術后恢復造成影響。手術為有創操作,在行結腸癌根治術后患者局部組織、器官均受創,因此炎癥因子水平會出現升高趨勢。但本研究發現術后1 d兩組WBC、TNF-α、IL-6均升高,而在化療1周后又降低,提示洛鉑應用在結腸癌根治術中,可有效減輕患者術后炎癥反應。本研究發現,兩組在術前1 d、術后1 d、化療1周的AST、TBIL、ALT、SCr、BUN指標均無顯著變化,且組間同時間點以上指標比較無顯著差異,提示在結腸癌根治術中應用洛鉑化療,不會影響患者肝腎功能,較為安全。可能是因為:在腹腔化療中,藥物僅在局部進行作用,而不會穿透腹膜-血漿屏障,殺傷作用較佳,對機體全身毒副作用相對較小[12]。在治療中,藥物可經肝臟門靜脈吸收,殺傷轉移至肝臟的癌細胞,發揮保護作用[13],洛鉑化療治療,或許有一定的肝臟保護作用,降低腫瘤細胞向肝臟轉移率。本研究中,兩組WBC、血紅蛋白、血小板計數在術后及化療后均有所降低,兩組術后以上指標比較無顯著差異,化療后觀察組以上指標明顯低于對照組,提示結腸癌根治術患者采用洛鉑化療會出現骨髓抑制反應,且經對癥治療后均有所緩解。本研究中兩組均未出現吻合口漏、切口裂開者,兩組腹腔膿腫、腹腔出血、肺部感染、切口感染、下肢深靜脈血栓發生率比較無顯著差異,但觀察組黏連性腸梗阻發生率略高于對照組,提示洛鉑的使用可能會增加黏連性腸梗阻發生率,這可歸因于小劑量的洛鉑在一定程度上影響胃腸道蠕動,在保守治療后好轉[14]。本研究指出,兩組6個月術后復發率比較無顯著差異,觀察組術后1年、術后兩年復發率均低于對照組,兩年生存率高于對照組,但兩組遠處轉移率比較無顯著差異,提示洛鉑在結腸癌根治術患者臨床治療中,有效降低術后1年及術后兩年復發率,提高生存質量,可為臨床治療提供有效化療手段。究其原因可能是洛鉑腹腔化療可確保局部藥物濃度較高,可輔助清除手術殘留病灶及游離癌細胞,提高生存質量[15]。
綜上,洛鉑在結腸癌患者根治術中應用較佳,可顯著降低術后1年及術后兩年復發率,提高生存質量,且無肝腎毒性,但因本研究例數較少,至于是否可在臨床推廣仍需進行大量臨床研究進行驗證。

