立體定向腦電圖在磁共振成像陰性中央區藥物難治性癲癇中的應用價值
王玉根,張光明,孟大偉,陳建偉,陳國強
在中央區藥物難治性癲癇的手術治療中,既要求最大限度地切除致癇灶,又需要減輕術后神經功能缺損,因此中央區藥物難治性癲癇的手術治療對神經外科醫生極具挑戰[1-2]。目前對于中央區藥物難治性癲癇的術前評估,需要通過癲癇發作的癥狀和頭皮腦電圖(electroencephalography,EEG)、顱腦磁共振成像(magnetic resonance imaging,MRI)、腦磁圖、正電子發射計算機斷層掃描成像(positron emission tomography-computed tomography,PET-CT)等無創性檢查綜合定位致癇灶,但對于MRI陰性中央區藥物難治性癲癇上述方法卻無法精確定位致癇灶和功能區。近年來,立體定向腦電圖(stereoelectroencephalography,SEEG)因其能夠精準植入電極并精確定位致癇灶和功能區等優勢,在藥物難治性癲癇的術前評估中得到了廣泛的應用,但其在MRI陰性中央區藥物難治性癲癇中的應用尚未見報道。為此,本研究回顧性分析了采用SEEG對MRI陰性中央區藥物難治性癲癇定位致癇灶并完成手術治療患者的臨床資料,以探討SEEG在MRI陰性中央區藥物難治性癲癇術前評估中的應用價值。
1 對象與方法
1.1 研究對象 回顧性選取2016年1月至2021年12月北京航空總醫院神經外科收治的采用SEEG定位致癇灶并完成手術治療的MRI陰性中央區藥物難治性癲癇患者10例,其中男7例,女3例;年齡9~30歲,平均(19.0±7.9)歲;病程4~22年,平均(9.9±5.7)年;10例患者的顱腦MRI均表現為陰性,10例患者的臨床資料見表1。本研究通過北京航空總醫院倫理委員會審核批準(2016111581671076)。
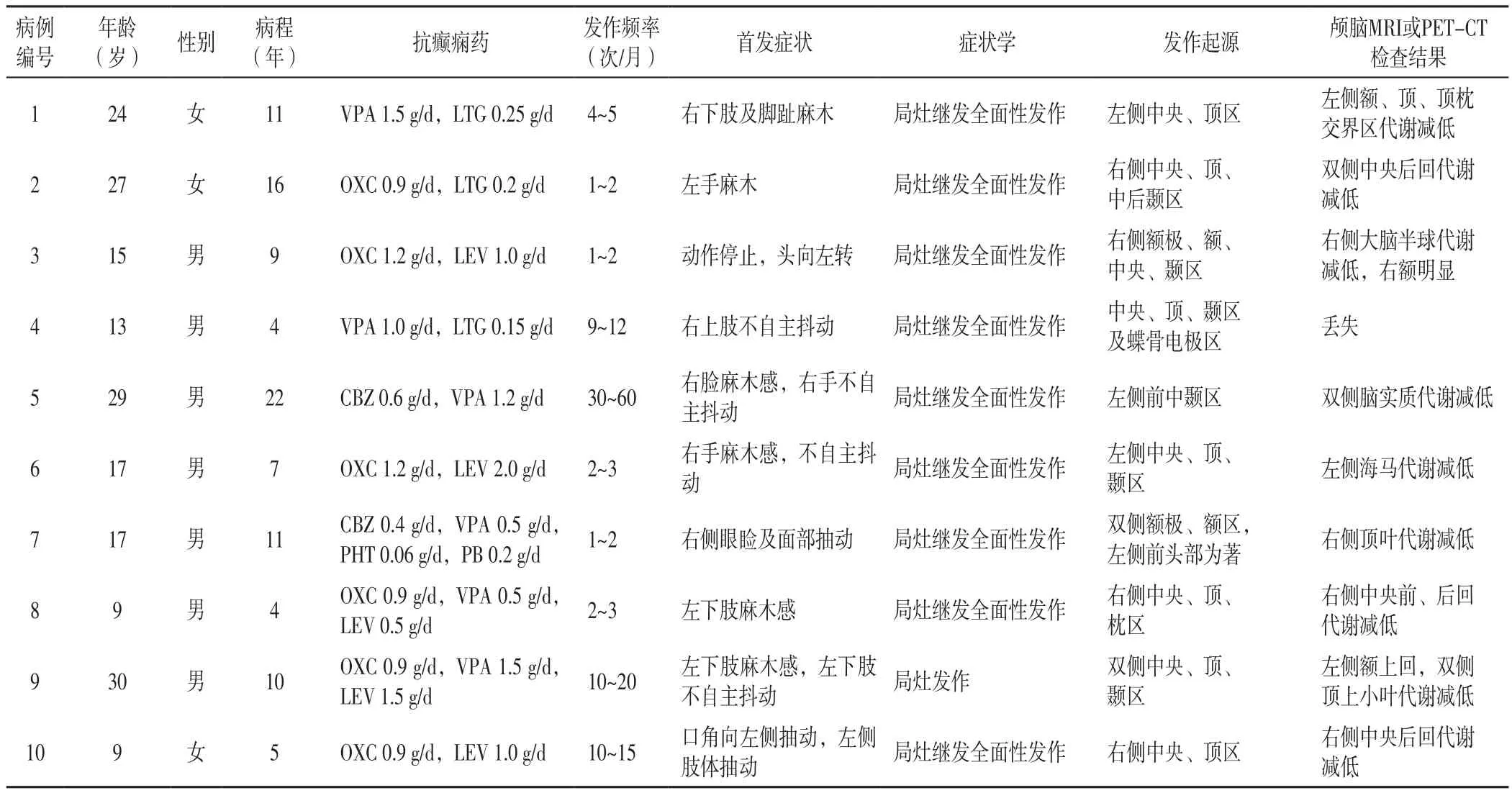
表1 10例MRI陰性中央區藥物難治性癲癇患者的臨床資料Table 1 Clinical data of 10 patients with MRI-negative drug-resistant epilepsies in central region
1.2 Ⅰ期術前評估 根據患者臨床資料,包括首發癥狀、癥狀學、發作起源、影像學資料(顱腦MRI或PET-CT檢查結果)等,由多學科團隊討論進行Ⅰ期術前評估,10例患者Ⅰ期術前評估均不能精確定位致癇灶,需要植入顱內電極,根據Ⅰ期術前評估結果確定顱內電極的覆蓋區域并設計電極植入方案。
1.3 大腦中央區初步定位 SEEG術前應用3.0T MRI(西門子)進行薄層掃描,掃描序列包括3D序列(1 mm3)、T1序列、三維液體衰減反轉恢復序列(3D-fluid attenated inversion recovery,3D-FLAIR)、相位對比血管成像(phase contrast MRA,PC-MRA)。將MRI和PET-CT數據導入Neurotech手術計劃系統(清華大學自主研發)。在顱腦MRI軸位圖像上依靠特征性的Ω形狀判斷該部位為手的功能運動區[3-4],見圖1,其后方為從內向外的腦溝,恒定的溝即為大腦中央溝,應用Neurotech手術計劃系統在軸位不同層面將順中央溝往外延續到硬膜下的位置連成一條線,3D重建后可以顯示中央溝在腦表面的軌跡,以此描繪一側中央溝的全程,見圖2。
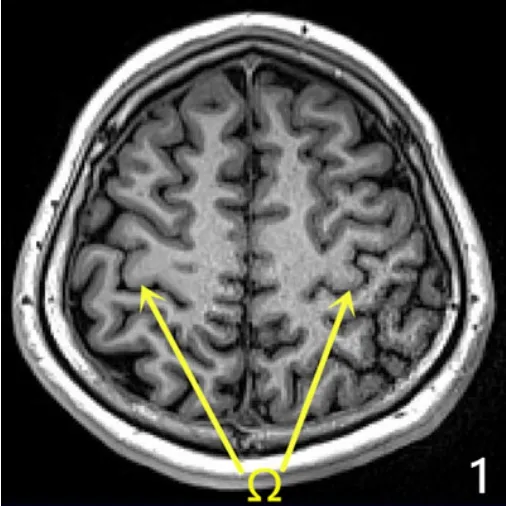
圖1 患者顱腦MRI檢查結果Figure 1 Brain MRI examination results of the patient
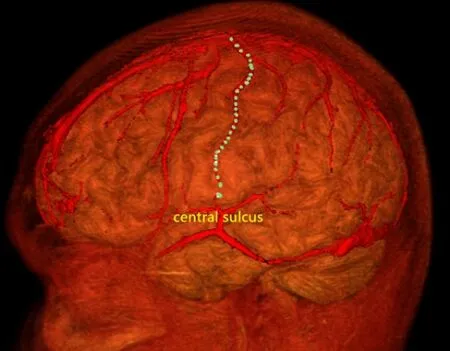
圖2 應用Neurotech手術計劃系統顯示中央溝在腦表面的軌跡Figure 2 Trajectory of the central sulcus on the surface of the brain visualized by Neurotech surgery planning system
1.4 電極植入計劃的制定 放置電極的數量并非固定不變的,有學者認為電極數量通常為7~14根。當電極數量少于6根時,應考慮有無行SEEG的必要。相反,當電極數量多于15根時,可以適當減少電極的數量[5]。也有學者認為,對于中央區癲癇患者,放置每根電極均要考慮血腫發生率及患者風險-收益比[6]。本研究放置電極位置優先考慮患者的首發癥狀,同時考慮患者的大腦體積及患者的經濟因素等,根據患者發作期及發作間期EEG解釋患者發作起源并確定致癇灶的大體位置,如PET-CT結果與該區域重合,則該區域為重點放置電極的區域,同時通過綜合評估患者的風險-收益比調整放置電極的數量,以增加定位的準確性。
1.5 SEEG電極植入 局部麻醉下安裝Leksell頭架后,進行顱腦CT掃描(層厚0.75 mm),將掃描后的CT與術前的手術路徑計劃融合校準,得出每根電極的坐標參數(X、Y、Z、arc、Ring)。患者氣管插管全身麻醉后,根據計算好的電極坐標,依次進行電極植入[2]。術后再次進行顱腦CT掃描,將CT圖像傳入Neurotech 手術計劃系統,與術前圖像進行融合,由此確認電極植入位置的準確性,明確有無電極彎曲或折斷、顱內血腫等并發癥,術后行長程視頻腦電監測。
1.6 Ⅱ期術前評估及手術 10例患者行顱內電刺激驗證致癇灶及明確功能區,每個觸點分別給予50 Hz、1~8 mA電刺激,并記錄患者的主觀感受、有無誘發發作及有無后放電。多學科討論確定發作起源,制定手術切除范圍和切除計劃。手術切除原則:在保留功能區的情況下,最大限度地將發作放電起始區、早期受累區、發作間期頻繁放電區及電刺激后誘發慣常發作區的皮質切除。
1.7 術后隨訪 患者術后持續門診及電話隨訪,評價術后癲癇控制效果和神經功能缺損情況。(1)癲癇控制效果:術后6個月采用Engel分級評定癲癇控制效果,達到EngelⅠ級和EngelⅡ級為治愈[7]。(2)神經功能缺損情況:術后第1天、第7天及術后3個月評價患者肌力,分為0~Ⅴ級;采用美國脊髓損傷協會(American Spinal Injury Association,ASIA)感覺指數評價患者感覺障礙情況。
2 結果
2.1 SEEG情況 10例患者植入電極數量為9~18根,共109根,平均植入電極數量為(10.9±2.9)根;觸點總數為1 112個,其中涉及中央區電極97根,觸點數為978個。SEEG時間為3~24 d,平均(10.9±6.1)d。電極植入及長程視頻腦電監測過程中無顱內出血、電極脫落、顱內感染、腦脊液漏等并發癥發生。
2.2 術后隨訪情況 10例患者均根據Ⅱ期評估結果進行了局部腦皮質切除術,術后隨訪6~19個月,平均(11.6±3.9)個月。癲癇控制效果:EngelⅠ級6例,EngelⅡ級2例,EngelⅢ級2例,治愈率為8/10。10例患者術后出現肢體及面部麻木7例,均于3個月后消失;術后出現對側肢體癱瘓2例,其中1例患者術后3個月肌力恢復正常,另1例患者術后3個月下肢肌力恢復至4級、上肢肌力正常。10例患者的SEEG情況及術后隨訪結果見表2。
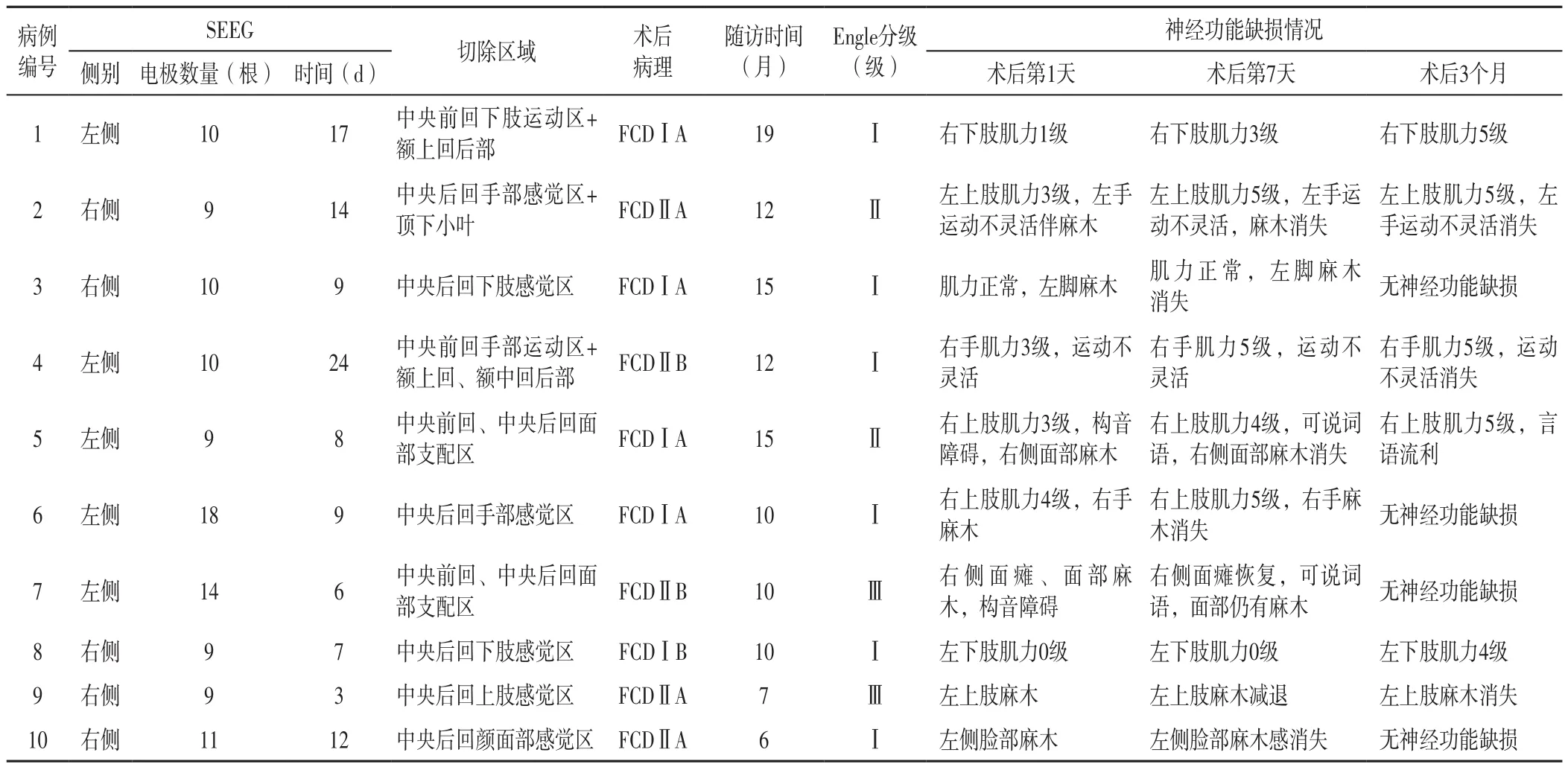
表2 10例MRI陰性中央區藥物難治性癲癇患者的SEEG情況及術后隨訪結果Table 2 SEEG status and postoperative follow-up of the 10 patients with MRI-negative drug-resistant epilepsies in central region
3 討論
中央區藥物難治性癲癇一直是癲癇外科工作的難點,手術既要最大限度地切除致癇灶又要最小限度地損傷功能區,因此精確定位致癇灶和功能區是手術的關鍵,既往多應用術中電刺激或開顱埋藏皮質電極后電刺激來定位功能區,但是創傷較大[8-9],近年來隨著對癲癇癥狀學認識的深入以及SEEG等先進技術的應用,使得微創下精確定位致癇灶和功能區成為可能。
中央區癲癇患者癲癇發作的癥狀學十分復雜,不同腦功能區發作起源會表現為相應區域所支配的功能異常,局灶性的運動發作常定位于中央前回相應皮質運動區,而局部感覺異常通常起源于中央后回及其附近,癲癇發作累及中央區島蓋部時則會有言語停頓、發聲或言語困難,對側面部運動、吞咽、舌蠕動感,舌不靈活或冷感等癥狀。中央區癲癇發作時常會繼發全面性發作,發作后常伴有Todd麻痹。本研究10例患者中9例患者癲癇發作時首先出現了不同部位的感覺及運動異常,然后導致了全面的癲癇發作,這些患者考慮致癇灶位于功能區,但是憑借癥狀學及無創檢查無法定位致癇灶,需要借助植入顱內電極來定位致癇灶及功能區。
研究表明,在顱腦MRI軸位圖像上依靠特征性的Ω形狀可以判斷該部位為手的功能運動區[10-11],然后應用Neurotech手術計劃系統初步描繪出大腦的中央溝,但大腦功能區的分布存在個體差異[12],簡單通過解剖關系定位功能區的方法存在一定的誤差。目前功能性MRI、彌散張量成像、腦磁圖、PET-CT等功能影像學也能夠對皮質功能區和皮質下傳導束做無創定位,但目前其定位的可靠性及精確性欠佳[13],不能單純以此為指導進行功能區的手術。目前認為大腦皮質電刺激是定位功能區的“金標準”[14],既往多通過植入皮質片狀電極,然后通過皮質電刺激定位功能區,但是這類手術需要開顱埋藏顱內電極,手術創傷大,術后出血、感染發生率高[15]。也有研究應用術中電生理監測定位功能區,但術中監測必定會延長手術時間、增加出血及感染的發生率,另外電刺激會誘發癲癇,發作嚴重時會引起腦膨出、腦缺血、腦損傷等,進而增加手術風險[16-17]。本研究結果顯示,密集的SEEG電極植入亦可以達到精確定位功能區的效果,本研究中1例患者在中央前后回植入了18根電極(見圖3),分別對每個電極的每一個觸點給予50 Hz、1~8 mA電刺激,當患者出現運動或感覺癥狀時不再增加電流強度,通過電刺激準確描繪出了肢體感覺及運動分布區在中央前后回的分布。SEEG術前利用Neurotech手術計劃系統重建中央溝,粗略地明確功能區后,再次利用顱內電極電刺激的方法,更加精確地定位功能區。因此利用SEEG技術可以代替開顱埋藏皮質電極以及術中電刺激定位功能區,這樣既縮短了手術時間,又避免了術中電刺激以及開顱帶來的手術風險。
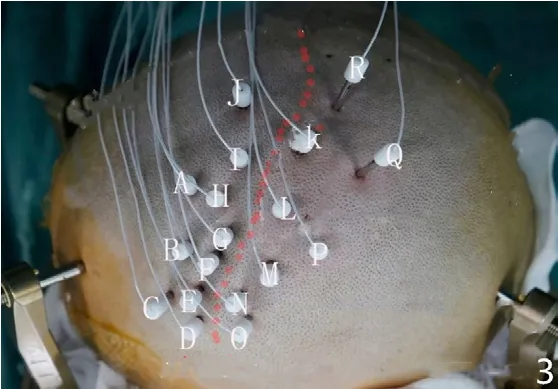
圖3 患者植入電極情況Figure 3 Implanted electrodes of the patient
中央區癲癇致癇灶的精確定位是手術治療癲癇成功與否的關鍵,EEG為癲癇的診斷手段之一,但研究表明,EEG受頭皮、顱骨、肌電活動和運動等多種偽差的影響,其空間分辨率低,僅能采集到6 cm2范圍以上的信號,不能精確定位中央區癲癇患者的致癇灶[18-19]。對于MRI陰性的中央區癲癇患者,致癇灶的定位更加困難。OSTERGARD等[20]對既往16篇文獻(共包含了208例患者)分析發現,通過顱內電極定位并手術切除中央區致癇灶后,癲癇控制率達84.4%,67.8%的患者達到EngelⅠ/Ⅱ級,僅有23.1%的患者出現了遠期神經功能障礙。本研究10例患者中8例達到EngelⅠ/Ⅱ級,且無嚴重神經功能障礙。既往研究多應用埋藏皮質電極的方法定位中央區致癇灶[21],本課題組既往研究發現,通過埋藏皮質電極與SEEG定位致癇灶的患者術后癲癇控制和并發癥發生率比較差異無統計學意義,而埋藏皮質電極需要開顱放置電極,創傷較大,并發癥發生率高,SEEG通過微創鉆孔放置電極,降低了顱內血腫、顱內感染、術后腦組織腫脹發生率[22]。另外,SEEG不受空間限制,可以在局部腦區放置多根電極,且可以對皮質電極所不能達到的深部結構如腦溝底部、島葉等部位進行監測。由此可見,SEEG對于中央區致癇灶的定位是值得肯定的。
綜上所述,SEEG可以個體化、密集化地將顱內電極植入某個腦區,精確定位致癇灶,使得中央區癲癇手術切除更精細化,術后不遺留明顯的神經功能障礙,適合MRI陰性中央區藥物難治性癲癇患者的術前評估,在MRI陰性中央區藥物難治性癲癇致癇灶及功能區的定位中發揮了重要作用。但本研究尚存在一些局限性,如由于技術原因,未進行功能性MRI檢查。近年來,隨著技術的發展,功能性MRI、術中MRI、術中導航系統等使手術切除更為準確,神經功能缺損發生率降低。此外,本研究樣本量較小,今后應進行大規模的研究,以指導癲癇致癇灶及功能區的定位,制定更精細化的手術切除策略。
作者貢獻:張光明、陳國強進行文章的構思與設計,研究的實施與可行性分析;王玉根、孟大偉、陳建偉進行資料收集;王玉根進行資料整理,論文撰寫,統計學處理;王玉根、孟大偉、陳建偉進行論文的修訂;陳國強負責文章的質量控制及審校,對文章整體負責、監督管理。
本文無利益沖突。

