任務導向的高中化學課堂教學實踐
王海富



摘要:立足于高二學生的認知水平,對比分析不同版本教材相關內容,探究任務導向的鹽類水解課堂教學實踐。關鍵詞:任務導向;鹽類的水解;教學實踐
文章編號:1008-0546(2022)07-0051-03中圖分類號:G632.41文獻標識碼:B
doi:10.3969/j.issn.1008-0546.2022.07.013
一、主題內容及相關研究
鹽類的水解是高中化學知識的重要內容之一。要求學生通過這部分知識的學習,認識鹽類水解的原理和影響鹽類水解的主要因素;了解水溶液中的離子反應與平衡在物質檢測、化學反應規律研究、物質轉化中的應用。《普通高中化學課程標準(2017年版2020年修訂)》還增加了離子反應與平衡的應用的要求,包括“能調控溶液的酸堿性”“能綜合運用離子反應、化學平衡原理,分析和解決生產、生活中有關電解質溶液的實際問題”等基于真實情境的學業要求[1]。關于必做實驗,使用“鹽類水解的應用”這一具有鮮明應用取向的表達方式,而非“探究鹽類水解的規律”,突出了重視真實任務情境、強調知識應用的特點[2]。
不同版本的教材對該內容的呈現也各有特色。人教版教材以“水溶液中的離子反應與平衡”為小標題,設計了“探究”和“思考與討論”等多種活動形式,重點介紹鹽類水解的知識,涉及水與鹽之間的作用,應用化學平衡理論建立鹽類水解平衡,得出鹽溶液呈酸性、堿性的原因及其應用。
蘇教版教材以“溶液中的離子反應”為小標題。首先是通過實驗探究鹽溶液的酸堿性,認識鹽溶液并不都是中性;其次是歸納不同類型鹽溶液顯酸堿性的微觀原因,認識鹽類水解的本質;最后是“鹽類的水解”概念定義、概念表達及概念應用。
魯科版教材以“物質在水溶液中的行為”為小標題。首先通過實驗探究不同鹽溶液的酸堿性及其微觀原因,認識鹽類水解的本質、規律;其次通過實驗和討論,推測影響鹽類水解平衡的因素;最后通過泡沫滅火器實驗演示,引導學生利用“鹽類的水解”原理解決實際問題。
筆者認為,教學時應充分挖掘不同版本素材,從宏觀現象(不同鹽溶液的pH)入手,圍繞溶液中存在的粒子、粒子之間的反應、水解平衡的建立及其移動等微觀本質,借助實驗手段讓學生從宏觀辨識走進微觀探析,理解鹽類水解的規律;注意引導學生緊密聯系生活,綜合運用水解知識,強化學生理論聯系實際的能力。
二、學生認知及教學目標研究
從學生素養提升角度看,需要關注以下方面。( 1)宏觀辨識與微觀探析:從鹽的組成和結構上預測、探究驗證鹽類溶液的酸堿性,理解組成鹽的離子在水中的反應規律;(2)模型認知與證據推理:以任務導向為前提,項目驅動鹽類水解教學,發展學生建模能力;(3)變化觀念與平衡思想:通過實驗探究,理解鹽類水解的本質和內在規律;(4)科學探究與創新意識:初步具備利用鹽類水解知識去解決問題的能力,進一步提升科學探究能力,增強創新意識和社會責任感。
從學生可能存在的模糊概念和教學難點角度看,需要增加探究實驗中加水、鹽酸對氯化鐵水解平衡的影響。學生在理解弱電解質概念與鹽、水電離形成的離子之間反應的內在聯系;鹽的水解常數與水的離子積、弱電解質的電離常數之間的定量關系方面可能會存在困難。
三、教學設計思想及創新點
從探究氯化鈉、碳酸鈉等鹽溶液的酸堿性入手,通過對實驗現象的分析和討論,引導學生預測鹽溶液的酸堿性與組成該鹽的酸和堿相對強弱之間的關系,以符號表征鹽溶液中粒子間發生的反應及建立的平衡,引導學生從微觀層面理解鹽溶液呈酸堿性的本質。通過實驗探究,揭示鹽水解的內在規律,形成思維模型。引導學生利用鹽類水解的原理凈水、滅火等,將理論知識與實際應用相結合。
通過新穎的呈現方式激發學生主動參與學習過程,啟發思維,培養其證據推理意識,突出了微粒觀、變化觀、平衡觀等學科觀念;將鹽類水解的過程示意圖化,將抽象的內容圖示化,有利于學生從微觀層面理解鹽類水解平衡建立及移動的過程,從而降低學習難度,減少理論學習的枯燥感。
四、教學流程
教學流程如圖1所示。
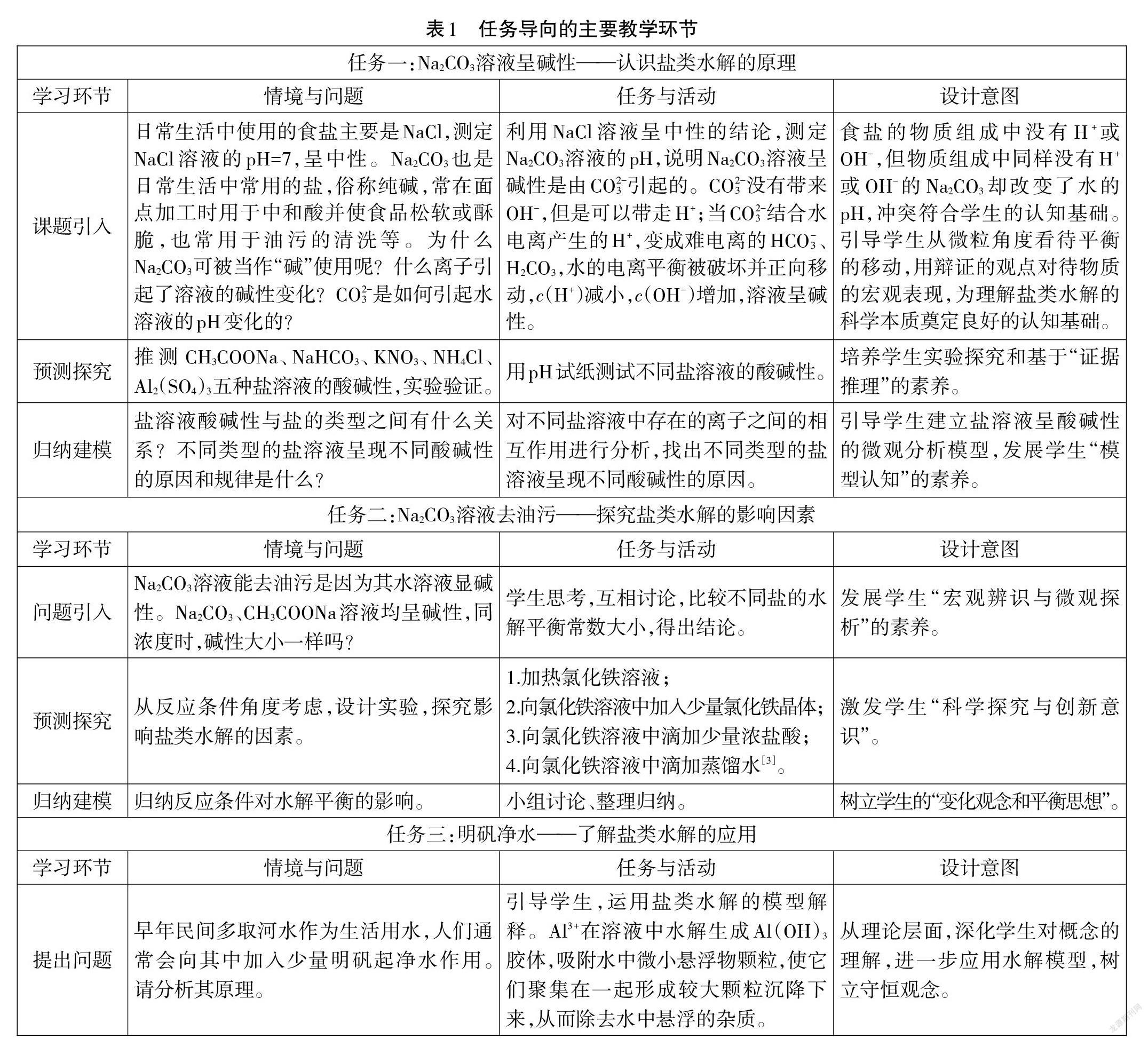
五、任務導向的主要教學環節
六、教學反思
本節課主要通過實驗探究,從微觀視角去探析離子之間的行為,構建鹽類水解的概念和模型,形成對鹽類水解本質認識;通過宏觀辨識和證據推理,建立變化觀念與平衡思想,進一步發展和應用鹽類水解模型,增強學生的科學探究精神和對社會、生活的關注及責任意識。在介紹鹽類水解的原理、影響因素和應用時,以“探究”“思考與討論”“方法引導”“資料卡片”等形式,引導和培養學生舉一反三、辯證思考的思維習慣和能力。
在教學設計時,將教學內容依據知識要點、學生認識發展點來分板塊設計,以任務導向、項目驅動展開教學。以知識為線索的設計分為:水解概念→影響因素→應用;以學生的認識發展點為線索的設計分為:酸堿性如何→酸堿性強弱→酸堿性的啟示。以碳酸鹽溶液呈堿性引入課題,碳酸鹽濃度不同堿性不同引入影響水解平衡的因素,最后是明礬水解在凈水中的實際應用。這樣一條線把三項任務進行串聯,每項任務里面以“問題提出→預想推測→驗證建模”為組織構建展開教學。
在教學環節注重對學生的方法引領、自主探究以及思維建模,沒有追求面面俱到,力求方法介紹;沒有追求知識呈現上的按部就班,力求問題整合。鹽類水解概念引入打破常規設計的先實驗后分析,改為先預測再探究分析;水解平衡移動影響中增加蒸餾水實驗探究;水解應用在介紹了鋁離子水解和雙水解基礎上模仿、遷移和拓展,增加了魯科版滅火器雙水解、古書修復的實際應用等,讓教學環節更接地氣。整個教學環節將核心概念和核心知識融合,在解決問題的過程中提升學生的思維能力,發展學生的化學核心素養。
當然在教學實踐中,教師也要力求能把教材實驗處理得當、分析到位。例如,在水解平衡移動影響的探究中,教師引導學生對蒸餾水影響平衡移動的原因分析時,要注意 Fe(OH)3只是最終形式[4],其實還有中間產物[Fe(H2O)5OH]2+、[Fe(H2O)4(OH)2] +、[Fe2(H2O)4 (OH)2 ]4 +等 [5-6],辯證理解濃度商 Q =c3(H+) 把Fe(OH)3當做 Fe3+水解的唯一形式,學生將會對類似的鹽類水解無所適從,如 Ag++H2OAgOH+H+,當不考慮 Ag+水解存在的中間各種絡合形式,就衡不移動,這與加入蒸餾水促進水解平衡是矛盾的。另外,實驗中向棕黃色 FeCl3溶液中滴入2-3滴濃鹽酸,溶液顏色變淺;當繼續滴入濃鹽酸時,溶液顏色變成亮黃色。教師在演示中需要控制好濃鹽酸的量,因為隨著濃鹽酸加入量的增多,Cl-濃度增大,下述絡合平衡:
[FeCl(H2O)5]2++Cl- [FeCl2(H2O)4]++H2O
[FeCl2(H2O)4 ]++2Cl-[FeCl4(H2O)2 ]-+2H2O 與 FeCl3水解平衡之間可能形成競爭,從而導致溶液顏色的變化。為減少 Cl-的競爭反應對實驗的干擾,建議選擇中等濃度的硫酸。蘇教版教材在該實驗探究時選擇向硝酸鐵溶液中滴加硝酸溶液,回避氯化鐵,避免Cl-的影響,值得借鑒。
參考文獻
[1] 中華人民共和國教育部.普通高中化學課程標準(2017年版2020年修訂)[S]. 北京:人民教育出版社,2020:33-67.
[2] 王湛,等.普通高中化學課程標準(2017年版)解讀[M].北京:人民教育出版社,2018:122-174.
[3] 人民教育出版社,課程教材研究所,化學課程教材研究中心. 普通高中教科書·化學反應原理(選擇性必修1)[M].北京:人民教育出版社,2020:73.
[4]人民教育出版社,課程教材研究所,化學課程教材研究中心. 普通高中教科書·化學(必修1)[M]. 北京:人民教育出版社,2020:8.
[5]北京師范大學,華中師范大學,南京師范大學無機化學教研室. 無機化學(下冊第四版)[M]. 北京:高等教育出版社,2007:770.
[6]宋天佑,等. 無機化學(下冊第一版)[M]. 北京:高等教育出版社,2012:641.

