下調lncRNA-MALAT1表達對新生大鼠缺氧缺血性腦損傷的保護作用
樊帥帥 宋磊軍 藺 聰 劉 揚
新生兒缺氧缺血性腦損傷(hypoxic-ischaemic brain damage,HIBD)是臨床常見病,預后較差。研究發現,lncRNA肺腺癌轉移相關轉錄子1(metastasis-associated lung adenocarcinoma transcript 1,lncRNA-MALAT1)下調明顯促進小鼠缺血性腦卒中后血管新生[1]。腦源性神經營養因子(brainderived neurotrophic factor,BDNF)及其受體原肌球蛋白相關激酶B(tropomyosin-related kinase B,TrkB)信號通路與神經細胞生長、凋亡密切相關,且該通路已被證實參與HIBD的調控[2]。本研究抑制lncRNAMALAT1表達新生大鼠HIBD模型的影響及其作用機制。
1 材料與方法
1.1 實驗動物及分組SPF級7 d齡SD大鼠40只(雌雄各半,體質量在12~16 g),購自鄭州大學實驗動物中心[許可證號SCXK(豫)20180001,倫理批號IACUC20190525001]。將大鼠隨機分為假手術組、模型組、lncRNA對照組、silncMALAT1組,每組10只。
1.2 模型制作 以Rice-Vannucci法建立新生大鼠HIBD模型[3]。吸入2%七氟醚維持麻醉,永久結扎左側頸總動脈(假手術組僅穿線不結扎),蘇醒后繼續喂養2 h,置于有機玻璃缺氧箱,持續輸入含8%O2、92%N2的混合氣體,缺氧2 h,觀察大鼠行為,出現夾尾、尖叫、自發左轉圈,則建模成功。模型組造模失敗2只,lncRNA組失敗2只,silncMALAT1組失敗1只,最終35只大鼠納入研究:假手術組10只,模型組8只,lncRNA對照組8只,silncMALAT1組9只。
1.3 給藥方法 建模成功后2 h,2%七氟醚麻醉,大鼠腦立體定位儀標記左側側腦室[4]。lncRNA對照組、silncMALAT1組緩慢推注空載體重組腺病毒、silnc-MALAT1各5μl(病毒滴度為2.5 ×1013pfu/L,上海吉瑪制藥技術有限公司提供)。假手術組、模型組推注5μl生理鹽水。停針1 min后緩慢退針,骨臘封閉。
1.4 Morris水迷宮試驗評估空間學習和記憶能力[5]造模后7 d進行1次適應性訓練,造模后8~11 d進行定位巡航試驗,記錄90 s內登陸安全平臺的時間即為逃避潛伏期,若90 s內未找到則引導至安全平臺,停留30 s,記錄為90 s。造模后12 d撤去安全平臺,記錄90 s內的游泳軌跡,分析目標象限停留時間及穿越目標象限內安全平臺的次數。
1.5 TUNEL染色檢測海馬神經元凋亡情況Morris水迷宮測試次日處死大鼠,迅速分離海馬組織,4%多聚甲醛固定48 h,石蠟包埋,制作4μm冠狀位切片。按照TUNEL試劑盒(美國Roche公司)說明書操作,DAB顯色,蘇木精核染,封片,顯微鏡下觀察細胞核染棕黃色或黃色顆粒則為凋亡細胞,記錄每平方毫米凋亡細胞數。見圖1。
1.6 實時定量PCR法檢測mRNA的表達 取海馬組織70 mg,采用Trizol試劑提取組織總RNA,逆轉錄獲得cDNA,再采用SYBR Green I實時PCR試劑盒(上海羽朵生物科技有限公司)進行實時定量PCR。以β-actin為內參,以2-ΔΔCT法計算相對表達量。
1.7 免疫印跡法檢測蛋白表達 取海馬組織50 mg,組織裂解液冰上裂解30 min,4℃預冷,16 099.2 g離心15 min,取上清液測定總蛋白濃度。取10μg待測蛋白和40μg上樣緩沖液混勻,置于沸水中10 min,16 099.2 g心10 min,進行SDS-PAGE電泳,經轉膜、封閉、兔抗大鼠BDNF、TrkB單抗一抗(美國Abcam公司)、HRP標記的二抗孵育(美國Abcam公司),顯影、曝光,分析并計算目的蛋白與內參β-actin灰度值比值。
1.8 統計學方法 采用SPSS 21.0 軟件分析;計量資料均以x±s表示,采用單因素方差分析和SNK-q檢驗;P<0.05 為差異有統計學意義。
2 結果
2.1 lncRNA-MALAT1對HIBD大鼠學習和記憶功能的影響Morris水迷宮試驗結果顯示,與假手術組相比,模型組、lncRNA對照組目標象限停留時間和穿越平臺次數均明顯減少(P<0.05 ),模型組和lncRNA對照組之間無統計學差異(P>0.05 )。與lncRNA對照組相比,silncMALAT1組目標象限停留時間和穿越平臺次數均明顯增加(P<0.05 )。見表1。
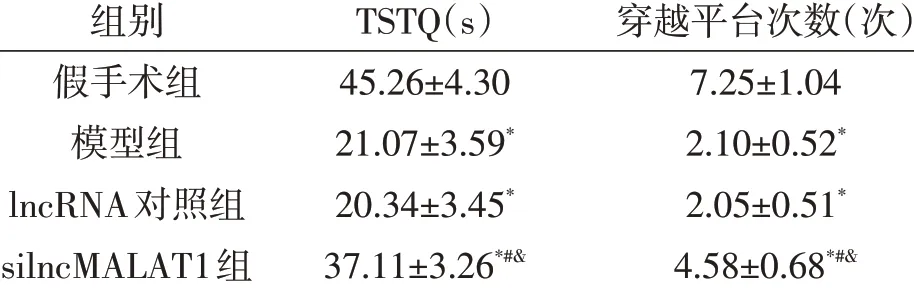
表1 Morris水迷宮實驗分析下調lncRNA-MALAT1表達對新生大鼠HIBD后學習和記憶功能的影響
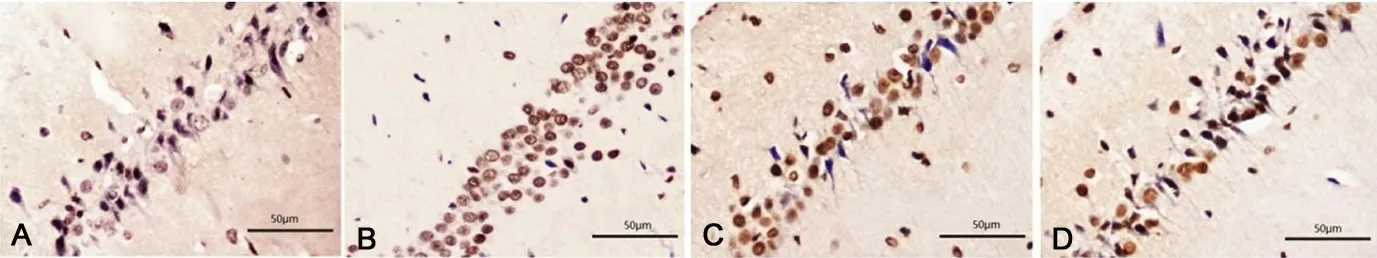
圖1 TUNEL染色分析新生大鼠缺氧缺血腦損傷后海馬神經元凋亡情況
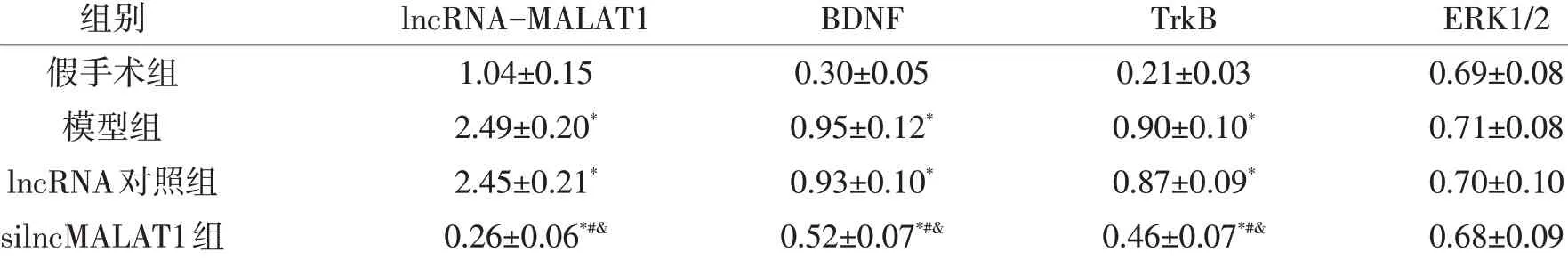
表2 下調lncRNA-MALAT1表達對新生大鼠HIBD后海馬組織mRNA表達量的影響
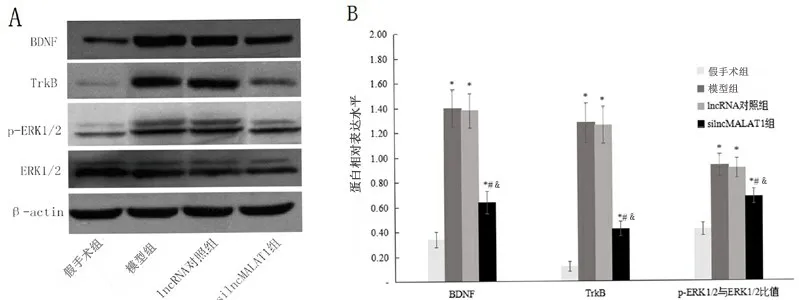
圖2 下調lncRNA-MALAT1表達對新生大鼠HIBD后海馬組織蛋白表達量的影響
2.2 lncRNA-MALAT1對HIBD大鼠海馬神經元凋亡的影響 與假手術組[(24.20 ±2.31 )個/mm2]相比,模型組[(146.00 ±12.14 )個/mm2]、lncRNA對照組[(143.60 ±12.54 )個/mm2]海馬神經元凋亡數量明顯增加(P<0.001 ),模型組和lncRNA對照組之間無統計學差異(P>0.05 )。與lncRNA對照組相比,silncMALAT1組[(71.40 ±8.06 )個/mm2]海馬神經元凋亡數量明顯減少(P<0.05 )。
2.3 lncRNA-MALAT1對HIBD大鼠海馬BDNF/TrkB信號通路的影響 與假手術組相比,模型組、lncRNA對照組BDNF、TrkB、ERK1/2 mRNA和蛋白表達水平均明顯增高(P<0.05 ),模型組和lncRNA對照組之間無統計學差異(P>0.05 )。與lncRNA對照組相比,silncMALAT1組BDNF、TrkB、ERK1/2 mRNA和蛋白表達水平均明顯降低(P<0.05 )。見表2、圖2。
3 討論
HIBD的發病機制復雜。研究顯示,HIBD后神經元及星形膠質細胞最先受到損害,累及神經元軸突及微血管功能系統,進一步損害神經信號傳導功能。應用最廣泛的HIBD動物模型為Rice-Vannucci法制作的模型,該模型與臨床HIBD病理基礎相似,與完全缺氧法制作的模型相比,可有效降低死亡率,且成模一致性較高[3]。本文83.33 %的新生大鼠出現異常神經行為學表現,提示建模成功率高。
本研究發現,silncMALAT1組大鼠海馬組織lncRNA-MALAT1表達量降低、海馬神經元凋亡數減少,目標象限停留時間延長,穿越平臺次數增多,說明下調lncRNA-MALAT1可抑制HIBD新生大鼠的海馬神經元凋亡,改善學習和記憶功能。小動脈側支循環的建立對糾正HIBD至關重要,而多種lncRNA在血管新生方面發揮重要調控作用。有研究表明,缺氧可促進大鼠腦組織微血管內皮細胞lncRNA-MALAT1表達上調,參與調節缺氧性腦損傷,但具體調控機制不明[6]。本研究silncMALAT1組海馬組織BDNF、TrkB mRNA和蛋白表達量,以及p-ERK1/2與ERK1/2比值均降低,說明新生大鼠HIBD發病機制可能與激活BDNF/TrkB信號通路介導的海馬神經元凋亡有關。TrkB與BDNF結合后可發生二聚體化,從而磷酸化激活下游ERK1/2信號通路,參與調控細胞凋亡。Atif等[7]研究表明,BDNF/TrkB信號通路與小鼠HIBD后急性行為性癲癇和腦梗死面積減少有關。研究發現,下調lncRNA-MALAT1可抑制脂多糖誘導的小膠質細胞活化,參與調控腦內炎癥反應[8]。這說明lncRNA-MALAT1可能與海馬區BDNF/TrkB信號通路存在相互作用,抑制lncRNA-MALAT1表達可抑制BDNF/TrkB信號通路,從而調控HIBD進程。
總之,下調lncRNA-MALAT1表達對新生大鼠HIBD具有保護作用,可能與抑制BDNF/TrkB信號通路有關。

