KV-CBCT圖像引導胸腺瘤放療不同標記點擺位誤差分析及外放邊界
趙鵬 張惠玲 陳曉芳 吳小良 許會軍
胸腺瘤多為起源于胸腺上皮細胞或淋巴細胞的實體腫瘤,常伴發自身免疫性疾病,包括重癥肌無力、純紅細胞再生障礙性貧血、低丙種球蛋白血癥、系統性紅斑狼瘡等,其中重癥肌無力為最常見。胸腺瘤WHO主要分為A、AB、B1、B2、B3。病理類型不僅影像學上存在差異,在臨床預后上也有較強價值,B2、B3型胸腺瘤有較高復發率和較差預后。胸腺瘤是具有侵襲性的非惡性腫瘤,由非惡性胸腺瘤上皮細胞和部分淋巴細胞組成,淋巴結轉移及血行轉移特別少見,術后局部和(或)區域復發為常見失敗原因。胸腺瘤可認為是惡性腫瘤,治療方式主要為手術切除[1,2]。研究報道胸腺瘤患者,即使腫塊完全切除后仍有可能出現遠處轉移和復發[3-5],所以胸腺瘤術后常給予放射治療。目前主要采用直線加速器圖像引導調強放療,圖像引導調強放療不僅提高靶區劑量,而且可以減少正常器官的照射,但這就對放療靶區擺位的精準度提出了更高的要求[6,7]。我院重癥肌無力中心有較多胸腺瘤患者需要放療,為保證胸腺瘤患者的精準放療,本研究通過采集我院胸腺瘤術后放療圖像配準擺位誤差,計算CTV-PTV外擴范圍,使靶區始終在照射野范圍內,達到足夠劑量的照射,同時也可以保護周圍正常組織,既可以保證腫瘤的足量照射,又能最大限度降低正常組織的受照量,如肺、心臟等器官免受不必要的照射,提高患者的生存質量,同時為我院臨床胸腺瘤術后放療CTV-PTV外擴提供理論依據。
1 資料與方法
1.1 一般資料 選擇我院2019年2月至2020年11月接受胸腺瘤放療患者,共36例胸腺瘤術后放療患者,其中男20例,女16例;年齡32~75歲,平均年齡(41.5±1.27)歲。患者均由病理學和影像確診。
1.2 體位固定要求 患者于Klarity集成定位板上,均取仰臥位,雙手上舉抓握固定桿,用Klarity胸腹一體熱塑膜進行體位固定,患者胸前及體膜上做“十”字標記,身體兩側及定位板做兩條豎線標記。
1.3 CT掃描要求 患者胸前“十”字標記要與體膜“十”字標記重合,身體兩側豎線要與Klarity定位板標記線一致,平靜呼吸。CT為西門子Somatom Definition Flash,掃描參數為電壓120 kv,重建層厚5 mm,螺距1.2 mm。掃描范圍為環甲膜至肺底,掃描圖像傳至飛利浦公司Pinnacle9.10放射治療計劃系統,放療醫師勾畫靶區及危及器官。
1.4 CBCT影像獲取及匹配方法 (1)首次治療時按定位CT掃描時進行擺位,Elekta-Synergy VMAT直線加速器自帶CBCT對患者進行掃描,掃描參數為電壓120 kV,Kv Collimator M20,Kv Filter F1,Frames 330。首次治療掃描完成,由放療醫師、物理師、技師共同參與圖像配準,并與原始定位CT圖像進行匹配。36例患者,采用5+1模式即每位患者第1~5次每次治療前均進行CBCT掃描,在線進行位置校正,后續治療中,每周掃描1次。(2)配準框選取范圍的上、下界分別為PTV上、下界外放5 cm,兩側為肺門,前界為包全胸骨,后界包全椎體。先用灰度進行自動配準,然后手動進行微調,分別以胸骨、隆突、椎體為標記點進行圖像配準,記錄LR、CC、AP擺位誤差結果。見圖1~3。
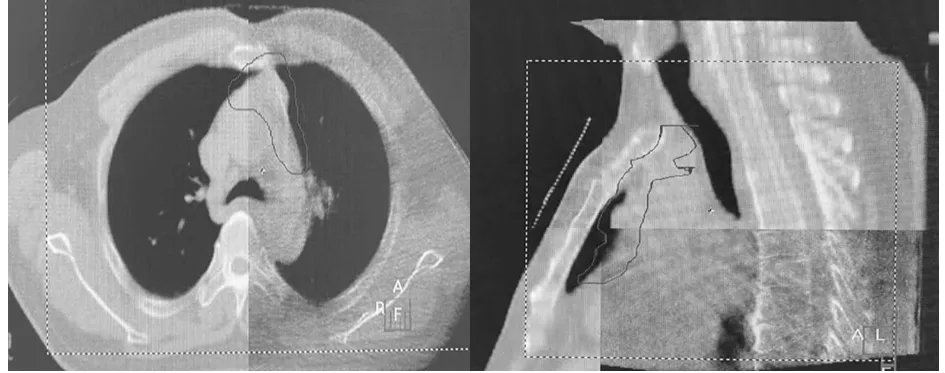
圖1 胸骨配準影像
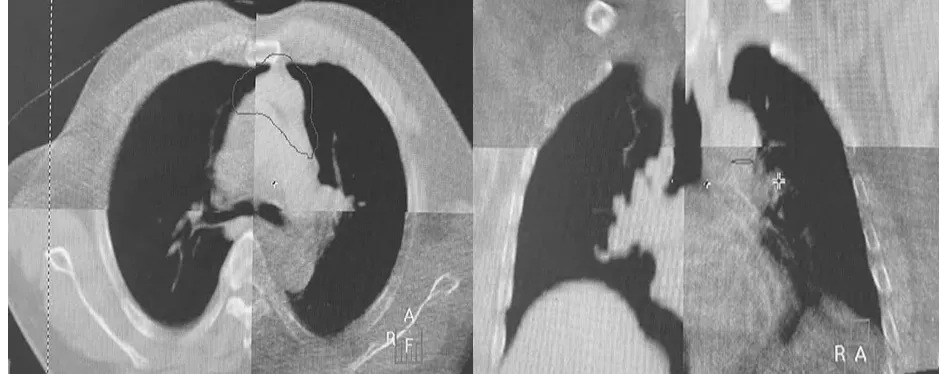
圖2 隆突配準
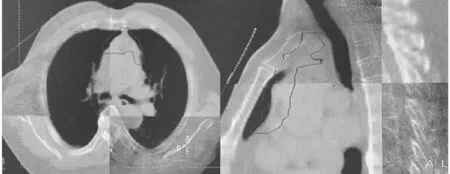
圖3 椎體配準

2 結果
2.1 3種配準標記點分次間擺位誤差結果比較 36例患者,采用三種不同配準標記點進行配準,獲取252組數據,統計三維方向分次間擺位誤差,三種配準標記點在LR、CC、AP擺位誤差分別為胸骨:(0.166±1.818)、(0.175±2.368) 、(0.331±1.848)mm;隆突:(0.140±2.045)、(0.161±3.167)、(-0.265±1.424)mm;胸椎:(0.084±1.889)、(0.25±1.985)、(0.007±1.822)mm,以不同標記點分別LR、CC、AP方向單因素分析顯示,差異無統計學意義(P>0.05)。見表1。

表1 3種配準標記點分次間擺位誤差結果
2.2 一位患者胸骨、隆突和椎體擺位誤差 入組患者中有一位患者擺位誤差絕對值明顯較大,3種標記點進行配準在CC方向均存在較大誤差(即>5 mm),最大值為0.65 mm。見表2。
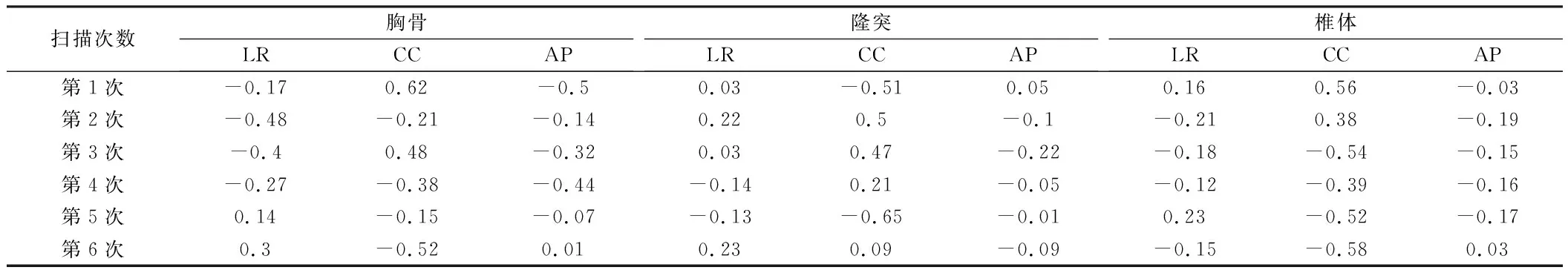
表2 一位患者擺位誤差
2.3 3種配準標記點靶區外擴數值 患者治療期間的分次運動,分為系統誤差和隨其誤差。∑為系統誤差,表示所有樣本平均誤差的標準差,δ為系統誤差,表示所有樣本標準差的均方根,根據van Herk的Mptv=2.5∑±0.7δ公式,計算出3種不同配準標記點CTV-PTV外擴范圍即Mptv。見表3。
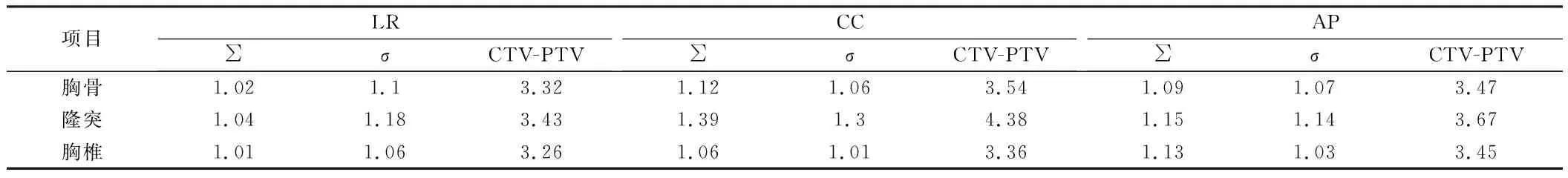
表3 3種配準標記點靶區外擴數值 mm
3 討論
由于胸腺瘤受呼吸運動、大血管及心臟運動的影響,所以適當的靶區外擴可防止跑靶,同樣這也增加了正常組織器官照射體積,甚至出現放射性并發癥,例如心臟毒性和放射性肺炎,心臟毒性反應與心臟的受照劑量的發生呈線性關系,有研究表明,心臟接受3 000 cGy的劑量超過46%體積時,心包積液發生率大概約為13%[2]。同時還有研究表明心臟接受>40 Gy劑量的照射,會誘發心臟疾病[4]。心臟受照射的平均劑量與冠狀動脈的病變發生風險呈正相關,心臟的平均劑量每增加1 Gy,冠狀動脈病變風險大約增加7.4%。放射性肺炎的發生與照射劑量和照射體積有密切的聯系,調強放射治療劑量分布呈現低劑量、大體積的特點,Tanabe 等[8]研究結果顯示低劑量覆蓋肺體積大小是放射性肺炎的獨立危險因素,并且推薦雙肺限制條件V5<55%、V10<37%。同時相似報道還表明放射性肺炎與V5 、V10、V20 發生顯著相關[9,10]。沙莎等[11,12]研究表明肺癌放療患者,當V5>50%時2級放射性肺炎發生率會明顯提高。由于胸腺瘤生存率高,生活質量要求更高,所以在胸腺瘤放療中,需盡可能的降低正常器官受量,通過改進放療技術和減少靶區外擴邊界值。
目前腫瘤的放射治療基本采用三維調強放療,利用多葉光柵對劑量強度進行調整,它能根據需要實現腫瘤靶區不同位置的劑量精準變化,使靶區得到均勻的劑量分布,在三維上使劑量分布與靶區形態一致[13]。CBCT圖像引導放療能對擺位進行在線校準,與定位CT影像進行配準調整,使實際治療狀態接近計劃狀態[14]。由于調強治療劑量梯度變化復雜,劑量的精準分布容易受擺位誤差的影響,因此精確放療中照射靶區位置的準確性是放射治療中最基本的,也是最重要的一個環節[15]。ICRU24號報告指出了體位與治療療效的關系,放射治療過程中靶區位置移動3 mm,療效下降3.3%;移動5 mm,療效下降18.4%;移動6 mm療效下降33.1%[16]。提高擺位的準確性和重復性,減小擺位誤差是調強放療質量控制的重要措施。擺位誤差分為系統誤差和隨機誤差,系統誤差為放射治療設備本身造成的誤差,隨機誤差包括患者治療期間的體位及體型的變化、靶區形態的變化,和技師在治療實踐過程中的水平有關[17]。所以擺位誤差只能降低而不能徹底消除,為此統計擺位誤差,進而計算CTV-PTV外擴邊界成為關鍵。
根據不同應用方法和目的原則而采用不同的CTV-PTV外擴公式,本研究采用van Herk的計算公式[18],同時考慮了系統誤差和隨機誤差對劑量的影響。減小擺位誤差從多個角度來解決,治療技師的水平及認真程度,患者合適的體位和重復性好的皮膚及骨性配準標記,都可以降低擺位誤差。體表標記線與人體骨性結構在三維空間上有相關性,商在春等[19,20]報道,添加體表標記線能有效降低擺位誤差。以往報道肺癌配準參考標記點選擇:肺尖、椎體、腫瘤、氣管、胸骨、隆突等[21-27]。同樣位于縱膈的食管癌調強放療,圖像配準時參考標記點多選擇椎體和食管相結合的方式[28,29]。彭應林等[30,31]研究表明肺癌配準框建議為患肺、胸骨、椎體為配準框范圍對日常擺位誤差有指導意義。本研究入組均為胸腺瘤切除術后患者,無實體腫瘤,靶區位置比較特殊,兩側為肺組織,前有胸骨及肋骨,后有氣管隆突,最下為胸椎,受周圍組織的生理運動影響比較小。再者配準標記點必須在影像圖像上清晰可見,并且與周圍組織存在密度差異,因此本研究選取胸骨、隆突、椎體作為配準標記點。
本研究中,圖像配準參考標記點選取胸骨、隆突以及椎體,三者的解剖位置具有一定的相關性。本研究結果表明,不同配準參考點得到的擺位誤差,在LR和AP方向三種配準標記擺位誤差無明顯差別,差異無統計學意義(P>0.05),因為縱膈生理運動比較小,而CBCT圖像獲取時間較長,圖像顯示信息為包括了呼吸運動的平均影像。無論何種配準標記CC方向均大于LR和AP個方向,90%的偏差范圍均<3 mm,這與很多胸腹腫瘤擺位誤差研究結果相似,因為胸、腹組織的生理運動為CC方向大,LR和AP方向受胸壁和腹部肌肉的限制運動范圍小。隆突在CC方向配準擺位誤差大于胸骨和胸椎的,對此現象Shirato等[32]做過氣管隆突隨呼吸運動幅度報道。3種參考標記配準結果差異無統計學意義,筆者建議在胸腺瘤術后放療圖像配準時選擇灰度配準,在結合三種配準標記點和人工調整,綜合方式進行配準。
3種配準方式分別計算出本單位胸腺瘤術后放療靶區CTV-PTV外擴范圍:胸骨(3.32 mm、3.54 mm、3.47 mm),隆突(3.43 mm、4.38 mm、3.67 mm),椎體(3.26 mm、3.36 mm、3.45 mm)。在左右、頭腳、前后3個方向上分別選取最大外擴值(3.43 mm、4.38 mm、3.67 mm),該外擴值涵蓋了所有擺位誤差,因此筆者推薦其作為胸腺瘤放療靶區CTV-PTV外擴范圍。研究中發現1例患者頭腳方向擺位誤差>5 mm,此患者行動不方便,仰臥后呼吸幅度大,擺位重復性差。且3種方法的配準結果顯示頭腳方向擺位誤差>5 mm。

