Hippo信號通路核心蛋白YAP在小鼠卵母細胞減數(shù)分裂中的作用
崔秋盈,馬雪山,姚桂東,路新樂,畢鋇鋇,胡琳莉
(鄭州大學(xué)第一附屬醫(yī)院生殖醫(yī)學(xué)中心,鄭州 450052)
正確的減數(shù)分裂是產(chǎn)生高質(zhì)量卵母細胞的前提。哺乳動物的卵母細胞受精前的減數(shù)分裂過程可大致分為4個時期,即生發(fā)泡(GV)期、生發(fā)泡破裂(GVBD)期、第一次減數(shù)分裂期、第二次減數(shù)分裂期。最終,發(fā)育到第二次減數(shù)分裂中期的卵母細胞等待受精[1-2]。
Hippo信號通路作用廣泛[3],其核心蛋白YAP蛋白在卵巢顆粒細胞的增殖[4]、卵泡的發(fā)育[5-6]以及早期胚胎生長分化的過程中發(fā)揮著重要的調(diào)控作用[7-8]。有研究表明YAP蛋白在排卵前卵母細胞中定位于細胞質(zhì),卵母細胞受精后部分YAP蛋白進入胞核參與調(diào)控胚胎干細胞的分化[9]。然而,YAP蛋白是否參與調(diào)控卵母細胞的減數(shù)分裂過程,目前仍未見相關(guān)研究報道。本研究通過在體外成熟的小鼠卵母細胞的培養(yǎng)液中加入藥物干擾YAP蛋白的活性來探究YAP蛋白在小鼠卵母細胞減數(shù)分裂過程中的作用。Verteporfin是一種小分子化合物,它可以抑制YAP蛋白與其轉(zhuǎn)錄共激活因子TEAD的結(jié)合,從而抑制YAP蛋白的轉(zhuǎn)錄調(diào)控作用,本實驗將其用作YAP蛋白的抑制劑[10]。XMU-MP-1是MST1/2激酶的抑制劑,XMU-MP-1通過阻斷MST1/2對LATS1/2的磷酸化,進而抑制LATS1/2對YAP的磷酸化,使得YAP蛋白的轉(zhuǎn)錄調(diào)控活性增強,本實驗將其用作YAP蛋白的激活劑[11]。
材料與方法
一、實驗動物
SPF級5周齡的雌性昆明小鼠,體質(zhì)量25 g,購自鄭州大學(xué)實驗動物繁育中心[實驗動物許可證號:SCXK(豫)2021-0009]。小鼠飼養(yǎng)在人工控制的環(huán)境中(室溫22~25℃,濕度40%~60%,光照12 h/d),自由攝取食物和飲水。小鼠購回后飼養(yǎng)2~3 d,待其適應(yīng)環(huán)境后使用。
二、主要實驗試劑及儀器
M2培養(yǎng)液(M7167,sigma,美國),礦物油(M8410,sigma,美國),米力農(nóng)(M4659,sigma,美國),Verteporfin(T3112,上海陶素),XMU-MP-1(T4212,上海陶素),兔抗Anti-Yap抗體(14074S,CST,美國),F(xiàn)ITC標記小鼠抗a-tubulin抗體(T6074,sigma,美國),F(xiàn)ITC標記兔抗Phalloidin抗體(23127,AAT bioquest,美國),Atto488山羊抗兔二抗(18772,sigma,美國),DAPI溶液(G8190,北京索萊寶),羊毛脂(8006-54-0,西安晉湘),SuperScriptTMⅢ CellsDirect cDNA Synthesis System反轉(zhuǎn)錄試劑盒(Invitrogen,美國),SYBRPremix EX TaqTMqPCR檢測試劑盒(TAKARA,日本),光學(xué)顯微鏡(Nikon,日本),共聚焦顯微鏡(Zeiss,美國),qPCR儀(Roche,美國)。
三、研究方法
1.GV期卵母細胞的獲取:斷頸處死60只雌性小鼠,開腹剝離出卵巢至培養(yǎng)皿上,加入少量預(yù)熱的M2培養(yǎng)液沖洗掉血漬,挑出卵巢于干燥的培養(yǎng)皿上,用小刀剁碎卵巢使卵母細胞充分釋放,加入預(yù)熱的含有2.5 μmol/L米力農(nóng)的M2培養(yǎng)液,用移液槍輕柔吹打均勻,將培養(yǎng)皿移至體視鏡下,調(diào)節(jié)焦距至清晰看到卵母細胞,用口吸管吸取并清洗卵母細胞,移至含有2.5 μmol/L米力農(nóng)的M2液滴中備用。
2.實驗分組及卵母細胞體外成熟:將卵母細胞在預(yù)熱的不含米力農(nóng)的M2液滴中清洗3遍,挑選透亮、大小適中、核位于中心的60枚GV期卵母細胞,隨機等分為3組(20枚/組),分別為激動劑組、抑制劑組和對照組。激動劑組移到預(yù)熱的含有6 μmol/L XMU-MP-1的M2液滴中;抑制劑組移到預(yù)熱的含有1 μmol/L Verteporfin的M2液滴中:對照組移到預(yù)熱的含有等體積溶劑DMSO的M2液滴中。每個液滴中放置20枚卵母細胞,液滴上方覆蓋石蠟油,于37℃、5%CO2的通氣培養(yǎng)箱培養(yǎng),培養(yǎng)期間不需要換液,培養(yǎng)12 h 以上。每組實驗重復(fù)3次。
3.不同濃度XMU-MP-1對體外培養(yǎng)小鼠卵母細胞的作用:將卵母細胞在預(yù)熱的不含米力農(nóng)的M2液滴中清洗3遍,挑選透亮、大小適中、核位于中心的80枚GV期卵母細胞,隨機等分為4組(20枚/組),分別移入含有0、3、6、9 μmol/L XMU-MP-1的M2液滴中,每個液滴中放置20枚卵母細胞,液滴上方覆蓋石蠟油,于37℃、5%CO2的通氣培養(yǎng)箱培養(yǎng),培養(yǎng)期間不需要換液,培養(yǎng)12 h 以上。每組實驗重復(fù)3次。
4.RT-qPCR檢測:將卵母細胞在預(yù)熱的不含米力農(nóng)的M2液滴中清洗3遍,挑選透亮、大小適中、核位于中心的240枚GV期卵母細胞,隨機等分為4組(60枚/組),分別在不含米力農(nóng)的M2液滴中體外培養(yǎng)0、4、8、12 h,在PBS中清洗3遍后,每組平均分3份吹入潔凈離心管中(20枚/份,每組3只離心管),盡量少帶液體,-80℃冰箱冷凍過夜。取出后稍微化凍,離心2 min,使得卵母細胞透明帶破裂,內(nèi)容物充分流出。根據(jù)目的基因分別設(shè)計合成引物,引物序列見表1。根據(jù)SuperScriptTMⅢ CellsDirect cDNA Synthesis System試劑盒說明書操作提取合成cDNA。利用1.5%瓊脂糖凝膠電泳檢測反轉(zhuǎn)錄效果以及引物的特異性。目的基因的qPCR檢測按照試劑盒SYBRPremix EX TaqTM說明書操作,反應(yīng)體系20 μl包括10 μl 2×SYBR Premix Ex Taq,上游和下游引物各0.4 μl,50×ROX Reference Dye 0.4 μl,cDNA模板2 μl以及dH2O 6.8 μl。按照“95℃變性5 s,60℃退火15 s,72℃延伸5 s”的反應(yīng)條件進行50個循環(huán),反應(yīng)結(jié)束后核對Real Time PCR的擴增曲線和溶解曲線,以Gapdh為內(nèi)參基因進行實驗結(jié)果的分析,實驗重復(fù)3次。

表1 引物序列
5.免疫熒光染色:選取體外培養(yǎng)形態(tài)較好的卵母細胞,在PBS溶液中清洗3遍后置于4%的多聚甲醛液滴中,放入濕盒內(nèi)室溫固定30 min。置于0.5%的Triton X-100液滴中在濕盒內(nèi)室溫透膜20 min,然后置于1% BSA液滴中室溫封閉1 h。對YAP蛋白染色時將卵母細胞置于用1% BSA稀釋的一抗(兔抗Anti-YAP,1∶100稀釋)液滴中,保存于4℃冰箱內(nèi)過夜。用1%的BSA溶液清洗3次,每次5 min,避光條件下置于用1%的BSA稀釋的Atto488山羊抗兔二抗(1∶200稀釋)液滴中室溫孵育1 h,然后用1%的BSA溶液清洗3次,每次5 min,避光條件下加入用1%的BSA稀釋的DAPI液滴(1∶1 000稀釋)中室溫作用15 min以上,然后用1%的BSA清洗3次,每次5 min,同時用不加一抗的卵母細胞作為陰性對照;對紡錘體結(jié)構(gòu)染色時將卵母細胞置于用1% BSA稀釋的a-tubulin抗體(FITC標記小鼠抗a-tubulin,1∶100稀釋)液滴中,在室溫下作用1 h后用1%的BSA清洗3次,每次5 min;對微絲帽結(jié)構(gòu)染色時將卵母細胞置于用1% BSA稀釋的Phalloidin抗體(FITC標記兔抗Phalloidin,1∶1 000稀釋)液滴中,在室溫下作用90 min后用1%的BSA清洗3次,每次5 min。槍頭于載玻片上點一滴抗淬滅劑[0.4 g三乙烯二胺、2 ml 0.2 mol/L Tris-HCl(pH 7.4)和18 ml甘油混合配制而成],用實心針稍微涂開,在顯微鏡視野下用口吸管把卵母細胞移入液滴,然后用實心針分散卵母細,最后封片(載玻片四個角均勻涂抹羊毛脂,可適量加厚,避免將卵母細胞壓破)。每組每個時期取不同樣本重復(fù)實驗3次。
6.圖片采集和處理:用共聚焦顯微鏡(LSM 510Meta,Zeiss,德國)采集圖片,圖像收集軟件為LSM Image Examiner。采集圖像用20×的物鏡,掃描模式為線型。藍色熒光用波長為405 nm的激光激發(fā),綠色熒光用波長為488 nm的激光激發(fā),紅色熒光用波長為647 nm的激光激發(fā)。圖片像素統(tǒng)一為1 042×1 042 pixels。
四、統(tǒng)計學(xué)分析
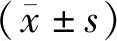
結(jié) 果
一、減數(shù)分裂各個時期小鼠卵母細胞內(nèi)Yap1、Lats1和Tead1的mRNA表達水平以及YAP蛋白的定位
Yap1 mRNA在減數(shù)分裂的各個時期都有表達并且表達水平逐漸上升,Yap1的上游基因Lats1 mRNA在GV、GVBD、MⅠ期表達量偏低,到了MⅡ期表達量顯著增高(P<0.05),而Yap1的下游基因Tead1 mRNA在GV期和GVBD期沒有表達,到MⅠ、MⅡ期才逐漸開始表達(圖1A)。YAP蛋白在GV期定位于細胞質(zhì)內(nèi),細胞核中沒有YAP蛋白的分布。在隨后的GVBD、MⅠ和MⅡ期中,卵母細胞核膜崩解,細胞核結(jié)構(gòu)消失,YAP蛋白均勻地分布在卵母細胞胞質(zhì)中(圖1B)。

A:RT-qPCR檢測Yap1、Lats1和Tead1 mRNA相對表達水平;B:免疫熒光檢測YAP蛋白的定位:綠色代表YAP蛋白,藍色代表DAPI;與GVBD組比較,*P<0.05;與GV組比較,#P<0.05。圖1 小鼠卵母細胞減數(shù)分裂各個時期Yap1、Lats1和Tead1 mRNA表達水平以及YAP蛋白的定位
二、各組小鼠卵母細胞的生發(fā)泡破裂率和第一極體排出率
體外培養(yǎng)4 h后,3組的卵母細胞均正常發(fā)育到GVBD階段;體外培養(yǎng)12 h后,顯微鏡下可觀察到抑制劑組和對照組卵母細胞均排出第一極體,而激動劑組卵母細胞沒有排出第一極體(圖2A)。各組體外培養(yǎng)4 h后生發(fā)泡破裂率的比較如圖2B所示;體外培養(yǎng)12 h后各組第一極體排出率比較如圖2C所示:抑制劑組與對照組比較第一極體排出率相近,而激動劑組與對照組比較第一極體排出率顯著下降(P<0.05)。并且隨著XMU-MP-1濃度的增加,卵母細胞第一極體排出率逐漸下降(圖2D)。

A:鏡下觀察各組第一極體排出情況;B:各組生發(fā)泡破裂率比較;C:各組第一極體排出率比較:與對照組比較,*P<0.05;D:不同濃度XMU-MP-1下卵母細胞第一極體排出率:與3 μmol/L XMU-MP-1比較,#P<0.05;與6 μmol/L XMU-MP-1比較,*P<0.05。圖2 各組小鼠卵母細胞的生發(fā)泡破裂和第一極體排出情況
三、激動劑組和對照組小鼠卵母細胞減數(shù)分裂各個時期YAP蛋白的定位比較
米力農(nóng)是一種磷酸二酯酶(PDE)抑制劑,可以抑制卵母細胞生發(fā)泡破裂從而使其停留在GV階段。我們在激動劑組和對照組的培養(yǎng)液中均加入濃度為2.5 μmol/L的米力農(nóng),一起放入培養(yǎng)箱中培養(yǎng)12 h后檢測YAP蛋白的定位,激動劑組YAP蛋白和對照組一樣停留在胞質(zhì)中(圖3A)。隨后,我們分別在不添加米力農(nóng)的激動劑組和對照組中取體外培養(yǎng)4、8、12 h的小鼠卵母細胞樣本檢測YAP蛋白的定位,發(fā)現(xiàn)雖然激動劑組與對照組相比,YAP蛋白熒光強度有所增加,但其在細胞中的定位沒有明顯的變化,仍然均勻地分布在細胞質(zhì)中(圖3B、C、D)。

A:添加米力農(nóng)的激動劑組和對照組培養(yǎng)12 h后(GV期)YAP蛋白定位;B、C、D:不添加米力農(nóng)的激動劑組和對照組分別培養(yǎng)4、8、12 h后YAP蛋白定位(分別對應(yīng)GVBD期、第一次減數(shù)分裂中期及第二次減數(shù)分裂中期)。綠色代表YAP蛋白,藍色代表DAPI。圖3 激動劑組和對照組小鼠卵母細胞減數(shù)分裂各個時期YAP的定位
四、激動劑組和對照組小鼠卵母細胞內(nèi)的紡錘體和微絲帽結(jié)構(gòu)
小鼠卵母細胞體外培養(yǎng)9 h后,對照組形成正常的紡錘體結(jié)構(gòu),并且紡錘體位于卵母細胞皮質(zhì)和中心之間。激動劑組染色體排列雜亂,紡錘體長度縮短,并且距卵母細胞皮質(zhì)的距離較遠(圖4A)。體外培養(yǎng)12 h后,對照組卵母細胞正常排出第一極體,而激動劑組卵母細胞同源染色體無法分離,紡錘體未能正常遷移,且沒有第一極體排出(圖4B)。進一步對體外培養(yǎng)9 h的小鼠卵母細胞微絲帽結(jié)構(gòu)染色,結(jié)果顯示在第一次減數(shù)分裂中后期,對照組靠近紡錘體處細胞膜上有微絲帽結(jié)構(gòu),而在激動劑組沒有觀察到微絲帽結(jié)構(gòu)(圖4C)。

A:體外培養(yǎng)9 h小鼠卵母細胞的紡錘體結(jié)構(gòu);B:體外培養(yǎng)12 h小鼠卵母細胞的紡錘體結(jié)構(gòu);C:體外培養(yǎng)9 h小鼠卵母細胞的微絲帽結(jié)構(gòu)。綠色代表tublin,紅色代表actin,藍色代表DAPI。圖4 激動劑組和對照組小鼠卵母細胞內(nèi)的紡錘體和微絲帽結(jié)構(gòu)
討 論
本研究通過在體外培養(yǎng)的小鼠卵母細胞的培養(yǎng)液內(nèi)添加藥物改變YAP蛋白的活性,發(fā)現(xiàn)抑制YAP蛋白不影響減數(shù)分裂的進程,而激活YAP蛋白會導(dǎo)致卵母細胞第一極體排出受阻。免疫熒光染色結(jié)果顯示這一部分卵母細胞在第一次減數(shù)分裂中期紡錘體結(jié)構(gòu)異常,同源染色體無法分離,同時卵母細胞膜上未形成正常的微絲帽結(jié)構(gòu)。提示當卵母細胞中YAP蛋白的活性增強會破壞紡錘體結(jié)構(gòu)和遷移,使得減數(shù)分裂過程不能完成從中期到后期的轉(zhuǎn)變。
卵母細胞反復(fù)成熟障礙會導(dǎo)致原發(fā)性不孕,常規(guī)的輔助生育技術(shù)很難從根本上解決這一問題,大多數(shù)的患者只能通過供卵的方式助孕[12-13]。臨床上,經(jīng)促排卵治療后約有8.6%~15.2%的不孕患者產(chǎn)生1個或1個以上不成熟的卵母細胞,當不成熟的卵母細胞比例達到25%時,臨床妊娠率明顯降低[14-15]。卵母細胞發(fā)育受阻會影響卵母細胞的受精能力以及胚胎生長發(fā)育潛能[16],導(dǎo)致不孕、早期流產(chǎn)以及后代染色體疾病等后果,影響人類的生殖健康。既往研究表明Hippo信號通路在卵泡生長和早期胚胎發(fā)育中發(fā)揮了重要的調(diào)控作用。卵泡的生長過程中,卵母細分泌的Gdf9和Bmp15通過激活顆粒細胞中的Smad2/3信號通路,進而抑制Hippo信號通路,使得YAP蛋白得以活化,活化的YAP蛋白促進了顆粒細胞的增殖[4]。在卵母細胞受精后的合子期和早期胚胎發(fā)育過程中,活躍的YAP蛋白在胞核中發(fā)揮了至關(guān)重要的轉(zhuǎn)錄調(diào)控作用,不僅參與了細胞分化,還調(diào)控了細胞多能性的表達和細胞凋亡等多種生理過程[8,17]。排卵后的卵母細胞必須經(jīng)歷減數(shù)分裂才能獲得受精能力,在這個過程中關(guān)于YAP蛋白的作用未見相關(guān)研究報道。本研究發(fā)現(xiàn),激活YAP蛋白后卵母細胞的紡錘體結(jié)構(gòu)和遷移被破壞,第一極體無法排出,減數(shù)分裂進程被阻滯在第一次減數(shù)分裂中期,而抑制YAP蛋白活性不會阻礙減數(shù)分裂進程。這提示,在卵母細胞減數(shù)分裂過程中YAP蛋白以失活的磷酸化形式存在,到卵母細胞受精后YAP蛋白才去磷酸化進入細胞核中發(fā)揮作用。
為什么在有絲分裂中起促進作用的YAP在減數(shù)分裂中卻是有害的?首先,我們推論可能是由于調(diào)節(jié)紡錘體組裝的蛋白SAC(the spindle assembly checkpoint)在有絲分裂和減數(shù)分裂中的活性差異導(dǎo)致的。SAC通過檢查微管和染色體之間的連接,使得連接異常的染色體不能分離,從而確保后期染色體的正確分離。SAC的作用在有絲分裂中非常嚴格,即使是一條染色體沒有正確連接也能觸發(fā)其活性,這種嚴格的作用確保了體細胞的正確分裂[18]。然而SAC在哺乳動物卵母細胞中的有效性較低,導(dǎo)致染色體分離容易出錯[19-20],從而引發(fā)早期流產(chǎn)和染色體疾病。研究發(fā)現(xiàn)當小鼠卵母細胞中的SAC被持續(xù)激活時,減數(shù)分裂會被阻滯在MⅠ處[21]。SAC的表達受Hippo信號通路調(diào)控,激活YAP蛋白會增強SAC的活性[22]。由此猜想,卵母細胞發(fā)育過程中抑制YAP的活性可能是為了保持SAC的低活躍狀態(tài),以防止卵母細胞發(fā)生MⅠ期阻滯。
另外,與有絲分裂不同,卵母細胞的減數(shù)分裂不是一個連續(xù)的過程,其中包含兩次生理性的阻滯。在人類中,第1次阻滯是在胎兒時期時,卵母細胞被阻滯在第一次減數(shù)分裂前期的雙線期;第2次是在性成熟后,卵母細胞被阻滯在第二次減數(shù)分裂中期等待受精[23]。已有不少研究證實,有絲分裂中YAP蛋白對細胞周期有促進作用[24-25]。因此,卵母細胞發(fā)育過程中抑制YAP蛋白的活性可能是為了防止其對減數(shù)分裂周期的干擾。
在我們的研究中,RT-qPCR結(jié)果顯示,Hippo信號通路中的Yap1及其上游的Lats1和下游的Tead1 mRNA水平在MⅡ期表達均達到最高,推測有可能是為了受精之后活躍的有絲分裂做準備,活躍的YAP蛋白對早期胚胎越過母型合子型轉(zhuǎn)換(maternal-zygotic transition,MZT)時期的發(fā)育阻滯以及隨后囊胚滋養(yǎng)外胚層的建立是必不可少的[7,9]。
但我們的研究也存在一些局限性,首先,活化的YAP蛋白看似不影響GVBD的發(fā)生,但是我們沒有對細胞內(nèi)具體染色體復(fù)制和排列情況作進一步研究。另外,我們所用的激活劑和抑制劑改變了YAP蛋白的活性,但是具體情況還需要蛋白實驗來證實。最后,我們用鼠卵在體外的培養(yǎng)箱內(nèi)發(fā)育成熟,但體外操作可能對卵母細胞有未知的干擾,不能完全代表其在體內(nèi)環(huán)境中的發(fā)育情況,并且鼠卵和人卵之間也存在一定的差異。
綜上所述,體外培養(yǎng)的小鼠卵母細胞中的YAP蛋白活性增強會影響紡錘體的結(jié)構(gòu)和遷移,使得卵母細胞發(fā)育阻滯在第一次減數(shù)分裂中期,無法正常受精。我們的研究為卵母細胞成熟障礙的治療提供了新的思路。

