面向雙碳戰略的CO2轉化和利用研究進展概述
吳愛青
(山東省濟寧市任城區委黨校 山東濟寧 272000)
我國近期提出了于2060 年實現碳中和的目標,為確保充足的能源供給和減少碳排放,發展CO2綜合利用技術具有重要的實際意義。CO2廣泛存在于自然界中,是一種潛在的資源,盡管隨著工業革命,CO2飽受詬病。但是CO2同時也是一種優質的原料。CO2是一種主要的長壽命溫室氣體,大約占到所有溫室氣體的26%。
自從18 世紀下半葉起源于英國的工業革命開始以來,人類生產經營活動對化石燃料的使用量不斷增加,以致大氣中的CO2分子濃度快速升高。持續上升的CO2濃度使地球上的溫室效應異常加重,全球氣候總體上來看有持續變暖的趨勢,人類活動對自然界氣象變化的影響很快超過了火山噴發和太陽活動等自然現象所帶來的影響。
近年來,由于人類對不可再生資源的大規模開采和使用,大氣中的CO2分子濃度不斷增加。根據世界氣象組織于2020 年初發布的最新溫室氣體公報,CO2的含量已經從工業化前的280 ppm 上升到2019 年底的411 ppm,増加了約47%。
不僅如此,根據美國國家海洋與大氣管理局公布的最新年度溫室氣體指數,從20 世紀70 年代末到2019 年,全球大氣中CO2分子的濃度平均每年增加1.83 ppm,而在21 世紀20 年代的這10 年里,大氣中CO2分子的濃度更是以每年2.3 ppm 的速度增長。也就是說,不僅大氣中CO2的濃度沒有下降的趨勢,CO2濃度的増速也沒有放緩的跡象。如果維持目前的排放量,統計工作者預計到2030 年全球CO2排放量仍然不會達到峰值,有繼續增加的可能[1]。
大氣中不斷上升的CO2濃度將引發嚴峻的環境問題[2]。CO2濃度攀升,最直接的影響是溫室效應加重,很多極端氣象災害,如颶風、洪澇和干旱等發生的頻率更快,使地表下墊面遭到破壞。生態系統對此變化發生響應,會縮短水循環周期,從而加劇洪澇、干早等災害。在這種情況下,生態系統很難自然適應或演變,從而減少了原生態系統中的生物多樣性。不僅如此,隨著溫室效應的逐步加重,全球溫度攀升,使冰川和極地冰塊溶解,再加上海水受熱之后膨脹,都將造成海平面升高。
為了應對海平面上升可能帶來的危害和風險,人們需要建設大量海岸保護工程。而這些工程將破壞先前的海岸帶濕地與沿岸沼澤地區的自然演化,使海洋和生態系統不斷退化,從而使自然災害造成的損失更大。因此降低大氣中CO2的濃度,從而緩解溫室效應和由此帶來的其他環境問題已經成為人類面臨的共同任務。
為了減少大氣中CO2分子的濃度,并進一步有效解決目前的資源緊缺問題,科研工作者從多種角度嘗試將CO2轉化為更具工業利用價值的含碳產物[3]。由于CO2分子中碳氧雙鍵的鍵長短、鍵能大,因而其化學性質非常穩定。直接將CO2分子進行活化非常困難,往往需要很高的壓強或溫度。為了使化學反應在相對溫和的環境中進行,也為了減小反應所需的外加能量,活化反應需要借助特定的媒介,也就是催化劑,來降低催化反應需用的活化能,從而提高活化過程的速率。根據催化反應原理的不同和催化反應條件的不同,常用的CO2轉化方法可以進行如下分類:光合作用[4]、酶促反應[5]、催化重整[6]、光催化反應[7]和電催化反應[8]等。光合作用和酶促反應主要是利用生物體內和生物體外的蛋白質酶在相對溫和的環境中催化CO2轉化為有機物;催化重整主要是利用CH4熱解反應器和CO2消碳反應器在催化劑的作用下將CO2轉化為合成氣;礦化作用主要是通過地表巖石中的空隙來儲存CO2,使CO2在地中經過漫長的物理化學過程形成碳酸鹽礦物,從而固定CO2光催化轉化CO2主要是利用半導體催化劑在光照下產生的高能量的激發電子來活化CO2,并通過加氫步驟使CO2還原為低價態的碳氫化合物:電催化轉化CO2主要是在外加電壓的作用下,使電子通過催化劑注入CO2分子中,并在水溶液中質子的作用下,不斷加氫最終轉變成更具工業價值的碳氫產物。
該文將對CO2的轉化與利用展開詳細論述。
2 CO2化學利用基礎
CO2化學利用主要是利用其化學性質,通過化學、光學、電學、熱催化作用,主要將其轉化成化學物質、燃料、建筑材料、聚合物以及新型材料,真正地實現了碳資源的循環使用,具體見圖1。然而中心碳原子處于最高氧化態,其自由能很小,是一個熱力學高度穩定的化合物,所以如何開發高效的催化體系,實現CO2催化轉化,需要深入探索與研究,而順利實現化學轉化這一過程中的關鍵問題是如何將中心碳原子活化。
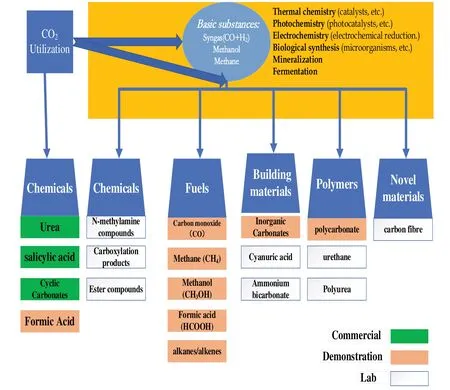
圖1 二氧化碳的化學利用技術
2.1 CO2活化與轉化的理論基礎
為了實現CO2的化學利用,首先要對CO2的結構和活化方式有充分的認識。CO2具有2 個SP 雜化軌道,每個雜化軌道各含有1/2S 和1/2P 軌道,軌道夾角180°。
CO2成鍵類型(2σg)2(2σu)2(1σg)2(1σu)2(1πu)4(1πg)4(2πu)0,其 中,(1σg)2(1σu)2(1πu)4為成鍵軌道,(2σg)2(2σu)2(1πg)4為非鍵軌道,所以CO2分子有2 個σ 鍵,2個π 鍵。CO2中的碳原子為缺電子中心,其可以作為一個親電體,并與親核試劑或者帶電子基團發生反應。
2.2 CO2的活化
CO2中的C 是最高氧化態,整個分子處于最低能量態,化學性質穩定,常見的性質具體見表1,其敘述的都是一種惰性分子。因此,要使CO2活化,需要克服熱力學壁壘,通常需要利用催化劑、高溫、高壓等條件以達到克服熱力學壁壘的要求。而最常使用的方法包括電催化/光化學活化/胺活化/Lewis 酸堿對(frustrated Lewis pairs,FLPs)活化/氮雜卡賓(Nheterocyclic carbenes,NHCs)活化以及過渡金屬活化等方法。其中,電催化及光化學活化是最為主要的方法。

表1 CO2的化學性質
接下來將對上述方法一一進行總結和評述,具體敘述如下。
2.2.1 電催化
電化學還原CO2是近年來研究的熱點,也就是利用電催化的手段將CO2還原生成高附加的化學品(例如甲醇、CO 等),這個技術可以實現將CO2轉化為易于存儲和運輸的穩定的化學能,這個過程可以定義為CO2還原的異相催化反應,其主要在電解池中進行,發生在催化材料的陰極材料表面。對溫度要求低(不需要高溫,往往室溫條件下即可發生反應)。CO2附著在電解池的陰極上,通過捕獲電子使自身活化,從而形成還原產物。
這個技術最核心的問題就是開發催化劑用來修飾電極以提高反應速率從而促使轉化效率提高。納米金屬材料是一種較好的電催化劑,因其有較高的催化表面積,含有大量的邊緣以及低配位位點,同時具有不同的催化行為,因此TiO2等納米材料受到廣泛的關注。
運用電化學合金化/脫合金,并結合酸處理的方法制備出納米多孔結構金(NP Au)的電催化劑,用于將CO2電化學還原為CO。金屬金經過處理得到的納米多孔結構材料具有電流密度大、產率高和穩定性好等優良特點,有利于電化學還原過程的進行。然而,貴金屬的高成本和低豐度制約了其在實際工作中的大規模應用,因此需要選擇儲量高并且具有高效催化作用的電催化劑來彌補這個問題。
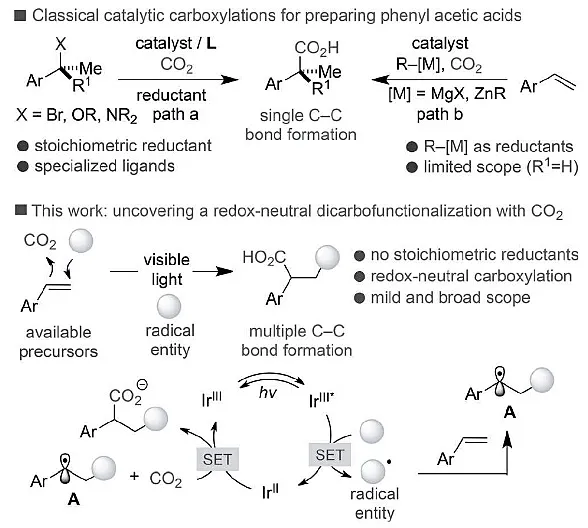
圖5 二氧化碳轉化為羧酸衍生物的機理
近年來,隨著對于納米技術在非貴金屬催化劑的制備中得到更好的應用,其逐漸展現出在CO2還原方面可以媲美貴金屬的優異性能,該技術將可能是未來的研究方向[9]。
同時,文中顯示的圖2 為電化學CO2還原的反應裝置示意圖。
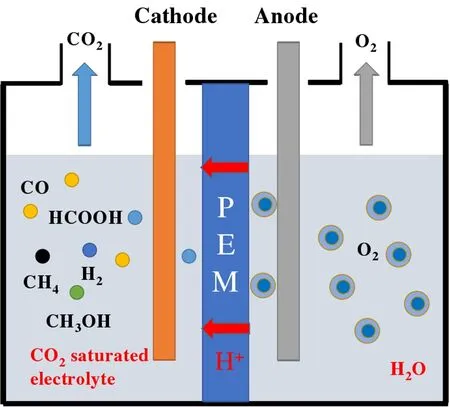
圖2 電化學CO2還原的反應裝置示意圖
2.2.2 光化學活化
因其類似于自然界中的光合作用,所以光化學還原CO2的反應,一般被認為是一種人工的光合作用。光化學催化還原CO2是氧化還原耦合的過程,入射光的能量必須等于或者大于催化劑的帶隙,以達到在光照的情況下催化劑被激發,光生電子由價帶激發到導帶。由于光生電子具有很強的還原能力,催化劑表面吸附的CO2能夠用來還原。光催化過程為:光吸收產生電子空穴對、光生載流子分離并轉移到光催化劑表面、CO2吸附以及表面氧化還原反應、產物解析。
光催化劑是光催化還原中重要的物質,它在很大程度上決定著CO2的轉化效率。目前,一半導體材料為主的催化體系是主要的研究方向,其中TiO2具有無毒、穩定性好、耐光腐蝕和催化性能好的特點,是目前應用比較廣泛的光催化材料。然而TiO2因其材料的禁帶寬度較大,只能在紫外線輻射下才能被激活,所以光能利用率低,導致CO2的轉化率較低,因此許多學者為了提高其轉化效率從而開始對TiO2材料進行改性[10]。其中有些方法較為有效,例如:將蔗糖水熱聚合得到的碳球(CSs)固定在TiO2表面形成交聯碳材料,使其光響應區域得到明顯擴增,從而提高了TiO2的可見光吸收效率,增大了CO2轉化率。
其中,文中顯示的圖3 是光催化還原CO2原理圖。

圖3 光催化還原CO2原理圖
3 技術與實踐
現如今,隨著CO2轉化方法及相關技術的發展與精進,CO2被利用于催化轉化制備能源產品,催化轉化制備化學品,催化轉化制備高分子材料,以及礦化制備無機材料,實際生產產物及過程包括其主要轉換方式。
CO2的化學轉化方式具體情況見圖4。
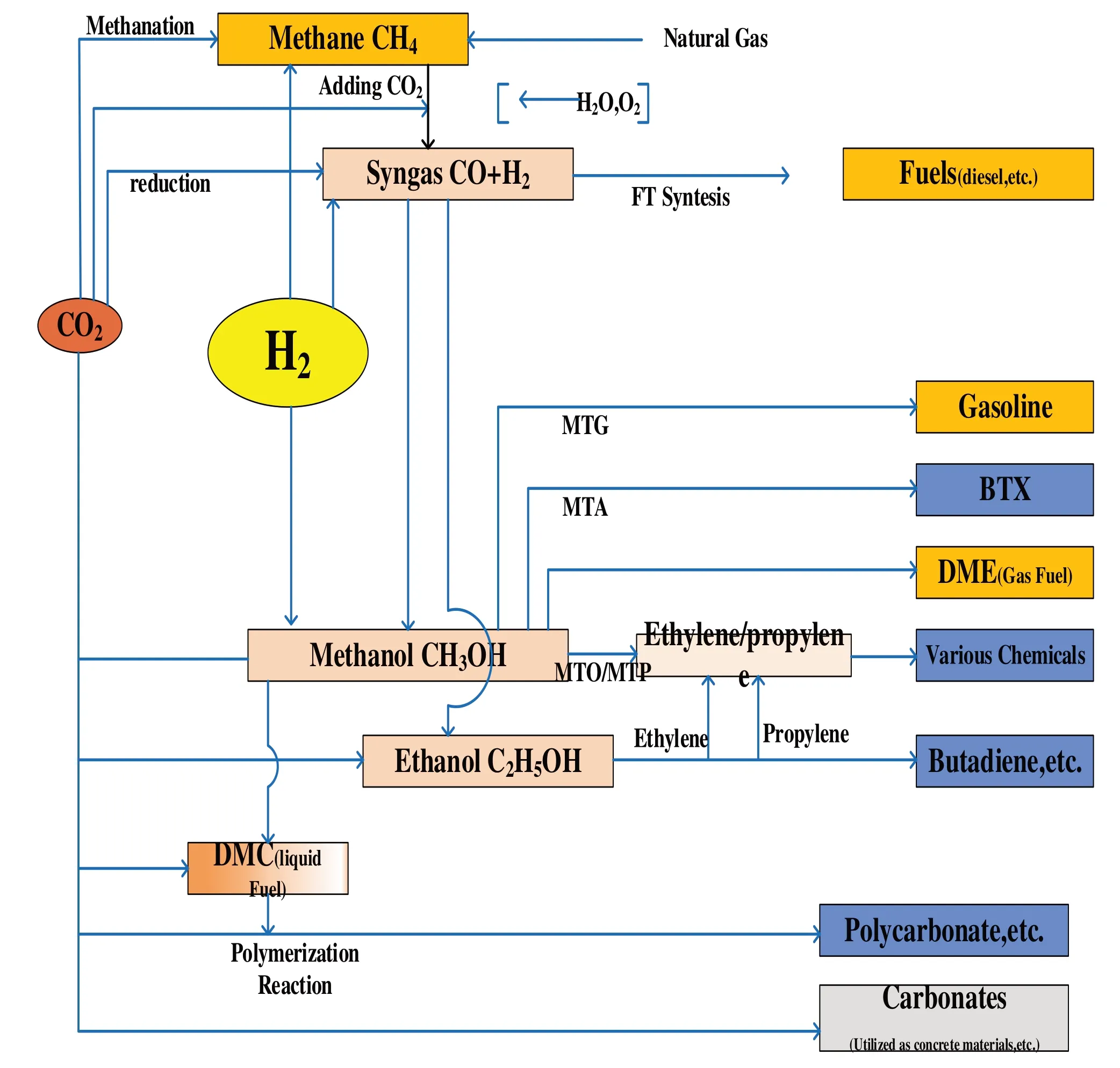
圖4 CO2的化學轉化方式
3.1 目前主要應用
3.1.1 合成尿素
目前,工業上用液相NH3和CO2反應合成尿素,屬于有氣相存在的液相反應。反應被認為分兩步進行,具體如下。

氨基甲酸銨的生成(液體)是一個體積縮小的、可逆的、反應速率較快的強放熱反應,在較短的時間內就可達到化學平衡,并且達到平衡后CO2轉化為氨基甲酸銨的百分數很高。
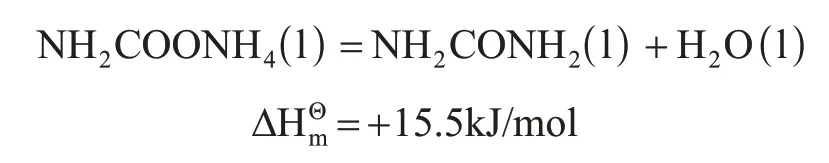
3.1.2 環狀碳酸酯
環狀碳酸酯是一種應用十分廣泛的化合物,廣泛應用于混合物的萃取分離、有機合成等領域。利用環氧化物和CO2為原料來合成環狀碳酸酯是目前已經工業化的技術,該反應進行的關鍵在于通過加入催化劑對CO2和環氧化物進行活化,從而使反應順利進行。
3.2 處于示范應用或者實驗室研究階段
3.2.1 CO2催化轉化制備能源產品
(1)CO。
CO 是一種重要的氣體工業原料,由CO 出發可以制備幾乎所有的液體燃料或基礎化學品。將CO2轉化為CO 是CO2高值利用的重要途徑,從節約資源和能源的角度考慮,是生產CO 的綠色途徑。其反應方程式如下。
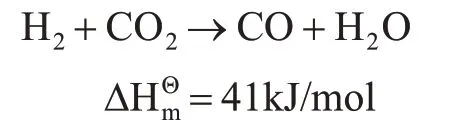
這是一個吸熱反應過程,需要較高的反應溫度。目前,催化劑普遍存在穩定性較差的問題。例如:Cu 催化劑在高溫下易燒結,氧化失活,工業應用中易發生硫中毒;Al/Zn 催化劑易高溫還原失活;Pt/Ce催化劑易積炭失活。因此,研究開發高活性和高穩定性的RWGS 反應催化劑,以高效快速制備CO,是實現RWGS 反應過程制備CO 的關鍵。
(2)CH4。
CH4是最簡單的有機化合物,也是重要的基礎化工原料。其化學反應方程式如下。
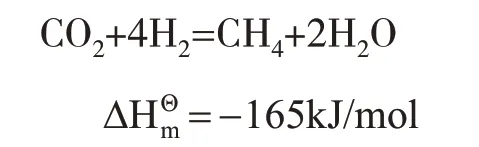
(3)甲醇。
甲醇不僅是一種重要的、需求巨大的有機化工原料,也是一種理想的清潔能源,在農業、畜牧業、石油化工、燃料電池和發電等領域均具有廣泛的應用。

要實現CO2的活化和轉化需要使用高效催化劑來降低CO2反應的活化能壘。目前,常見的CO2加氫制甲醇催化劑主要包括銅基催化劑、貴金屬負載型催化劑及其他類型催化劑。
(4)甲酸。
CO2加氫合成甲酸也是重要的反應,這個反應可以充分利用物質,甲酸也是一個非常理想的化工原料。然而,當前CO2還原制甲酸仍面臨著諸多挑戰,包括反應動力學遲緩、甲酸選擇性較低等。因此,開發經濟、穩定、高選擇性的電催化材料是實現電化學CO2還原制甲酸技術大規模應用的關鍵所在。

3.2.2 二氧化碳催化轉化制備化學品
(1)酯類化合物。
DMC 是近年來受到國內外廣泛關注的環保型綠色化工產品。

(2)N-甲胺化合物。
二甲基甲酰胺既是一種用途極廣的化工原料,也是一種用途很廣的優良溶劑。由二甲胺和CO2/H2反應合成DMF,是一條合成DMF 的綠色途徑,具有重要的實用價值。
(3)羧化產品。
以CO2為原料用于C-C 鍵形成反應,得到具有重要生物活性的羧酸衍生物。
4 結語
我國于近期提出了2060 年實現碳中和的目標,碳減排和碳中和已成為國家長期戰略。低碳發展也是我國實現生態文明重大戰略的重要組成。低碳發展目前最艱巨的任務就是減少CO2的排放。CO2作為目前最主要的溫室氣體,如何將CO2轉化為便于存儲的化學能,是當前國際前沿課題。為此,該文通過對CO2化學利用基礎以及CO2活化與轉化的理論基礎的綜述,總結了CO2的活化方式,重點分析了電催化及光化學活化的CO2轉化方式。并根據其活化方式概括其現有應用以及未來的可能應用。

