灌注加權成像影像組學對成人型彌漫性膠質瘤分子分型的預測價值
劉振 任晶晶 洪旋科 劉獻志 △
鄭州大學第一附屬醫(yī)院 1)神經(jīng)外科;2)臨床大數(shù)據(jù)中心 鄭州 450052
彌漫性膠質瘤是成人原發(fā)性腦腫瘤中最常見的類型之一,高度惡性且病死率高[1]。即使經(jīng)過手術治療及術后放化療,患者的5 a生存率依然極低[2-3]。2021年世界衛(wèi)生組織(WHO)對中樞神經(jīng)系統(tǒng)(central nervous system, CNS)腫瘤的分類中,依據(jù)異檸檬酸脫氫酶(isocitrate dehydrogenase,IDH)、1號染色體短臂和19號染色體長臂(1p/19q)的狀態(tài),將成人型彌漫性膠質瘤分為IDH野生型、IDH突變型和1p/19q非共缺失型、IDH突變和1p/19q共缺失型3個分子亞型[4]。目前已有多項研究表明,IDH突變型的膠質瘤患者比野生型擁有更長的總生存期[5-6]。然而,確定彌漫性膠質瘤生物分子標志物的狀態(tài)多需要進行侵入性手術或組織活檢[7-8]。為了便于術前風險評估及術后選取最佳的治療方案,需要一種術前能夠判斷彌漫性膠質瘤生物分子標志物狀態(tài)的無創(chuàng)方法。動態(tài)敏感性對比劑灌注加權成像(dynamic susceptibility contrast perfusion-weighted imaging,DSC-PWI)是一種較為先進的且不斷發(fā)展的成像方法,通過監(jiān)測血管中造影劑信號的強弱變化來描述腫瘤的微尺度血流和血流動力學[9]。有報道稱,灌注參數(shù)是膠質瘤分子生物標志物的潛在預測指標之一[10-13]。本研究通過DSC-PWI導出灌注參數(shù)偽彩圖,提取影像組學特征,結合機器學習算法,開發(fā)并驗證了一個預測模型,旨在通過簡單的方法提高預測成人型彌漫性膠質瘤分子亞型的能力,從而進行早期干預、改善預后。
1 資料與方法
1.1一般資料本研究經(jīng)鄭州大學第一附屬醫(yī)院倫理委員會批準(No. 2019-KY-176)。收集2013-01—2020-01我院神經(jīng)外科手術切除后經(jīng)組織病理結果證實的274例成人型彌漫性腦膠質瘤患者的臨床及影像資料。納入標準:(1)年齡≥18歲。(2)明確的IDH和1p/19q狀態(tài)。(3)可用的液體衰減反轉恢復序列(fluid attenuated inversion recovery,F(xiàn)LAIR)圖像和DSC-PWI圖像,經(jīng)1名資深神經(jīng)外科醫(yī)生和1名資深神經(jīng)影像科醫(yī)生確認,任何一幅圖像都沒有強烈的和不可修復的運動偽影。(4)術前未進行藥物治療、化療及放療。
1.2MR成像采集所有圖像均采集于術中3.0 T磁共振掃描儀(Siemens Healthcare, Germany),12通道線圈。掃描參數(shù),F(xiàn)LAIR:重復時間(time of repetition,TR)6 000 ms,回波時間(time of echo,TE) 94 ms,掃描野220 mm×193 mm,層厚5 mm。在患者進行5次無增強掃描后,通過手背靜脈以4 mL/s的速度注射0.1 mmol/kg順磁造影劑(Bayer Healthcare,Germany)。采用T2*加權梯度回波平面成像獲得DSC-PWI:TR 1 500 ms,TE 30 ms,掃描野230 mm×230 mm,層厚4 mm。
1.3圖像預處理采用后處理工作臺灌注軟件(Siemens Healthcare,Germany)對DSC-PWI圖像進行預處理,生成相應的腦血容量(cerebral blood volume,CBV)、腦血流量(cerebral blood flow,CBF)、達峰時間(time to peak,TTP)及平均通過時間(mean transit time,MTT)灌注圖。為了減少位置、層數(shù)和其他參數(shù)的誤差,在N4ITK程序(美國國立衛(wèi)生研究院的Insight工具包內獲取)上對所有影像圖像的形狀、體素及強度進行標準化處理。圖像標準化之后,以軸向FLAIR圖像為基準,采用互信息相似性度量對CBV、CBF、MTT和TTP圖像進行剛性配準,得到配準圖像rFLAIR、rCBV、rCBF、rMTT和rTTP。定義整個腫瘤區(qū)域內所有增強、未增強和壞死區(qū)域為感興趣體積(volume of interest,VOI)區(qū)域。一位研究生在采用盲法的情況下,利用ITK-SNAP軟件(3.4.0版本),在軸向rFLAIR圖像逐層地描繪腫瘤感興趣區(qū)(region of interest, ROI),得到腫瘤VOIs。隨后,另一位神經(jīng)外科主任醫(yī)生單獨復查了腫瘤ROIs。對有爭議的ROI,主任醫(yī)師與一位影像科主任醫(yī)師探討后確定標準區(qū)域。
1.4影像組學特征提取所有特征使用Pycharm軟件(2020.2.3版本)PyRadiomics工具包(能夠從醫(yī)學影像圖中提取組學特征的工具包,3.0.1版本)提取。將ROIs與對應灌注圖像相結合,提取影像組學特征。
1.5特征選擇特征選擇的過程大致可分兩部分:(1)去除冗余和不相關的特征。(2)最優(yōu)特征集的選擇。分別使用R軟件的Caret工具包(6.0-89版本)和Boruta工具包(7.0.0版本)。首先對特征集進行標準化和歸一化處理;標準化的特征在Caret包中進行去冗余,對于相關系數(shù)>0.75的特征,保留單變量預測能力較強的特征(較大的曼-惠特尼U檢驗P值)。然后利用Boruta算法對剩余的非冗余特征的重要性進行比較,逐一刪除相關性差的特征,重復這個過程,直到剔除完所有預測能力弱的特征。在評估所有的特征后,選擇預測能力最強的特征集進入預測模型。
1.6機器學習與預測模型根據(jù)選定的影像組學特征集,利用機器學習開發(fā)了一個預測模型,使用隨機森林算法[14]預測成人型彌漫性膠質瘤的分子亞型。在該算法中,設置隨機森林算法中的樹數(shù)目為500,同時將基尼指數(shù)(Gini index)作為描述各組學特征對分子亞型重要性的指標。基尼指數(shù)數(shù)值越小,說明該特征對該分型的重要性越小。影像組學預測模型的獨特邏輯回歸基于R軟件的Utiml工具包(0.1.7版本)和randomForest工具包(4.6-14版本)。
1.7統(tǒng)計分析入組病例按6∶4的比例隨機分為訓練集和驗證集。為驗證臨床信息分布的均衡性,采用χ2檢驗評估隊列中性別、WHO分級及分子分型的差異,采用Wilcoxon檢驗評估年齡分布的差異,統(tǒng)計分析均采用R軟件(R-4.0.5版本)。描述訓練集和驗證集的性能為曲線下面積(area under curve,AUC)、準確性、敏感性和特異性。
2 結果
2.1患者臨床特征文章的設計流程如圖1所示。在本研究中,根據(jù)納入標準共入組274例患者(訓練集168例和驗證集106例)。訓練集與驗證集患者之間的臨床信息分布無差異性,如表1所示:性別(P=0.3647)、年齡(P=0.5739)、WHO分級(P=0.7782)、分子亞型(P=0.9739)。
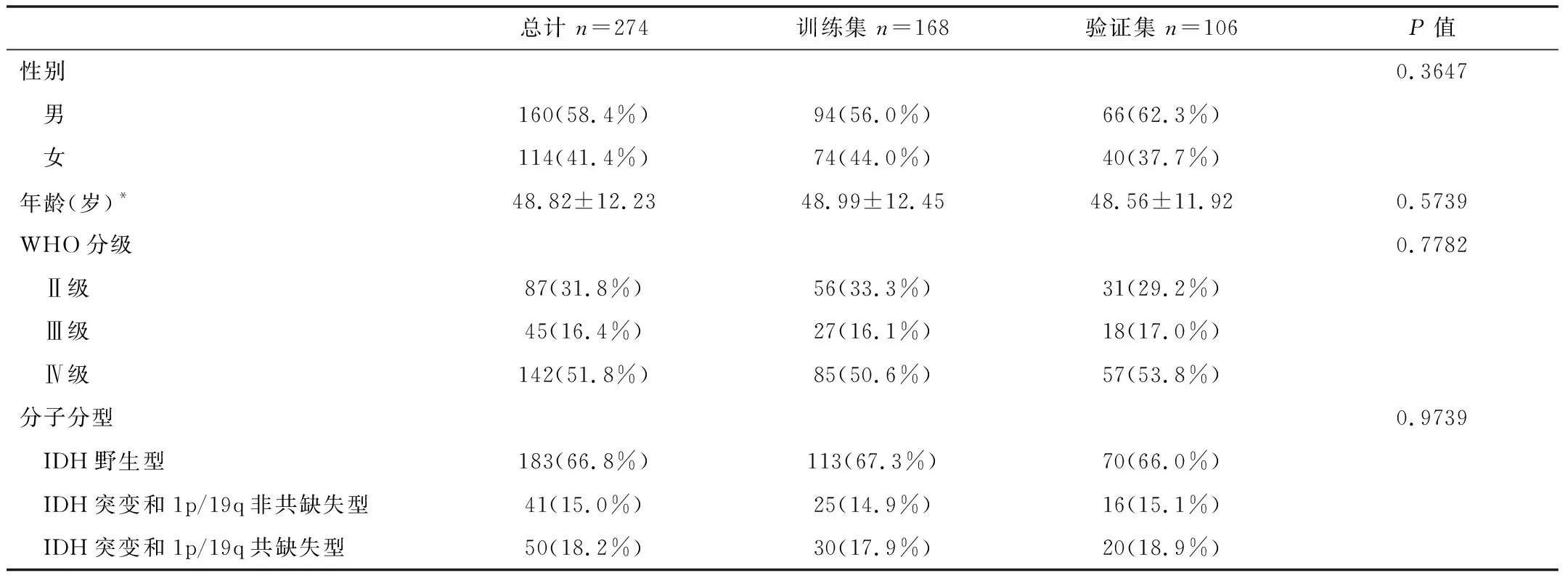
表1 入組患者臨床資料的比較
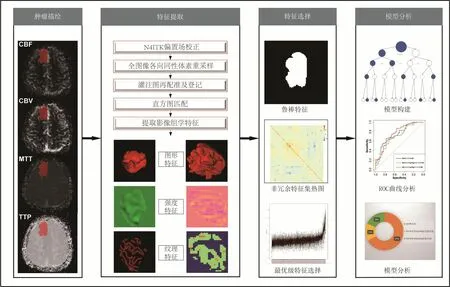
圖1 研究設計流程圖
2.2特征選擇經(jīng)特征提取后,共從4張灌注圖中獲得影像組學特征4 787個(形狀特征55個,強度特征936個,紋理特征3 796個)。其中537個特征為非冗余特征。經(jīng)過特征去冗余和特征選擇后,最終納入了13個與預測模型高度擬合的組學特征:7個紋理特征和6個強度特征,見表2。并且每個選中的特征與分子亞型的單變量關聯(lián)是顯著的(偽發(fā)現(xiàn)調整率P<0.01)。
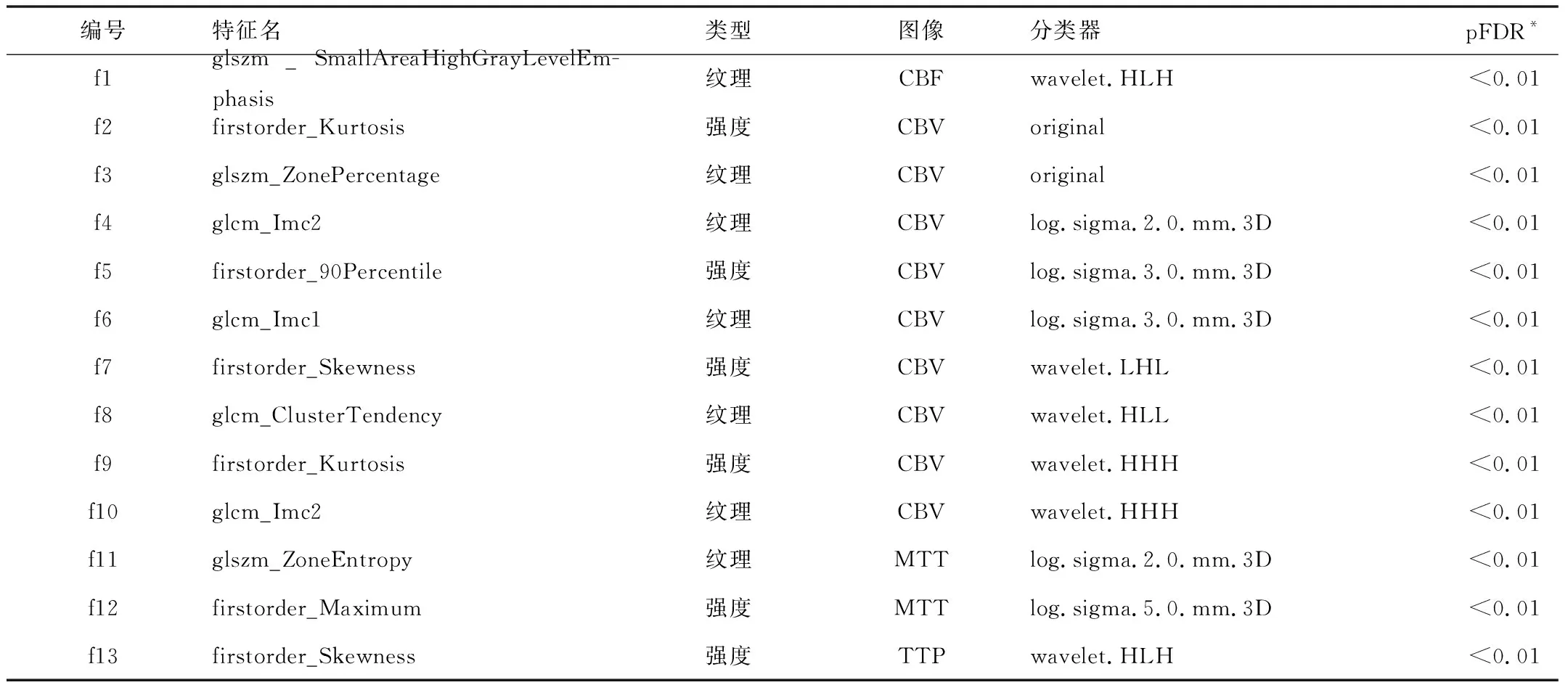
表2 預測成人型彌漫膠質瘤分子分型的13個影像組學特征
2.3分類性能基于影像學的預測模型的受試者工作特征曲線(receiver operating characteristic curve,ROC)見圖2。預測模型在驗證集中的AUC值分別為:IDH野生型,0.748;IDH突變型和1p/19q非共缺失型,0.707;IDH突變和1p/19q共缺失型,0.759。其他反映訓練集和驗證集的性能的指標,包括敏感性、準確性和特異性,見表3。
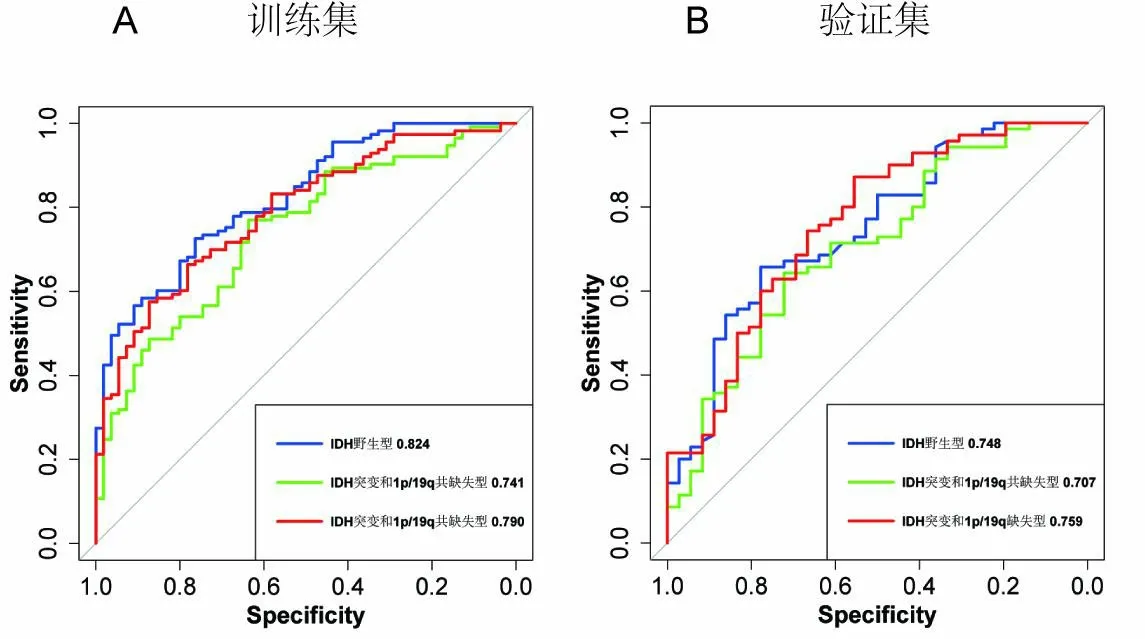
圖2 訓練集(A)和驗證集(B)的ROC曲線
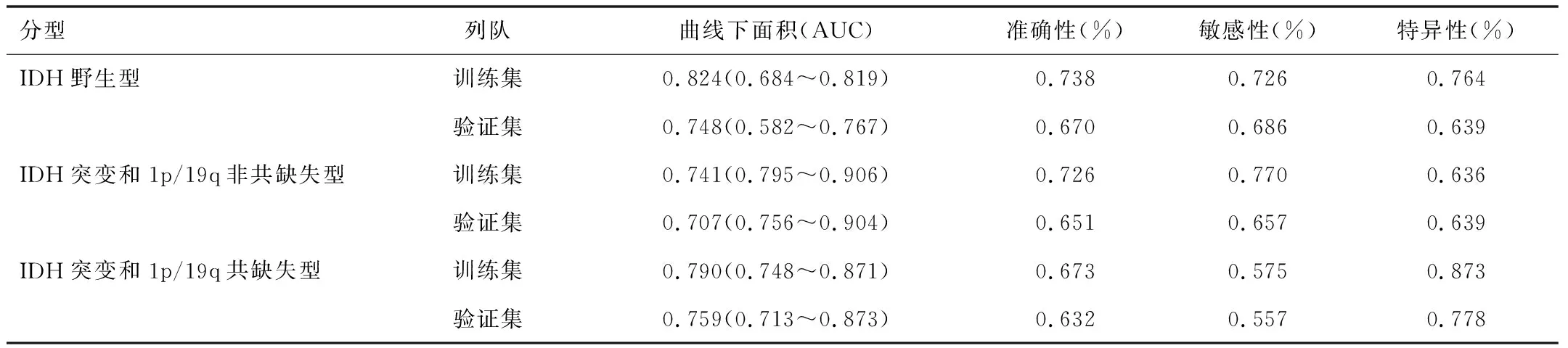
表3 影像組學模型的預測性能總結
2.4特征性能圖3顯示了13個特征對各分子分型的重要性。基尼指數(shù)作為每個特征對各個分子分型的預測貢獻測量指標,基尼系數(shù)越高,說明該特征預測該分子分型的能力越強。為了描述所選中的13個影像組學特征與分子亞型的關聯(lián)性,圖4展示了3種分子分型的典型圖像和與之相對應的同源特征圖。
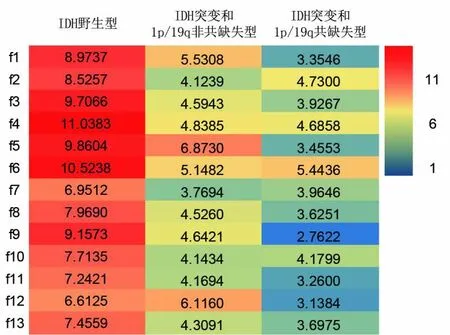
圖3 選定的13個特征與彌漫性膠質瘤分子分型之間重要性的熱圖
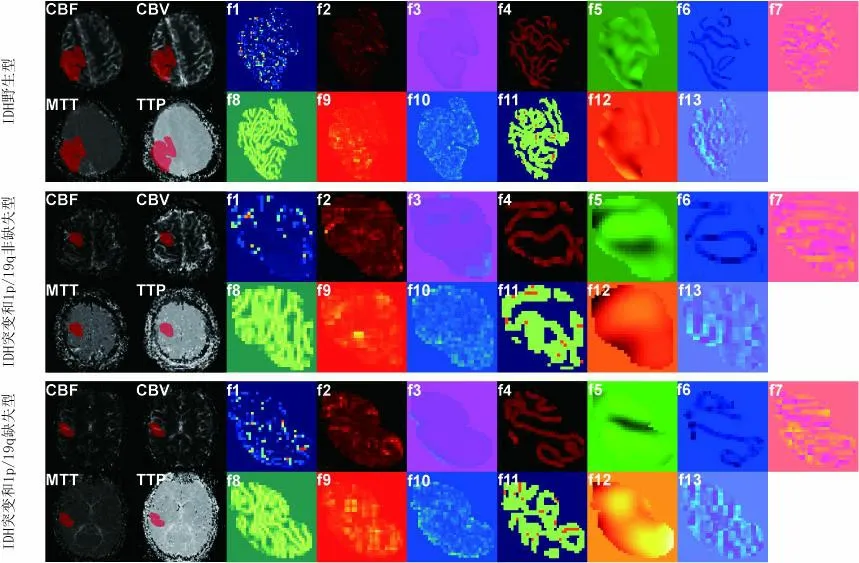
圖4 選定特征的紋理及強度圖形
DSC-PWI及相應的同源特征圖用于區(qū)別IDH野生型、IDH突變和1p/19q非共缺失型、IDH突變和1p/19q共缺失型彌漫性膠質瘤。腫瘤內部圖像模式的變化可以在特征圖中清楚地顯示,同時揭示了影像組學特征和分子亞型之間的相關性。
3 討論
本研究開發(fā)并驗證了一個依托于DSC-PWI影像組學模型,根據(jù)2021年WHO分類系統(tǒng),能夠有效地預測成人型彌漫性膠質瘤的分子亞型。與以往使用常規(guī)核磁影像的研究相比[15-16],其主要優(yōu)勢有:(1)將灌注參數(shù)中反映腫瘤微血管生理特性的CBV、CBF、MTT和TTP 4種灌注圖全部納入放射組學模型,首次較為完整地納入全部灌注參數(shù)信息,可以更準確地預測膠質瘤的分子亞型。(2)依托機器學習,從4種灌注圖中提取大量影像組學特征而非局限于原始圖像本身或相對腦血流量數(shù)值,進而提高了我們研究結果的可信度。
以往的文獻表明,利用影像組學模型預測膠質瘤分子分型具有一定的意義。例如Lu等[17]使用多參數(shù)核磁圖像影像組學對456例膠質瘤的亞型進行分類,獲得了80%~91.7%的準確率。與常規(guī)核磁圖像相比,灌注加權成像在檢查腫瘤與腦組織血管網(wǎng)絡的關系上存在著明顯的優(yōu)勢。
大量研究表明,彌漫性膠質瘤在不同分子亞型中表現(xiàn)出不同的血管系統(tǒng)和代謝模式[18-19]。IDH野生型膠質瘤患者的相對腦血容量(CBV)較突變型顯著升高[10,20];而在IDH突變型膠質瘤中,1p/19q非共缺失型膠質瘤患者的腦血容量較共缺失型則降低[21]。而彌漫性膠質瘤在腫瘤初生長時就開始聚集大量微血管網(wǎng)絡,更進一步說明血流灌注與彌漫性膠質瘤密切相關。由上不難發(fā)現(xiàn),灌注參數(shù)在預測膠質瘤分子生物標志物中擁有巨大潛力[10,12,20-22]。以往的研究主要是通過CBV的半定量分析或直方圖分析進行單個基因的預測,無法納入完整的灌注圖像信息。本研究根據(jù)2021年WHO的分類,通過整合4個灌注參數(shù)圖,利用機器學習提取特征后開發(fā)并驗證了1個影像組學模型來預測成人型彌漫性膠質瘤的分子分型,并取得了預期的效果。
本研究模型對IDH野生型膠質瘤的預測結果準確性較高,其原因為IDH野生型膠質瘤的血管系統(tǒng)與突變型在分子上有所區(qū)別,導致了IDH野生型膠質瘤具有不同的血管生成譜[18]。值得注意的是,表2顯示大多數(shù)特征都是CBV派生的,圖3中對應的Gini指數(shù)值也偏高。這一結果可能與CBV間接反映了腫瘤內血管新生程度有關[19]。同時,提取自CBF、MTT和TTP的特征也有助于影像組學模型的預測。圖3中可見CBF衍生的f1紋理特征在區(qū)別IDH野生型膠質瘤和IDH突變型方面具有優(yōu)越的意義。Yamashita等[13]的研究表明,與突變型患者比較,IDH野生型患者的CBF顯著增加。盡管如此,生物學原理仍需進一步研究闡明,以支持我們的發(fā)現(xiàn)。之前的一項研究發(fā)現(xiàn),量化局部圖像模式和全腫瘤體積內信號強度不均勻性的紋理特征是預測IDH和1p/19q狀態(tài)最有用的生物標志物[17]。已驗證了我們模型的發(fā)現(xiàn),13個放射組學特征中有7個是紋理特征。
本研究仍存在一定的局限性:(1)是回顧性的單機構研究設計,需要更多的多中心數(shù)據(jù)集來進一步獨立檢驗模型。(2)對于標準化圖像,在提取特征之前,雖然我們對圖像各向同性體素進行了歸一化,但大量提取的特征之間仍可能存在細微差異。(3)應利用多組學數(shù)據(jù)闡述預測膠質瘤分子亞型的影像組學特征的生物學基礎,將預測模型轉化為臨床應用。
綜上所述,依托DSC-PWI的先進影像組學模型能夠根據(jù)2021年WHO分類預測成人型彌漫性膠質瘤的分子亞型,可基于此進行早期臨床干預,以提高膠質瘤的治療水平。

