基因VI 型新城疫病毒反轉錄數字PCR檢測方法的建立與應用
王靜靜,舒 波,2,于曉慧,克軍宏,3,邢安琪,4,彭真奇,5,劉華雷
(1.中國動物衛生與流行病學中心,山東青島 266032;2.江西農業大學,江西南昌 330045;3.塔里木大學,新疆阿拉爾 843300;4.寧夏大學,寧夏銀川 750021;5.安徽農業大學,安徽合肥 230036)
新城疫(Newcastle disease,ND)是由新城疫病毒(Newcastle disease virus,NDV)強毒株感染引起的,可危害多種禽類的烈性傳染病。世界動物衛生組織(WOAH)將ND 列為法定報告動物疫病,我國農業農村部將其列為二類動物疫病。雞、鴿等易感禽類感染NDV 后,發病率和死亡率可高達100%[1-2]。NDV 基因組全長有15 198、15192 和15 186 nt 3 種長度,共包含6 個基因片段,3'-NP-P-M-F-HN-L-5',其中F基因和HN基因是主要的毒力決定基因[3]。NDV 可分為Class I 和Class II 兩類,其中強毒株均屬于Class II[4]。國家新城疫參考實驗室監測數據顯示,我國目前流行的強毒株主要是Class II 的基因VI 型和VII 型,其中鴿源基因VI 型NDV 近年分離率明顯升高[5-6]。
通過接種雞胚進行病毒分離和RT-PCR 測序鑒定是確診ND 的“金標準”[7-8],然而這些方法對生物安全要求高,步驟繁瑣,耗費時間長,成本較高,不能做出快速診斷。近年來,隨著分子生物學技術的發展,數字PCR(dPCR)被廣泛應用于多種動物病原的精準檢測[9-11]。dPCR 是先對模板進行預處理,將其稀釋分配到許多個獨立的單元,每個單元有1 個目標序列的PCR 微反應區,PCR 擴增結束后,通過采集熒光信號進行量化(陽性記作1,陰性記作0),再引入泊松概率分布函數進行計算,從而得到樣本的初始拷貝數,對樣本進行絕對定量[12-13]。該方法靈敏度極高,可檢測到樣本中低拷貝數的核酸,且大大節約了檢測時間和檢測成本,在動物疫病檢測中具有廣闊的應用前景[14]。本研究利用dPCR 技術平臺,針對基因VI 型NDVF基因保守區設計引物和探針,建立了一種快速、有效、靈敏度高的RT-dPCR 檢測方法,以期為在鴿群中開展基因VI 型NDV 快速檢測和研制診斷用核酸標準物質奠定基礎。
1 材料與方法
1.1 材料
1.1.1 病毒 基因VI 型、VII 型、XII 型NDV,H5、H7、H9 亞型禽流感病毒(AIV),雞傳染性支氣管炎病毒(IBV),雞傳染性喉氣管炎病毒(AILTV),禽腺病毒(FAdV)等常見禽病病原,均由中國動物衛生與流行病學中心禽病監測室保存。
1.1.2 臨床樣品 180 份鴿口咽/泄殖腔拭子,由中國動物衛生與流行病學中心2021 年從國內部分地區活禽市場采集。
1.1.3 試劑盒 核酸提取試劑盒(High Pure Viral Nucleic Acid Kit),購自Roche 公司;RT-PCR 試劑盒(Primescript One Step RT-PCR Kit Ver.2),購自TaKaRa 公司;熒光RT-PCR 試劑盒(SuperScript III Platinum One-Step qRT-PCR Kit),購自Invitrogen 公司;一步法反轉錄數字PCR 反應預混液(RT-dPCR Kit),購自蘇州思納福醫療科技有限公司。
1.1.4 雞胚 9~11 日齡SPF 雞胚,購自山東濟南斯帕法斯家禽有限公司。
1.2 引物、探針設計與篩選
從GenBank 上下載NDVF基因序列,采用MEGA 6 進行序列比對分析,選取保守區域設計3套特異性引物和探針(表1),并通過熒光RT-PCR和RT-dPCR 方法篩選出最佳引物探針組合。引物和探針由寶生物工程(大連)有限公司合成。

表1 RT-dPCR 引物和探針
1.3 病毒核酸提取
按照核酸提取試劑盒說明書提取病毒核酸,立即用于RT-dPCR 擴增,或置-80 ℃保存備用。
1.4 RT-dPCR 反應
反應體系見表2。反應程序:50 ℃,15 min;95 ℃,3min;95℃ 30 s,58 ℃ 60 s,42 個循環。升降溫速率2 ℃/s。
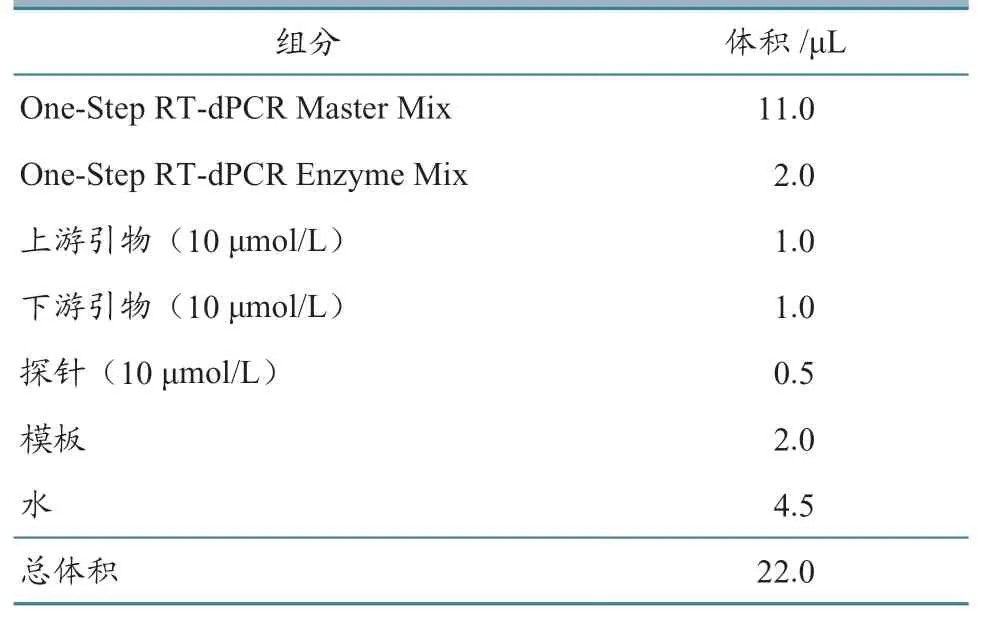
表2 RT-dPCR 反應體系
1.5 靈敏度試驗
將基因VI 型NDV 核酸進行10 倍倍比稀釋,分別取100、10-1、10-2、10-3、10-4稀釋度樣品進行RT-dPCR 檢測,每個濃度做3 次重復檢測,評價方法的靈敏度。
1.6 特異性試驗
提取基因VI 型、VII 型、XII 型NDV,H5、H7、H9 亞型AIV,IBV,AILTV,FAdV 病毒核酸,使用RT-dPCR 方法進行檢測,驗證方法的特異性。
1.7 重復性試驗
用建立的RT-dPCR 方法對基因VI 型NDV 核酸進行檢測,重復測定6 次,計算標準差和變異系數,評價方法的重復性。
1.8 臨床樣品檢測
用建立的RT-dPCR 方法對臨床采集的180 份鴿口咽/泄殖腔拭子樣品進行檢測,并與病毒分離方法檢測結果進行比較。
2 結果
2.1 引物探針篩選
用設計的3 組引物探針組合對基因VI 型NDV核酸進行熒光RT-PCR擴增。結果(表3)顯示,第3 組引物探針擴增Ct 值略低于前兩組。用設計的3 組引物探針進行RT-dPCR 擴增,結果顯示,3組引物探針均可有效擴增,故最終選擇第3 組引物探針用于RT-dPCR 方法建立。

表3 3 組引物探針組合熒光RT-PCR 擴增Ct 值
2.2 靈敏度試驗
將基因VI 型NDV 核酸進行10 倍倍比稀釋(100~10-4)后進行RT-dPCR 檢測,每個濃度做3 次重復,獲得梯度稀釋擴增圖(圖1)和標準曲線y=1.021x-0.132(圖2),R2=0.993。結果說明,本方法具有較高擴增效率,且在1.97×100~1.30×104copies/μL 的檢測范圍內具有良好的線性關系,最低檢測限為1.97 copies/μL。
2.3 特異性試驗
用建立的RT-dPCR 方法檢測基因VI 型、VII型、XII 型NDV,H5、H7、H9 亞型AIV,IBV,AILTV,FAdV 等9 種病毒核酸,僅有基因VI型NDV 檢測結果為陽性,其余病毒檢測結果均為陰性(圖3)。
2.4 重復性試驗
取同1 份基因VI 型NDV 核酸樣品,經RTdPCR 重復測定6 次。結果(表4)顯示,變異系數為2.2%,表明本方法重復性好,結果穩定、可靠。
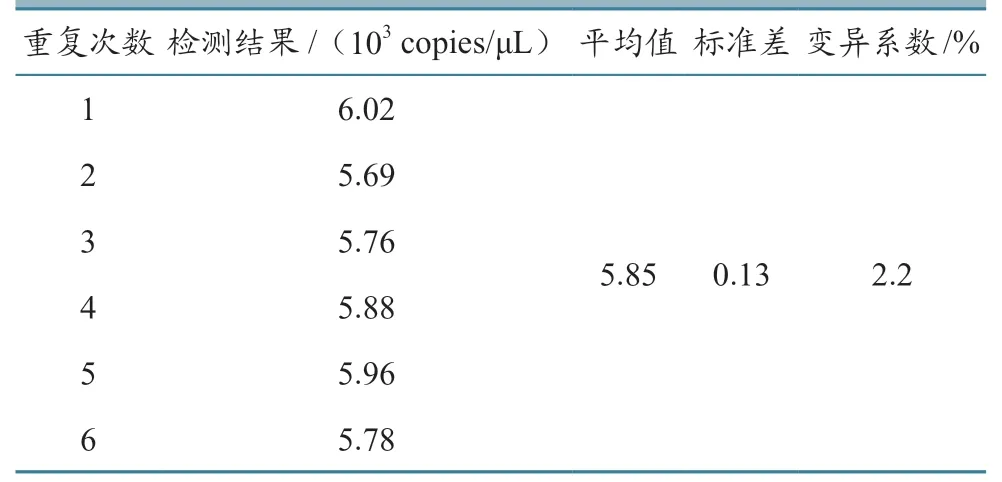
表4 重復性試驗結果
2.5 臨床樣品檢測
用建立的RT-dPCR 方法對臨床采集的180 份鴿口咽/泄殖腔拭子樣品進行檢測,結果檢出陽性樣品14 份,同時對180 份樣品進行病毒分離鑒定(雞胚接種、RT-PCR 擴增和測序、序列分析),結果顯示14 份陽性樣品均為基因VI 型NDV。RT-dPCR檢測結果與病毒分離鑒定結果完全一致,符合率為100%,說明本研究建立的RT-dPCR 方法可信度高,可用于臨床樣品中基因VI型NDV的檢測。
3 討論
基因VI 型NDV 是引發鴿ND 的主要病原,嚴重危害我國鴿業健康發展。自20 世紀80 年代鴿ND 傳入我國以來,一直在我國鴿群中流行和傳播[15-16]。ND 與禽流感、傳染性支氣管炎、傳染性喉氣管炎等禽類呼吸道疾病在鑒別診斷上難以區分,甚至一些APMV-13 和APMV-7 等副黏病毒也能與NDV 發生HI 交叉反應[15-16],因此快速鑒定NDV 對于養禽業意義重大[17]。ND 的早期診斷主要通過血清學方法,如血凝抑制試驗、病毒中和試驗、酶聯免疫吸附試驗(ELISA)、免疫組化法(IHC)等[18],這些檢測技術雖然能檢測NDV 但是不能判斷其基因型和病毒毒力,而且有些毒株無法被ELISA 等技術檢測到[19]。RT-PCR、熒光RTPCR、環介導等溫擴增技術(LAMP)等分子生物學方法是目前應用最廣泛的方法[20]。RT-PCR 和熒光RT-PCR 雖然能快速準確檢測NDV,但其靈敏度和準確度還有待提高,而且經常會出現假陽性結果,也無法檢測到所有NDV[21]。LAMP 需要針對模板設計4 對引物,方法的建立難度較大,LAMP多路復用也增加了該方法的局限性[22],而且,上述方法均不能對病原進行絕對定量。
隨著科技的不斷發展,1999 年Bert Vogelstein和Kenneth W.Kinzler 建立了第三代PCR 技術,即dPCR 技術[23]。dPCR 與第一代和第二代PCR 技術相比,具有更高的靈敏度、精確度、耐受性以及絕對定量等優點,彌補了熒光PCR 依靠Ct 值間接定量的缺陷,也解決了熒光PCR 重復性差的問題[24]。dPCR 可用于稀有突變檢測[25-26]、拷貝數變異分析[27]、復雜樣本基因表達檢測[28]等。近年來,在動物疫病檢測中的應用越來越廣泛,陳亞娜等[29]和譚建錫等[30]分別利用dPCR 技術建立了偽狂犬病毒和H1 亞型豬流感病毒微滴式dPCR 檢測方法,提高了檢測的靈敏性和準確度。但由于其檢測高濃度核酸樣品時,無法實現精準定量,目前dPCR 還不能完全取代熒光PCR[31]。
本研究利用dPCR 技術,針對基因VI 型NDVF基因保守區域設計特異性引物和探針,建立了一種可快速、特異、靈敏檢測基因VI 型NDV 的RT-dPCR 方法,可用于臨床上鴿NDV 的精準檢測及樣本中病毒核酸的精確定量,為研制診斷用核酸標準物質奠定了基礎。

