宮頸鱗癌患者手術前后的血清蛋白質指紋圖譜差異研究
蔡思娜 陳劍光 關小倩 梁衛江
1南方醫科大學第三附屬醫院腫瘤科(廣州 510630);2廣東省醫學科學院,廣東省人民醫院醫學研究部轉化醫學實驗室(廣州 510080);3南方醫科大學南方醫院腫瘤科(廣州 510515)
宮頸癌的發病率居女性惡性腫瘤第4 位,僅2018年在中國就有10.6 萬例發病[1]。晚期宮頸鱗癌的復發和死亡率高[2],提高其5年生存率的一個關鍵是找到能夠準確預測療效且靈敏度高腫瘤標志物。表面增強激光解吸飛行時間質譜技術(surface enhanced lasar desorption/ionization time of flight?mass spectrometry,SELDI?TOF?MS)[3]是近年來發展新技術,在較多腫瘤中已進行相關研究,如乳腺惡性腫瘤[4-5]、卵巢惡性腫瘤[6]、肺惡性腫瘤[7]等。然而大部分實驗均是比較癌與正常人之間的差異蛋白質,很少研究腫瘤治療后蛋白質變化情況,目前在國內外中未見宮頸鱗癌手術前后三個不同時期差異蛋白質的研究,因而本研究采取上述技術結合弱陽離子芯片(CM10),動態分析宮頸鱗癌患者手術前后蛋白質變化,從而找出相應差異蛋白質。
1 材料與方法
1.1 臨床資料本研究在南方醫科大學附屬南方醫院共收集27 例宮頸鱗癌患者的血清(2008年3月至2008年12月期間),患者術后病理分期具體如下:Ⅰa 期1 例,Ⅰb 期14 例,Ⅱa 期10 例,Ⅱb期2 例(其中高分化3 例,中分化16 例,低分化8 例)。患者的PS 評分均> 70 分,血清總蛋白及白蛋白正常,中位年齡46 歲(42~50 歲)。有20 例宮頸鱗癌患者隨訪收集了其術后30~40 d 的血清標本,中位年齡47歲(42~52歲)。納入標準:(1)確診時未經手術放化療等治療;(2)相關資料完整;(3)患者均行廣泛全子宮切除+盆腔淋巴結清掃術。按照手術時間將宮頸癌患者分為術前(A1組)、術后7~10 d(A2 組)及術后30~40 d(A3 組)。將健康對照組設為B 組,取自健康體檢女性的血清(同期南方醫院),對照組和手術組之間的年齡構成比無統計學意義。本研究已通過南方醫科大學南方醫院倫理委員會的倫理批準和獲得相關患者及健康組人員的知情同意。
1.2 儀器和試劑弱陽離子芯片(CM10)(美國Ciphergen 公司),5810R 低溫臺式離心機(德國Ep?pendorf),SELDI?TOF?MS(美國Ciphergen 公司),millipore 去離子水,尿素、Tris.Hcl、乙腈以及二硫蘇糖醇等來自美國Sigma 公司。
1.3 檢測血清蛋白
1.3.1 收集樣品采集3~5 mL靜脈血(需清晨空腹,血液不抗凝),60 min 靜置后,在4 ℃1 000 rpm/min條件下用離心機離心20 min,小心吸取離心后上清放入EP 管內,于-80℃冰箱保存。
1.3.2 處理樣品步驟在冰盒上融化樣品,上述同樣條件離心2 min ,用18 μL U9 緩沖液充分稀釋9 μL 血清,進行30 min 冰浴震蕩,隨后將上述樣品加入90 μL 的結合緩沖液(50 mmol/L NaAC,pH 4.0),混勻。
1.3.3 CM10 芯片的預處理步驟準備好生物芯片處理器,將芯片裝入,然后每孔加200 μL 的結合緩沖液,在450 rpm/min 條件下,振蕩5 min 后甩掉緩沖液;重復一次。
1.3.4 蛋白質結合反應步驟按照100 mL/孔的標準將上面處理好的樣品加入處理器中,在450 rpm/min條件下,進行60 min 室溫震蕩,甩出樣品后每孔再加入200 μL的結合緩沖液,相同條件下振蕩5 min,再次甩去緩沖液,重復一次;隨后每孔加入去離子水200 μL,馬上甩出,待芯片微干時,加SPA 0.5 mL/孔,微干后,重復一次。
1.3.5 檢測芯片質譜儀先用標準芯片進行校正,然后進行參數設置,隨后在軟件(Ciphergen ProteinChip)中按照設置程序來讀取芯片數據,以及準確地得出相關蛋白質質譜圖。
1.4 統計學方法設有意義蛋白峰的最低信噪比為5,最低出現頻率閾值為15%。將信噪比(S/N)>3 和分子量偏差<0.5%的峰也標記為有效蛋白峰(為避免遺漏小的蛋白峰)。聯用Ciphergen Protein Chip 3.1 和Biomarker Wizard 軟件,對質譜圖進行標準化,比較血清蛋白質譜峰差異。統計學處理采用SPSS 13.0,不同組之間蛋白峰比較采用t檢驗,對于手術前后三個不同時期蛋白峰對比采用析因分析,當P<0.05 時為差異具有統計學意義。
2 結果
對B 組與宮頸鱗癌患者A1 組、A2 組及A3 組的蛋白質指紋圖譜進行對比,得到了2 組不同血清差異蛋白質。
2.1 宮頸鱗癌患者手術不同時期的16 種差異蛋白質第一組為16 個宮頸鱗癌與對照組相比的差異蛋白質,在術后7~10 d 其含量呈上升趨勢(A3組與B 組比較,均P>0.1);其中12 個蛋白質(除表1中第13?16 蛋白)在A1 組與A2 組比較中差異有統計學意義(表1、圖1,P≤0.001)。
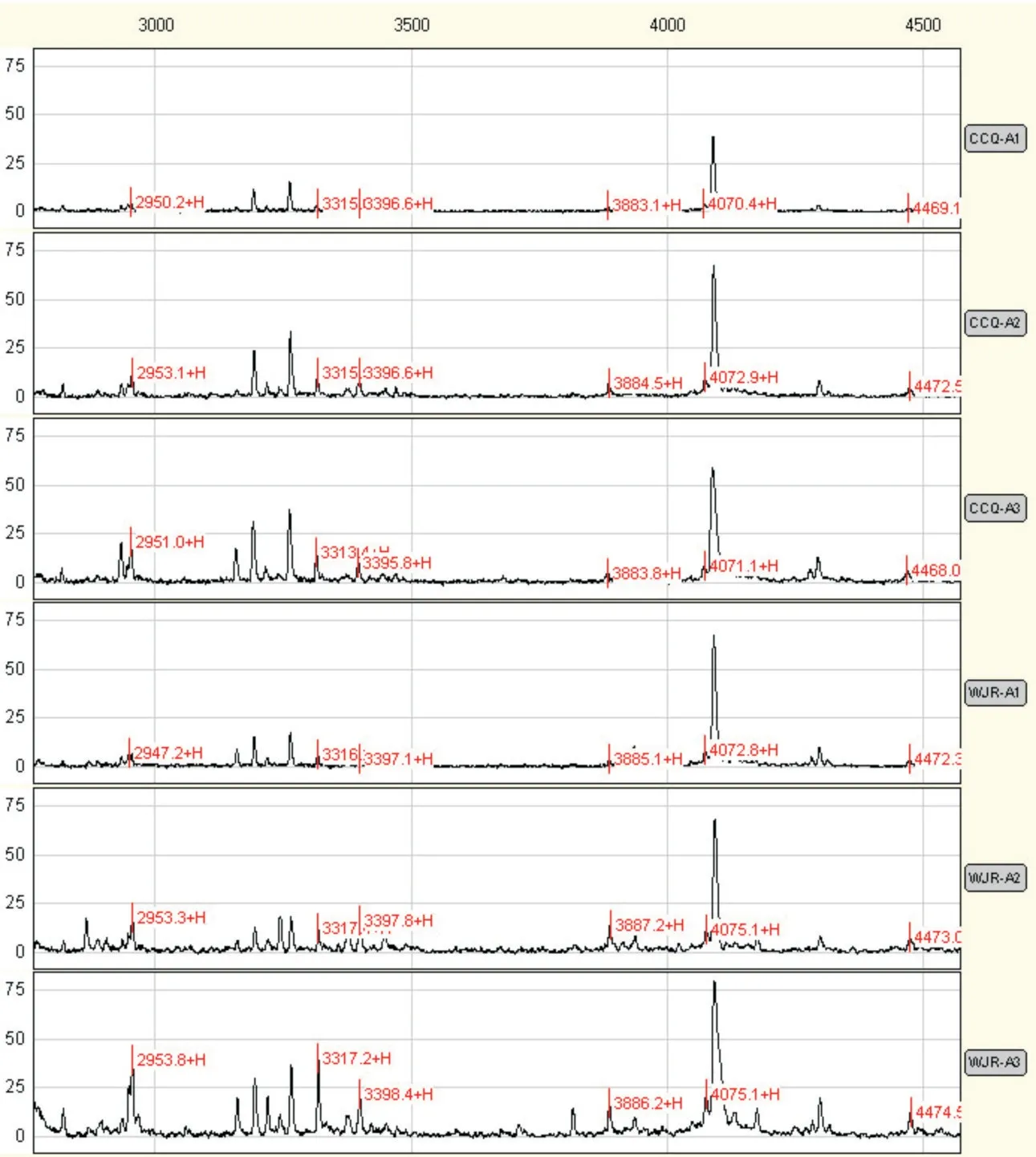
圖1 宮頸鱗癌患者第一組部分血清差異蛋白質在不同手術時期質譜峰圖Fig.1 The mass peak map of six different serum proteins in the same paitent with cervical squamous cell carcinoma between pre?operation and post?operation
表1 16 種差異蛋白質在宮頸鱗癌患者手術不同時期血清中的質譜峰值Tab.1 The peek intensity of 16 different proteins in the patient with cervical squamous cell carcinoma between pre?operation ±s

表1 16 種差異蛋白質在宮頸鱗癌患者手術不同時期血清中的質譜峰值Tab.1 The peek intensity of 16 different proteins in the patient with cervical squamous cell carcinoma between pre?operation ±s
編號A1 組(images/BZ_42_2142_2300_2165_2333.png±s)組內比較P 值Mass(Da)2 950.38 3 885.53 4 074.49 4 473.88 5 334.74 5 632.30 5 901.93 6 087.13 6 109.62 6 627.27 7 765.25 9 286.48 3 315.77 3 397.42 12 860.11 13 263.98 A2 組(images/BZ_42_2142_2300_2165_2333.png±s)A3 組(images/BZ_42_2142_2300_2165_2333.png±s)1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 7.058±2.765 4.832±1.488 8.844±2.807 3.782±1.671 7.282±3.171 28.502±12.421 36.991±10.794 1.999±0.985 4.320±1.616 45.631±16.555 15.911±5.343 5.463±3.538 12.407±6.906 5.655±1.629 0.396±0.252 0.255±0.217 11.390±4.320 9.528±3.749 12.674±3.927 6.212±2.358 14.232±5.920 41.286±9.453 57.339±10.506 4.847±1.861 9.228±3.242 61.471±10.474 32.016±9.982 12.884±5.479 19.757±7.146 12.357±6.240 0.771±0.448 0.606±0.370 15.612±7.308 8.545±3.853 13.842±4.781 7.518±2.426 18.228±10.339 49.212±13.970 62.509±14.690 5.256±2.936 11.061±5.464 61.868±12.078 27.220±11.452 10.197±5.368 20.944±9.712 11.998±6.222 0.537±0.260 0.501±0.478 P 值<0.001<0.001<0.001<0.001<0.001<0.001<0.001<0.001<0.001<0.001<0.001<0.001 0.004 0.002 0.003 0.004 A1:A2 0.001<0.001<0.001<0.001<0.001 0.001<0.001<0.001<0.001<0.001<0.001<0.001<0.001<0.001<0.001<0.001 A1:A3<0.001 0.001<0.001<0.001<0.001<0.001<0.001<0.001<0.001<0.001 0.001 0.002 0.002<0.001 0.038 0.026 A2:A3 0.026 0.413 0.368 0.104 0.095 0.087 0.238 0.549 0.169 0.883 0.169 0.060 0.681 0.874 0.057 0.318
2.2 宮頸鱗癌患者手術不同時期的12 種差異蛋白質第二組為12 個A1 組與A3 組之間相比的差異蛋白質,在術前患者、術后7~10 d 及術后30~40 d 血清中的含量不斷上升,有11 個蛋白質在術后30~40 d時基本恢復到對照組水平(表2、圖2)。
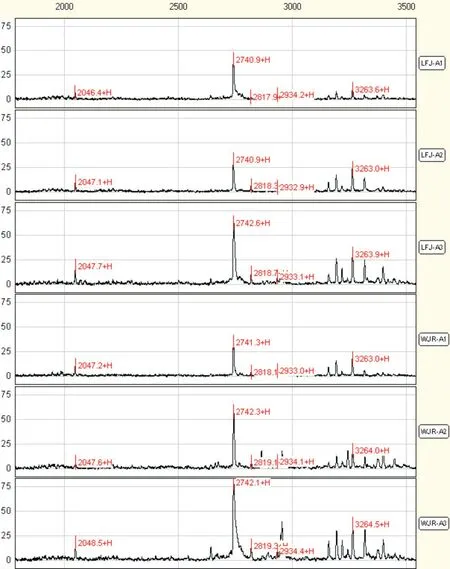
圖2 宮頸鱗癌患者第二組部分血清差異蛋白質在不同手術時期質譜峰圖Fig.2 The mass peak map of five different serum proteins in the same paitent with cervical squamous cell carcinoma between pre?operation and post?operation

表2 12 種差異蛋白質在宮頸鱗癌患者手術不同時期的質譜峰值Tab.2 The peek intensity of 12 different proteins in the patient with cervical squamous cell carcinoma between pre?operation x±s
3 討論
宮頸鱗癌的治療以綜合治療為主,加強對手術效果監控和評價,盡早發現復發,對宮頸鱗癌整體診療非常重要[8]。目前國際上有許多蛋白組學技術應用于宮頸癌[9],而SELDI?TOF 技術則是一種非常有用的生物標志物篩選技術,可以直接分析復雜樣品,可檢測20 kda 以下的蛋白質,這些小分子量蛋白質可能因疾病而被切斷或脫落,因此具有生物學意義。本技術在肝癌[10-11]、腦部疾病[12]、感染疾病[13]、Wilms 腫瘤[14]及篩選結腸癌手術后復發差異蛋白質[15]等多種疾病的診斷以及治療中應用廣泛,然而目前在國內外中未見宮頸鱗癌手術前后三個不同時期血清差異蛋白質的研究。
本研究通過對比宮頸鱗癌患者手術前后血清中蛋白質變化,結合對比健康人血清蛋白質,發現了兩組差異蛋白質:第一組所含有的3 397.42(M/Z)、4 473.88(M/Z)、5 901.93(M/Z)等16 個差異蛋白質在術前患者的血清含量中,與對照組相比,明顯處于低值,有可能作為生物標志物,用于區分宮頸鱗癌與健康人;進一步分析這16 個差異蛋白質含量在術后30~40 d 基本恢復至健康人水平;這種變化趨勢與郭社珂等[16]采用不同于CM10 的銅離子芯片,使用SELDI 技術對比宮頸鱗狀細胞癌患者術前和術后血清蛋白質,結果得到6 個低表達的差異蛋白質,這些蛋白質在術后3 個月有明顯回升,和本實驗結果一致,而且該研究中的M/Z為9 280.63 的差異蛋白質和本組所得到的差異蛋白質9 286.48(M/Z)幾乎相同,可認為是同一蛋白質。由此可以推斷通過SELDI?TOF 技術所檢測出的結果有較高的可靠性及可重復性。第二組的差異蛋白質中有5 個在術前患者血清的含量明顯低于對照組,也可作為區分宮頸癌患者與健康人的生物標志物;尤其是2 741.41(M/Z)、4 173.61(M/Z)、6 479.29(M/Z)3 個用于組成宮頸鱗癌診斷樹模型的差異蛋白質[17]。雖然第二組差異蛋白的含量在A1 和A2 的對比中沒有發生顯著變化,但是在術后30~40 d 含量上升,結合第一組蛋白質含量變化趨勢,由此可以推斷這兩組蛋白質是一組機體或其它器官組織分泌保護因子或抑癌因子,由于存在腫瘤組織的抑制,使其含量明顯降低,在手術切除腫瘤后,含量不斷上升至正常。從本研究可看出,手術治療效果能夠通過SELDI 技術結合芯片盡早檢測出來,具體可通過觀察相關差異蛋白質的變化趨勢,而其他腫瘤研究也支持這個結論,CHAI 等[18]研究表明,通過該技術進行血清蛋白質組學分析,可以在盆腔放療前發現易出現放射性直腸炎的宮頸癌患者,從而對后續干預起到指導作用。而ZHOU 等[15]使用該技術比較了結腸癌術后原位復發患者的特異性血清生物標志物,發現復發組和非復發組之間共有9 個蛋白質峰顯示出差異,從而對疾病復發起到監測可能。
下一步的研究將是利用液相色譜?質譜等二級質譜方法鑒別出差異蛋白質,最后進行臨床驗證等。本研究樣本量偏小,需繼續收集,并結合患者臨床特征如HPV 感染、病理等進行相應分層分析[19-20]。
綜上所述,本研究采用SELDI?TOF 結合CM10芯片技術,得到了兩組不同的差異蛋白質。第一組差異蛋白質可作為區分宮頸鱗癌與正常人生物學指標,在宮頸鱗癌和對照組比較差異有統計學意義,同時兩組差異蛋白質含量在宮頸鱗癌患者手術前后三個不同時期均有明顯不同,預測能作為宮頸鱗癌手術療效評價和術后病情監測的指標。

