持續冷暴露通過循環miRNA影響小鼠血脂代謝的實驗研究
姬寒蕊,吳圣賢
高脂血癥是指由于脂肪代謝或運轉異常而使血液中脂質水平異常的一種疾病。近年來,隨著膳食結構的改變和社會老齡化的加速,高脂血癥已成為動脈粥樣硬化、缺血性腦卒中、急性心肌梗死等疾病的主要危險因素,可直接或間接地導致以上疾病發生或加重,提高其致殘率及死亡率,積極探究血脂代謝紊亂的調控機制十分必要。近年來,發現了一類天然存在的非編碼RNA,稱為microRNA(miRNA),miRNA為脂質代謝的關鍵調節因子[1-2],在調節血脂代謝和動脈粥樣硬化發展進程中具有關鍵作用,探究miRNA表達與血脂代謝的關系,對于防治高脂血癥具有重要意義。
1 材料與方法
1.1 動物模型的建立 實驗選用C57BL/6J雄性小鼠建立高脂飲食誘導的高脂血癥模型,將90只小鼠隨機分為兩組,即4 ℃冷暴露組和30 ℃等熱區對照組,每組45只。4 ℃冷暴露組常溫下飼養4周后轉入18 ℃環境飼養箱內適應性飼養1周后,轉入4 ℃環境飼養箱內飼養4周;30 ℃等熱區對照組結束常溫飼養4周后直接轉入30 ℃環境飼養箱內飼養5周。高脂飲食配方為15%脂肪、0.25%膽固醇,12 h/12 h光/暗循環。
本實驗中所有動物飼養條件以及動物實驗操作均嚴格遵守醫院重點學科實驗室動物實驗倫理委員會制定的相關規定。
1.2 血脂水平檢測 取200~300 μL小鼠血清,應用全自動生化分析儀檢測血脂四項,即總膽固醇(TC)、三酰甘油(TG)、低密度脂蛋白膽固醇(LDL-C)。
1.3 病理學檢測 取出固定于4%多聚甲醛中的脂肪組織,清洗切塊后放置于石蠟組織包埋盒中,盒外標記信息。包埋盒置于自動脫水石蠟組織制備儀中脫水、過夜,切片機切片,40 ℃溫水臺中使切片舒展開,將水控干后烤片,常溫干燥環境中保存以備用。取小鼠脂肪組織的石蠟包埋切片,進行常規免疫組織化學染色和蘇木精-伊紅(HE)染色,免疫組化一抗使用兔抗線粒體解偶聯蛋白1(UCP1)抗體(貨號AB-10983),購自Abcam公司,二抗為兔二步法檢測試劑盒(貨號PV-9001),購自北京中杉金橋生物技術有限公司。中性樹膠封片后,光學顯微鏡下觀察并攝片。觀察小鼠肩胛區、腹股溝區、附睪區脂肪組織HE染色情況,比較各部位脂肪組織細胞面積大小、數目、小房室形成情況;并分析各部位脂肪組織棕色化標志物UCP1免疫組化陽性染色面積。
1.4 二代測序及初步分析 使用Trizol法進行血清外泌體RNA提取和純化,Agilent2100檢測各樣本RNA濃度。采用BGISEQ-500測序技術,對富集到的18-30nt small RMA片段進行測序。對測序得到的目標序列進行分類注釋,將數據與第22版的miRBase數據庫進行比對,挑選出比對上的miRNA的成熟體和前體信息;同時miRNA的前體能夠形成發夾二級結構,使用miRDeep2軟件進行新的miRNA預測。使用TPM對每個樣品的表達量進行標準化后對組間樣本進行miRNA差異表達分析,找到表達上調和下調的miRNA。通過R語言對miRNA的表達量進行差異性分析。使用miRanda和TargetScan靶基因預測軟件對鑒定得到的差異表達miRNA進行靶基因預測,借助GeneOntology 數據庫和京都基因和基因組百科全書(Kyoto Encyclopedia of Genes and Genomes,KEGG)進行基因本體(GO)功能顯著性富集分析和信號通路顯著性富集分析。測序過程由武漢華大基因研究所完成。

2 結 果
2.1 兩組體重、血脂水平比較 與30 ℃等熱區對照組相比,4周4 ℃持續冷暴露可使小鼠體重減輕約12.85%(P<0.001),TC水平降低16.10%,LDL-C水平降低約23.41%,TG水平降低約26.51%,差異均有統計學意義(P<0.05)。詳見表1。
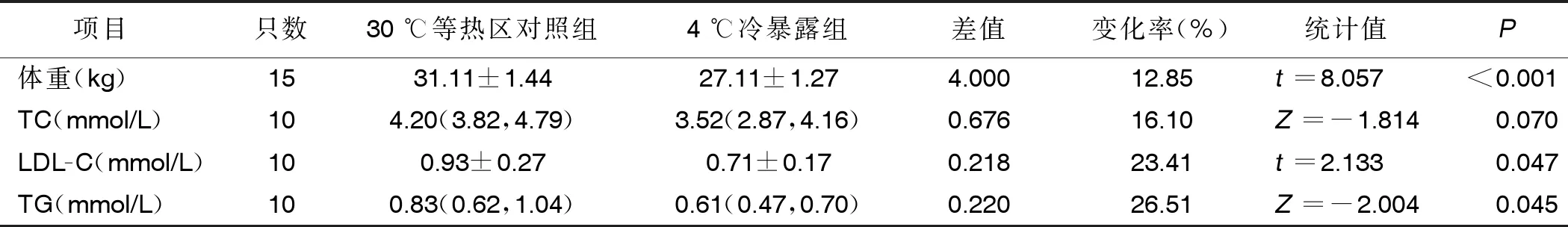
表1 兩組體重、血脂水平比較
2.2 免疫組化和HE染色結果 對小鼠肩胛區棕色脂肪組織進行HE染色,結果顯示,4 ℃冷暴露組與30 ℃等熱區對照組相比,脂肪細胞體積明顯縮小,體型苗條,顯微鏡下可以看到細胞核染色較深,呈現出棕色化表現。此外,腹股溝脂肪組織HE染色發現,在30 ℃等熱區對照組小鼠的脂肪組織中,染色較淺,為細胞圓潤的單房脂滴;而4 ℃冷暴露組脂肪組織染色較深,為相對瘦小的多房脂滴。兩組附睪區脂肪組織HE染色無明顯區別。UCP1免疫組織化學染色提示,與30 ℃等熱區對照組相比,4 ℃冷暴露組UCP1可見明顯陽性表達。詳見圖1~圖6。

圖2 兩組腹股溝區脂肪組織HE染色圖

圖5 兩組腹股溝區脂肪組織UCP1免疫組化圖

圖6 兩組附睪區脂肪組織UCP1免疫組化圖
2.3 兩組小鼠miRNA表達譜分析 對兩組樣本進行miRNA差異表達分析,找到上調和下調的miRNA。結果顯示,4 ℃持續冷暴露組與30 ℃等熱區對照組間miRNA表達譜對比,篩選出組間顯著差異表達miRNA 共451條,其中140條miRNA表達顯著上調,311條miRNA表達顯著下調。顯著差異表達的前10位未知及已知的miRNA見表2及表3。

表2 兩組顯著差異表達的未知miRNA(前10位)

表3 兩組顯著差異表達的已知miRNA(前10位)
2.4 靶基因預測和GO功能注釋 結合靶基因預測結果與查閱文獻發現,顯著差異表達的前20位miRNA中,預測到的novel_mir114、novel_mir389、novel_mir431可靶向作用于低密度脂蛋白受體(LDLR)基因(NM_010700)。此外,查閱既往研究發現,mmu-miR-344b-3p、mmu-miR-23b-5p、mmu-miR-149-5p、mmu-miR-130b-5p等與脂肪細胞形成、分化以及肝臟脂質代謝等密切相關,可作用于調控血脂代謝的相關基因。同時4 ℃冷暴露組和30 ℃等熱區對照組miRNA差異表達分析發現,這4條miRNA表達水平均顯著下調。
GO顯著性富集分析結果見圖7,分別以不同顏色標注。同時分析結果顯示,4 ℃冷暴露組與30 ℃等熱區對照組相比,差異表達miRNA靶基因涉及的生物學過程主要為生物調節(biological regulation)、細胞過程(cellular process)、代謝過程(metabolic process)、單生物過程(single-organism perocess)。詳見表4。

圖7 GO顯著性富集分析結果(紅色為基因的分子功能;綠色為細胞成分;藍色為參與的生物學過程)

表4 兩組差異表達miRNA GO生物學過程(前10位)
2.5 KEGG信號通路分析 通過KEGG顯著性富集能確定差異表達小RNA的靶基因參與的最主要生化代謝途徑和信號轉導途徑。分析顯示,主要富集的生化代謝途徑和信號轉導途徑包括細胞進程(cellular processes)、環境信息處理(environmental information processing)、遺傳信息處理(genetic information processing)、人類疾病(human diseases)、新陳代謝(metabolism)、有機體系統(organismal systems)等。RichFactor系差異小RNA的靶基因中位于該信號通路條目的基因數目與所有有注釋基因中位于該信號通路條目的基因總數的比值,富集的程度越大,則RichFactor越大。Q值是經過多重假設檢驗校正之后的P值,取值范圍為0~1,越接近于零,代表富集越顯著。詳見表5、圖8。

表5 兩組差異表達miRNA信號通路條目(前20位)

圖8 信號通路富集統計散點圖(排名前20位)
3 討 論
隨著膳食習慣的改變及社會老齡化的速度加快,我國成人血脂異常患病率大幅上升,城鎮居民肥胖、高脂血癥、動脈粥樣硬化、腦卒中等代謝性疾病的發生率亦不斷增加。根據《中國心血管報告2018》[3]報告中描述,目前我國心腦血管疾病的現患人數已達到2.9億人,其中腦卒中為1 300萬人,冠心病1 100萬人。心腦血管疾病已成為導致人類死亡的首位原因[4-5]。關于血脂代謝的內在機制及臨床治療,仍有眾多問題亟待解決。大量流行病學研究顯示,在全世界范圍內,冬季心血管事件顯著高發[6-7],腦卒中和心肌梗死與環境氣溫下降具有明顯的相關性[8-9],然而寒冷導致心血管事件增加的原因,一直沒有得到滿意的解答。miRNAs作為一種基因表達的調控因子,在肥胖、糖尿病、動脈粥樣硬化和高尿酸血癥等代謝疾病的發生、發展中起重要作用,在高脂血癥中的作用更為明顯。已有眾多研究提示,miRNA在轉錄后參與調控極低密度脂蛋白的分泌、膽固醇的內源性合成、膽固醇逆向轉運(reverse cholesterol transport,RCT)以及肝臟LDLR的表達等過程。外泌體是一種特殊的細胞間信號傳輸載體[10-11],脂肪細胞為其主要來源,并可作用于包括肝臟在內的多種靶器官[12]。
本研究發現,4周4 ℃持續冷暴露可使小鼠體重明顯減輕,TC、TG、LDL-C水平下降;病理學研究顯示,小鼠皮下棕色脂肪活化、白色脂肪棕色化增加,且免疫組化顯示UCP1增量表達,表明寒冷暴露后皮下脂肪動員,進而UCP1依賴性脂解。此外,課題組前期研究顯示,肝臟受到冷刺激后LDLR增量表達,從而導致血脂水平下降。為了進一步探究其內在機制,本研究對小鼠血清外泌體中的miRNAs進行了二代測序。
表達譜初步分析發現,與30 ℃等熱區對照組相比,mmu-miR-344b-3p、mmu-miR-23b-5p、mmu-miR-149-5p、mmu-miR-130b-5p等在4 ℃持續冷暴露組小鼠血清中顯著下調,其中mmu-miR-344b-3p變化最顯著,而miR-130b-5p研究最為充分,且與脂質代謝相關,不過多數研究認為過氧化物酶體增殖劑激活受體家族(PPAR)可能為其調控脂質代謝的潛在靶標[13-16]。靶基因預測結果顯示,mmu-miR-149-5p可預測LDLR、 極低密度脂蛋白受體(VLDLR)、前蛋白轉化酶枯草溶菌素9(PCSK9)、環磷酸腺苷反應元件結合蛋白(CREB)的轉錄激活因子2(CRTC2)、胰島素受體(INSR)等多種脂質代謝相關基因。Zhao等[17]通過高脂飲食誘導建立胰島素抵抗小鼠模型,采用二代高通量測序篩選差異表達miRNA并進行實時定量聚合酶鏈式反應(PCR)驗證,結果顯示,與正常小鼠相比,肝臟中miR-122-5p、miR-149-5p等顯著差異表達,miR-149-5p靶基因預測顯示可預測到CRTC2、INSR、信號傳導及轉錄激活因子3(Stat3)等與代謝穩態相關的基因。
肝LDLR是肝臟膽固醇清除的主要途徑,其表達受到嚴格而精細的調節。本研究發現,新預測到的未知miRNA包括novel_mir349、novel_mir114和novel_mir287等表達顯著上調,novel_mir116、novel_mir431、novel_mir416、novel_mir389等顯著下調。靶基因預測初步發現novel_mir114、novel_mir389、novel_mir431等可直接靶向作用于LDLR基因。未知miRNA參與亦可能是持續冷暴露下的血脂代謝的調控機制之一。
綜上所述,4 ℃持續冷暴露小鼠血清外泌體中差異表達的miRNA可能與血脂代謝的調控機制有關。血清中的miRNA可能來源于冷暴露后活化的皮下脂肪組織,并以外泌體為載體到達肝臟,進而參與肝臟中的LDLR膽固醇清除途徑。但目前尚無明顯證據表明其來源及具體作用靶點,后續可通過實時定量聚合酶鏈式反應、細胞實驗、熒光素酶報告基因檢測等技術手段開展深層次探究。

