國內外質控差異可能對多組分抗生素注射劑一致性評價產生的影響
馬步芳 王立新 張培培 姚尚辰 常艷
(中國食品藥品檢定研究院,北京 102629)
根據《國務院辦公廳關于開展仿制藥質量和療效一致性評價的意見》(國辦發〔2016〕8號)等有關規定,為加快推進仿制藥一致性評價工作,國家藥品監督管理局于2020年5月12日發布《開展化學藥品注射劑仿制藥質量和療效一致性評價工作的公告》(2020年第62號)標志著化學藥品注射劑仿制藥質量和療效一致性評價工作正式實施。抗生素藥物在注射劑中占有較大比例[1]。按抗生素組分構成特點可分為單組分和多組分抗生素兩個大類。中國藥典2020版二部中已收載的多組分抗生素注射劑包括:注射用替考拉寧、硫酸慶大霉素注射液B等[2]。對于單組分抗生素注射劑一致性評價的策略已有文獻報道[3-5],但對于多組分抗生素注射劑的一致性評價又該如何開展?在已頒布的《化學藥品注射劑仿制藥質量和療效一致性評價技術要求》中,并未對“多組分”提出具體要求。根據既往仿制藥一致性評價經驗,在質量研究與控制技術要求方面需參考相關技術指導原則以及國內外藥典的收載要求,特別是原研或參比制劑所在國藥典中的質控項目和限度規定。但當國內外藥典對于多組分抗生素的質控存在明顯差異,特別是在組分和有關物質控制的限度上存較大分歧時,這種差異或分歧又會對此類抗生素注射劑一致性評價產生哪些影響?本文嘗試以替考拉寧品種為例展開討論。
替考拉寧是一種糖肽類多組分抗生素,其組分可分為A2組和A3組。A2組包括A2-1組、A2-2、A2-3組、A2-4、A2-5組和A2-6組;其中,A2-1組包括主要組分A2-1,以及RS3(A2-1a)和RS4(A2-1b)兩個小組分;A2-3組和A2-5組分別包括主要組分A2-3和A2-5,A2-6組包括2個親脂性較大的類似物RS1和RS2[6-7]。A3組包括主要組分A3-1,該化合物是A2的去酰基葡萄糖胺產物[8]。替考拉寧各主要組分化學結構見圖1。在臨床應用中,5個主要組分A2-1至A2-5的抗菌活性與藥代動力學特性相對差異較小,A3-1組分及4個小組分RS1至RS4的體外活性與A2組的5個主要組分并無顯著性差異[9-10]。此外,A2組和A3組中還存在多個結構、活性和毒性均未知的微量組分。
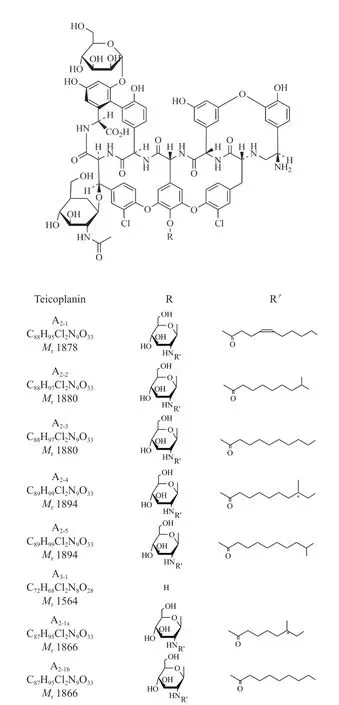
圖1 替考拉寧各主要組分化學結構Fig.1 Chemical structure of main components of teicoplanin
對于發酵類的多組分抗生素,產品中各組分的比例與菌種和發酵工藝有關,由于菌種、培養基組成、發酵時間、發酵溫度以及提取工藝等多種因素的影響,組分比例差異不可避免[11]。這種差異可能與臨床用藥的療效和毒副反應的發生率直接相關[12],故需制定合理的質控標準對各組分含量及有關物質進行控制,以保證用藥的安全性和有效性。歐洲藥典(EP)、英國藥典(BP)、日本藥典(JP)、中國藥典(ChP)中收載了替考拉寧品種,各國藥典均在控制效價活性含量的同時采用HPLC法對其組分及有關物質進行質控。經比較,各國標準中:液相色譜條件基本一致,各組分和有關物質計算方法完全相同,均采用相對比例作為質控指標,但對各組分和有關物質的控制限度卻存在較大差異[13-16]。
在國內,替考拉寧和注射用替考拉寧分別有3個和5個生產批號。根據國家藥品監督管理局藥品審評中心2019年6月3日發布的《化學仿制藥參比制劑目錄(第二十二批)》,注射用替考拉寧的參比制劑為其原研賽諾菲(Sanofi S.p.A)公司生產的他格適(Targocid),規格為200mg。國產仿制注射用替考拉寧包含0.2 g和0.4 g兩個規格涉及3個生產廠家。本文以市場流通環節獲取的注射用替考拉寧參比制劑、國內3個不同廠家生產的仿制藥以及2批次替考拉寧國家標準品作為研究對象展開討論。
1 材料與方法
1.1 主要儀器及試劑
儀器 Waters e2695液相色譜儀;Waters 2998 Photodiode Array Detector。
試劑 無水磷酸二氫鈉、氫氧化鈉均為分析純;乙腈為色譜純;水為超純水。
1.2 供試品
賽諾菲安萬特SANOFI(參比制劑)提供替考拉寧注射用粉針(200mg)樣品3批(批號:A8681、A8682、A8683);國產企業提供替考拉寧原料藥共8批,標記為A廠(批號:2121-170901、2121-180501、2121-180502),B廠(批號:YTN1810401、YTN1811401),C廠(批號:306T181214A、306T181215A、306T181216A);中國食品藥品檢定研究院提供替考拉寧國家標準品2批(批號:130374-201002、130374-201903)
1.3 溶液配制
分別取各廠家替考拉寧注射用粉針和原料藥以及國家標準品各適量,以水溶解并稀釋成含替考拉寧約2 mg/mL的溶液,作為供試品溶液。
靈敏度溶液:取供試品溶液適量,以水稀釋成含替考拉寧約0.01 mg/mL的溶液,作為靈敏度溶液。
1.4 色譜條件與系統適用性試驗
采用EP10.0中的色譜條件,洗脫方法見表1;色譜柱為X Bridge Shield RP18 5 μm,4.6 mm×250 mm。取供試品溶液和靈敏度溶液各20 μL,注入液相色譜儀,記錄色譜圖。供試品溶液中A2-4峰與A2-5峰之間的分離度不小于1.0;靈敏度溶液中A2-2峰的信噪比不小于40。

表1 梯度洗脫方法Tab.1 Gradient elution method
1.5 組分及有關物質測定
取供試品溶液20 μL,注入液相色譜儀,記錄色譜圖。各組分/有關物質的位置描述(相對于A2-2組分峰的相對保留時間,RRT)及含量計算公式詳見表2和公式1~2。A2-2組分峰的保留時間約為18 min。
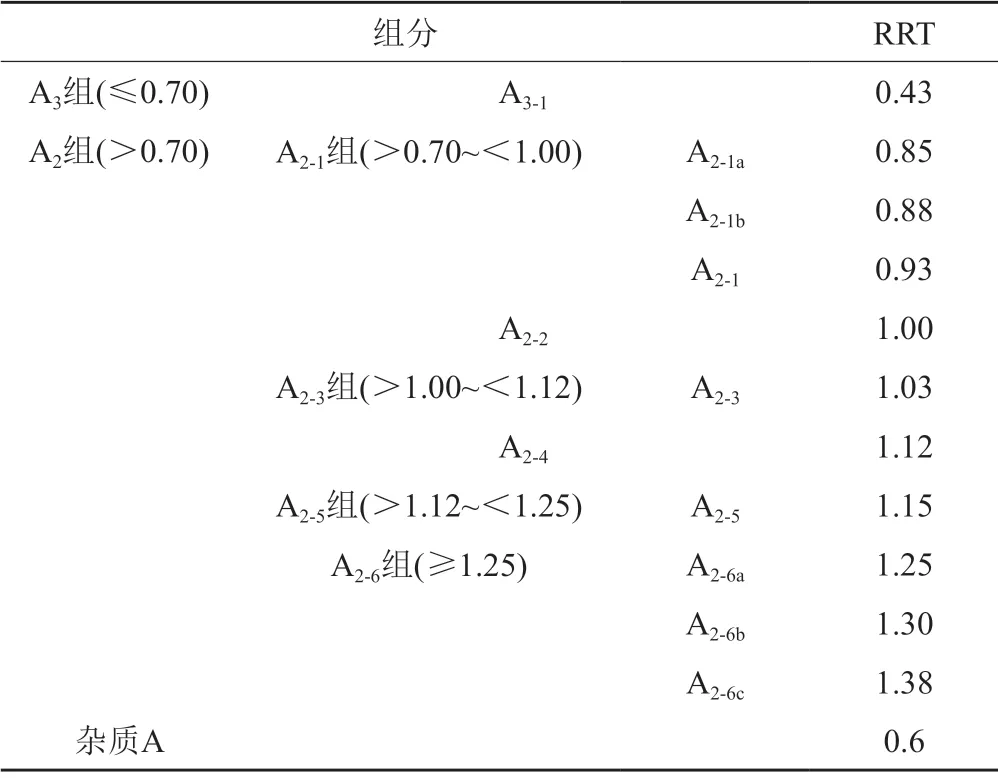
表2 各組分/有關物質的相對保留時間Tab.2 Relative retention time of teicoplanin components/related substances
公式1:
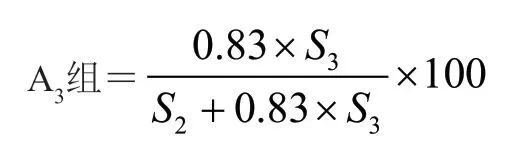
公式2:
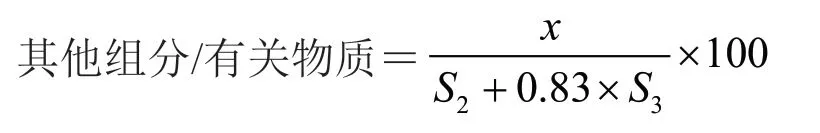
式中S2為A2組峰面積之和;S3為A3組峰面積之和;x為某一組分/有關物質的峰面積。
2 結果與討論
2.1 測定結果
2.1.1 各國藥典對替考拉寧組分和有關物質控制要求比較
各國藥典自首次收載起[17-20],對替考拉寧組分/有關物質測定的色譜條件和含量計算方法保持一致,但對于受控組分及其質控限度存在差異(表3):日本藥典和中國藥典保持一致,并沿用至今[13-14],期間未進行任何修訂;歐洲藥典和英國藥典保持一致,在EP9.8版[21]/BP2020[15]版中作了較大幅度的修訂,沿用至今(EP10.0版[16]),修訂后版本與JP17和ChP2020版之間存在較大差異。關鍵差異可以概述為兩點:首先,受控組分不同;第二,限度規定方式和數值不同。JP17/ChP2020、EP7.0/BP2010和EP9.8/BP2020規定的受控組分數量分別為3個、8個和13個。除A2-2外,EP7.0/BP2010對各受控組分的限度規定方式與JP17/ChP2020一致,均為規定含量上限或下限,僅在數值上有差異;EP9.8/BP2020對除A2-6組之外的所有受控組分含量上下限均有明確的數值規定。與JP17/ChP2020和EP7.0/BP2010相比,EP9.8/BP2020增加了“有關物質”這一質控項。此外,EP/BP對雜質A的含量有限度規定,而JP17/ChP2020無此質控項。各藥典標準對受控組分間相對比例的規定允許波動的范圍由大到小依次為:JP17/ChP2020>EP7.0/BP2010>EP9.8/BP2020。

表3 各國藥典對替考拉寧組分/有關物質的質控限度Tab.3 Control limits of teicoplanin components and related substances in different pharmacopoeias
2.1.2 不同來源替考拉寧組分/有關物質的測定結果
測定結果(表4)具有以下兩個特點:第一,同一來源內部,同一組分/有關物質的含量在不同批次間存在波動,波動差異由大到小排序:國家標準品>A廠家>B廠家>C廠家>參比制劑,其中參比制劑同一組分/有關物質的含量在不同批次間相對穩定;第二,不同來源樣品中各組分構成的相對比例間存在顯著性差異,典型色譜圖詳見圖2,各主要組分/有關物質含量比較的示意圖如圖3所示。
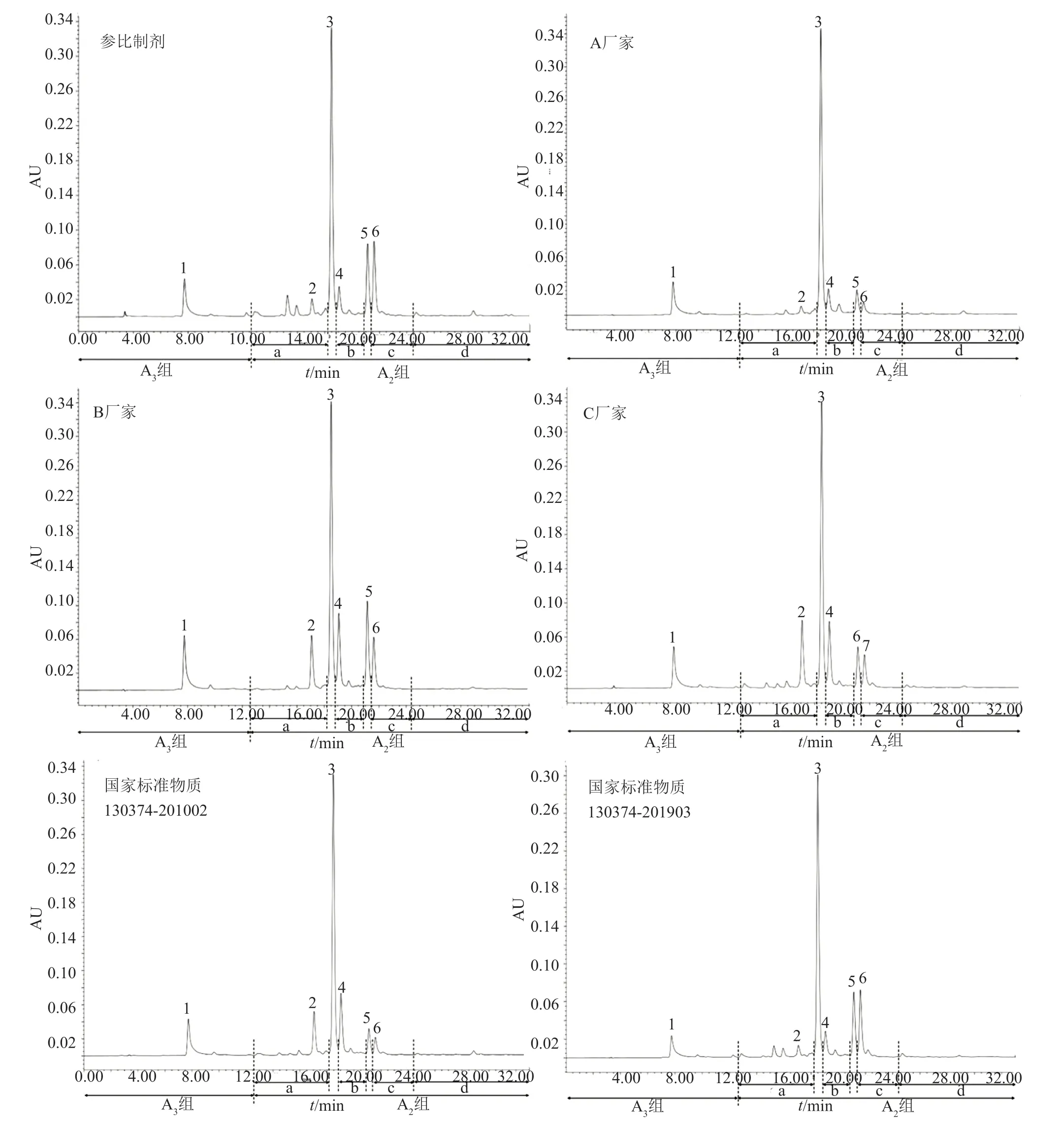
圖2 不同來源的替考拉寧產品的典型色譜圖Fig.2 Typical chromatograms of teicoplanin products from different sources
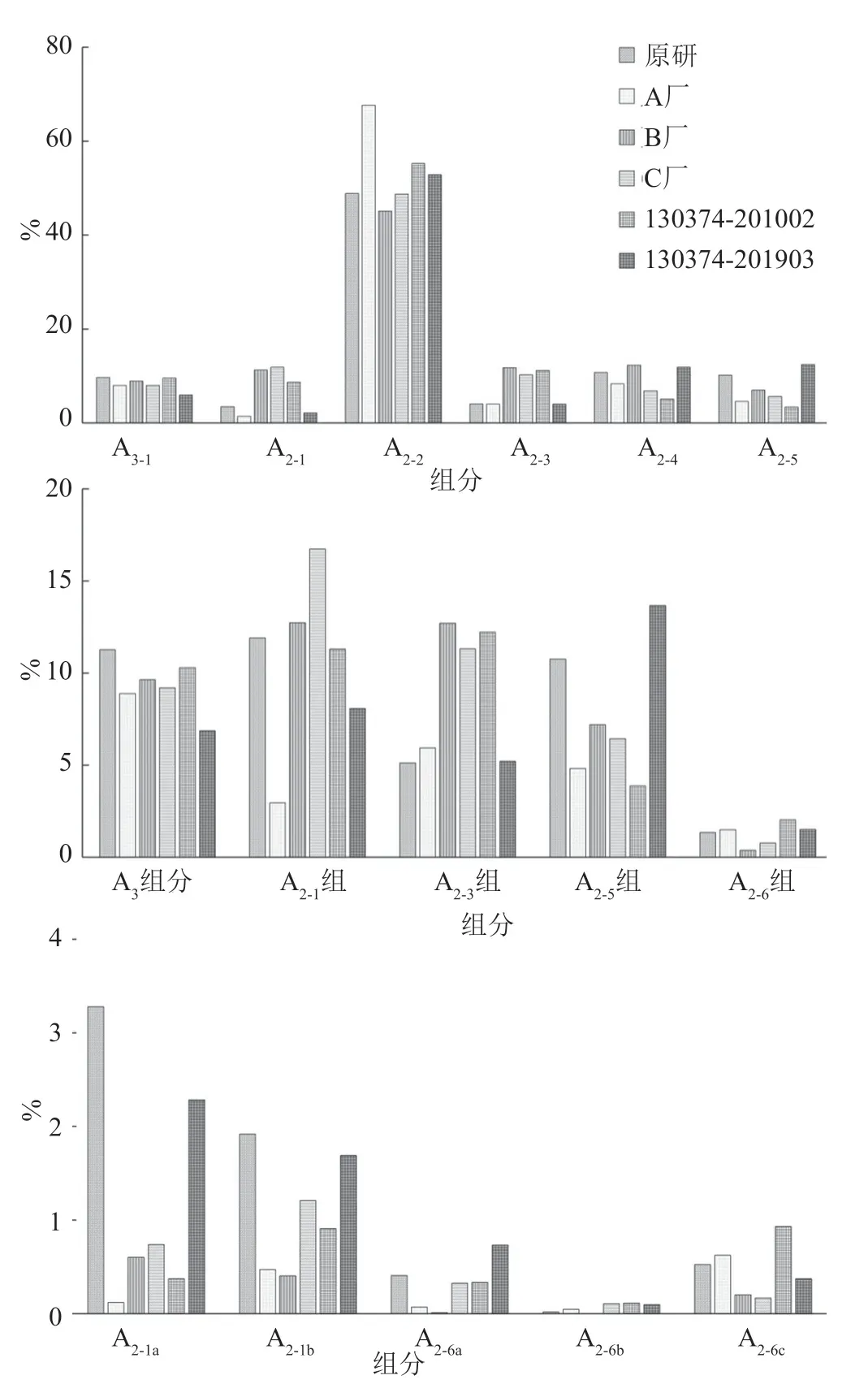
圖3 不同來源的替考拉寧產品的組分含量比較示意圖Fig.3 Comparison diagram of component content of teicoplanin products from different sources
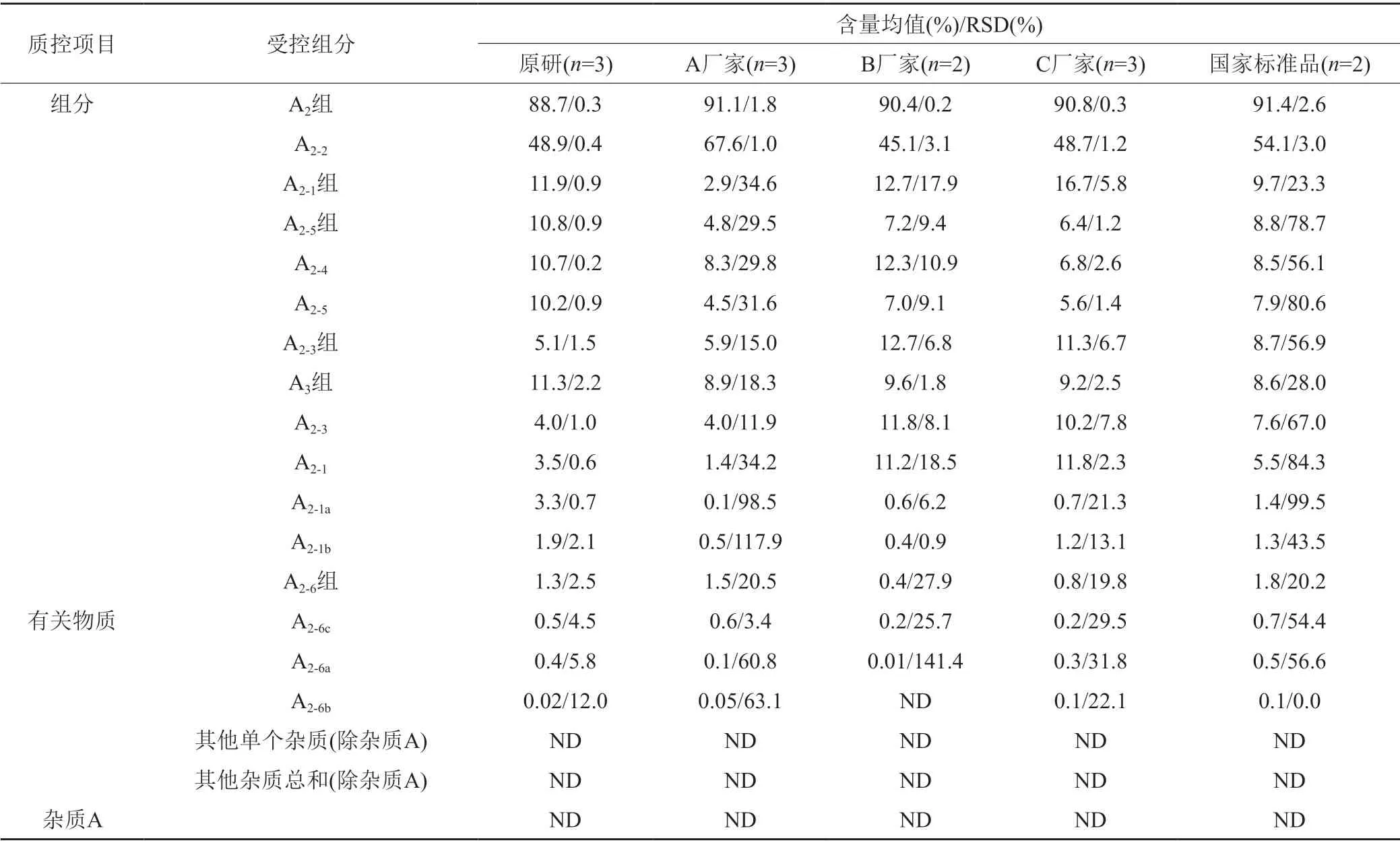
表4 不同來源的替考拉寧組分和有關物質含量Tab.4 Teicoplanin components and related substances content from different sources
根據各國藥典中對替考拉寧及其有關物質的質控限度規定:全部樣品均可符合JP17/ChP2020的限度要求;除A廠家的3批樣品外,其他樣品均可符合EP7.0/BP2010的限度要求;僅參比制劑的全部批次樣品可符合EP10.0/BP2020的限度要求。
2.2 國內外質控差異可能對多組分抗生素注射劑一致性評價產生的影響
理想的一致性評價首先需選擇參比制劑。鑒于在人用藥品注冊技術要求國際協調會議(ICH)成員國上市的原研藥物通常均通過了嚴格的臨床試驗,且處方明確,工藝相對穩定,因此,常作為參比制劑的首選[4]。但對于多組分抗生素而言,國產仿制產品的組分構成及其相對比例是否均須與參比制劑保持高度一致?
據文獻報道,在日本上市的注射用萬古霉素和替考拉寧仿制藥,其在實際治療中抗菌活性較原研產品分別低約14.6%和17.3%[22]。通過進一步研究,可能導致國產仿制注射用萬古霉素較原研制劑活性偏低的原因有以下兩個方面:一方面是原研制劑的裝量通常較國產制劑的裝量約高13%[23];另一方面,萬古霉素雖為單組分抗生素,但其來源于生物發酵,產品中的小組分/雜質可以與萬古霉素B競爭結合萬古霉素靶位,導致療效降低[24],而國產注射用鹽酸萬古霉素中萬古霉素B的含量較原研產品約低2%~3%[23]。目前,影響注射用替考拉寧臨床療效的原因尚未見相關文獻報道。但對于多組分抗生素如慶大霉素和替考拉寧等,不同的組分對特定致病菌可能表現出不同的抗菌活性[25-26]。已有文獻報道,當采用某一特定評價模型時,若仿制藥與參比制劑的組分構成及其相對比例間存在差異時,可能導致表現出不同的抗感染效果[27],雖然其提示在對特定的患者治療時候,可能出現療效不一致的現象,但這種差異可能在治療其他致病菌的感染時呈現出完全不同的治療效果[4]。鑒于多組分抗生素的組分差異客觀存在的事實基礎,在對此類品種開展一致性評價過程中,應盡量明確各組分的毒/活性特點,并關注各組分對臨床耐藥菌的有效性,更為全面、客觀地對仿制藥和參比制劑在實際臨床療效/安全性間的差異進行評價,而并非在組分構成及其相對比例上追求與參比制劑保持絕對一致。ChP2015年版在修訂硫酸慶大霉素及其注射液標準時便體現出了這一思路[28],ChP2015并不鼓勵通過提高C1a組分(理論效價最高的組分)的比例來提高產品的效價,而是希望通過對無效組分/雜質的控制,提高總組分的含量來提高產品的效價[25]。對于替考拉寧品種而言,從實現臨床療效一致性角度出發,在評價過程中建議重點關注:除結構已明確的有效組分外,是否還存在有其他結構未知的有效組分,特別是對于臨床耐藥菌有效的其他組分;此外,現有A2組中5個主要組分(A2-1~A2-5)間的相對比例變化是否會引起臨床療效的顯著變化,如存在顯著差異,則應在保證療效一致的前提下盡量明確相對比例間可接受的變化范圍等。
除合理評估國產仿制藥與參比制劑療效/安全性的一致性外,如何保證產品質量的持續一致性是另一需要完善的關鍵性問題。基于質量源于設計(quality by design,QbD)理念,通常目標產品的質量可通過產品的關鍵質量屬性(critical quality attributes,CQAs)進行表征[29-30]。在一致性評價過程中,不僅應理解參比制劑的CQAs,還需明確參比制劑生產過程中涉及的關鍵原輔料屬性(critical material attributes,CMAs)和關鍵工藝參數(critical process parameters,CPPs),建立CMAs、CPPs和產品CQAs的關系,通過精準控制進而達到控制成品質量的目的[4]。根據此評價思路,就目前國產仿制注射用替考拉寧而言需要關注以下兩點。第一,各國產廠家樣品中不僅存在各組分/有關物質的構成及其相對比例與參比制劑間存在顯著性差異的情況,關鍵問題在于同一廠家內部不同批次間同一組分/有關物質的含量存在較大波動,提示:國產仿制注射用替考拉寧的CPPs與參比制劑存在差異的同時,各國產廠對各自現有CPPs的控制精準度亦與參比制劑存在顯著差距。第二,在處方上,部分國產注射用替考拉寧與參比制劑存在差異。參比制劑處方中含有約10%氯化鈉,部分國產注射用替考拉寧處方中并未明確標注含有氯化鈉成分,據ChP2020版中注射用替考拉寧中氯化鈉的含量規定為“不得過5.0%”,與替考拉寧原料項下保持一致[14],提示,制劑中氯化鈉來源為原料生產工藝引入而非制劑處方添加。在用法上,除常規靜脈滴注或肌注外,僅參比制劑提供3~5min靜脈推注的使用方式。保證其可直接靜脈推注給藥的前提正是參比制劑處方中含有約10%氯化鈉,使其按規定方法溶解后形成等滲溶液。此外,據文獻報道,等滲溶液在臨床中的應用,特別是對于兒童患者、正接受手術的低鈉血癥患者或在重癥加護病房(ICU)中的患者使用時更為安全[31-34]。建議在一致性評價過程中關注兩者在處方和用法上的差異。
3 結論
受諸多因素影響,多組分抗生素品種在組分/有關物質構成及其相對比例間不可避免的存在差異。建議在此類品種仿制藥一致性評價過程中應盡量明確:各組分的毒/活性特點,并關注各組分對臨床耐藥菌的有效性;各主要組分相對比例間的變化與臨床療效的相關性;關鍵原輔料屬性、關鍵工藝參數與關鍵質量屬性間的相互關系,以及其對產品質量持續可控產生的影響等。

