載藥微球聯合肝動脈化療栓塞術對原發性肝癌患者的療效觀察
代樹本,李海霞,王秀香,李 輝
滄州市第三醫院介入科,河北滄州 061001
原發性肝癌(PHC)居于我國惡性腫瘤第4位,死亡率位于第3位[1]。PHC惡性程度較高,早期沒有明顯癥狀,肝功能輕微受損,而大部分中晚期患者失去了外科手術指征。肝動脈化療栓塞術(TACE)是治療PHC非手術治療首選標準方式,經證實能縮小腫瘤體積,改善患者生存情況[2-3]。既往研究結果顯示,TACE療效并不穩定,PHC患者1年總體生存率為70.30%,2年為51.58%,3年為40.40%,5年僅有32.40%[4],亟待提升。載藥微球是一種新型技術,屬一種不可降解型載藥微球[5],它通過加載正電荷蒽環類化療藥并促使其緩慢釋放到病灶部位,進而輔助提升局部化療藥物濃度。目前關于載藥微球聯合TACE治療PHC的研究已有報道,但未能完全明確其療效。本研究探討載藥微球聯合TACE治療PHC的療效,現將結果報道如下。
1 資料與方法
1.1一般資料 選擇滄州市第三醫院2019年9月至2021年2月診治的134例PHC患者作為研究對象,使用隨機數字表法將患者分成C-TACE組及D-TACE組,每組67例。C-TACE組中男性40例,女性27例;年齡41~73歲,平均(58.50±4.15)歲;臨床分期(TNM):Ⅰ~Ⅱ期11例,Ⅲ~Ⅳ期56例;肝功能分級(Child-Pugh分級):A級59例,B級8例;病灶數目:多發20例,單發47例。D-TACE組,男性41例,女性26例;年齡40~77歲,平均(58.51±4.19)歲;TNM分期:Ⅰ~Ⅱ期10例,Ⅲ~Ⅳ期57例;Child-Pugh分級:A級61例,B級6例;病灶數目:多發22例,單發45例。兩組患者性別、年齡、TNM分期、Child-Pugh分級及病灶數目比較,差異均無統計學意義(均P>0.05),具有可比性。納入標準:(1)符合PHC規范化診治專家共識中相關診斷標準;(2)無肝外轉移;(3)患者知情同意;(4)預計生存期大于3個月。排除標準:(1)合并其他惡性腫瘤患者;(2)伴有心腦血管疾病患者;(3)合并門靜脈主干癌栓或梗阻性黃疸患者;(4)妊娠期、哺乳期患者;(5)嚴重癌因疲乏患者。本研究經滄州市第三醫院醫學倫理委員會審核批準(審批號:20BZX072)。
1.2治療方法 C-TACE組進行傳統TACE治療,治療期間隔4周,在數字減影心血管造影設備監測下,導管經右側股動脈插管進入腸系膜上動脈。造影后根據腫瘤大小及供血情況進行碘化油(上海萬代制藥有限公司,國藥準字H20064893,規格10 mL)栓塞治療,多次交替注射絲裂霉素(江蘇恒瑞醫藥股份有限公司,國藥準字H20023070,規格2 mg)10~15 mg、吡柔比星(浙江海正藥業股份有限公司,國藥準字H20045983,規格10 mg)20~40 mg、5-氟尿嘧啶(海南中化聯合制藥工業股份有限公司,國藥準字H20051627,規格0.5 g,按氟尿嘧啶計)500~1 000 mg。治療后7 d進行常規保肝治療。D-TACE組使用載藥微球聯合TACE治療,TACE治療方案同C-TACE組。載藥微球使用CalliSpheres微球(蘇州恒瑞迦利生物醫藥科技有限公司),在栓塞時向動脈內緩慢推注,直至達到栓塞終點。終點標準:腫瘤血管血流變緩,2~5個心跳造影劑消失。
1.3評價指標
1.3.1標本采集 治療前1 d及治療結束后6個月時抽取兩組患者外周肘靜脈血8 mL,3 000 r/min離心處理10 min,取上層血清保存待檢。
1.3.2肝功能指標檢測 使用全自動生化分析儀(NSA-400型,沈陽東軟醫療系統有限公司)檢測血清丙氨酸氨基轉移酶(ALT)、天門冬氨酸氨基轉移酶(AST)、總膽紅素(TBIL)水平。
1.3.3肝癌細胞活力指標檢測 使用酶聯免疫吸附試驗檢測血清甲胎蛋白異質體3(AFP-L3)、高爾基體跨膜糖蛋白73(GP73)、α-L-巖藻糖苷酶(AFU)水平。AFP-L3試劑盒(貨號EY2683)購于上海一研生物科技有限公司,GP73試劑盒(專利產品號200710107505.1)購于北京熱景生物技術有限公司。αAFU試劑盒(貨號FY-A014459)購于上海富雨生物科技有限公司。
1.3.4不良反應 統計兩組患者惡心嘔吐、發熱、腹痛發生情況。
1.3.5近期療效 治療結束后隨訪6個月時,采用實體瘤療效評價標準(mRECIST)評定近期療效。完全緩解(CR):肝癌腫瘤消失至少4個月。部分緩解(PR):肝癌腫瘤縮小50%及以上至少4個月。病灶穩定(SD):肝癌腫瘤縮小不足50%或增大不足25%。疾病進展(PD):肝癌腫瘤增大25%及以上,或者出現一個或多個肝癌新病灶。臨床總有效率=(CR例數+PR例數)/總例數×100%。

2 結 果
2.1兩組近期療效比較 D-TACE組臨床總有效率高于C-TACE組,差異有統計學意義(P<0.05),見表1。

表1 兩組近期療效比較
2.2兩組肝功能比較 治療前,兩組ALT、AST、TBIL水平差異均無統計學意義(P>0.05);治療后,D-TACE組ALT、AST、TBIL水平低于C-TACE組,差異均有統計學意義(P<0.05),見表2。
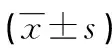
表2 兩組患者肝功能比較
2.3兩組肝癌細胞活力比較 治療前,兩組AFP-L3、GP73、AFU水平差異均無統計學意義(P>0.05);治療后,D-TACE組AFP-L3、GP73、AFU水平低于C-TACE組,差異均有統計學意義(P<0.05),見表3。

表3 兩組肝癌細胞活力比較
2.4兩組不良反應發生情況比較 D-TACE組患者不良反應發生率低于C-TACE組,差異有統計學意義(P<0.05),見表4。

表4 兩組不良反應發生情況比較
3 討 論
PHC發生機制較復雜,與多種因素有關,包括致癌基因、抑癌基因、吸煙、飲酒及遺傳。對于PHC治療以手術、栓塞為主[6-7]。中晚期不能進行手術的患者可以進行TACE治療[8-9]。多項研究表明,TACE為主的綜合治療可以延長中晚期PHC患者生存時間,改善生存質量[10-11]。既往研究表明,TACE在促使腫瘤完全壞死上的有效率可高達20%,對PHC患者療效較確切[12]。雖然TACE治療可以控制PHC發展,延長患者生命,但反復TACE治療會導致肝功能惡化,最終加重病情[13]。VOGL等[14]認為,TACE治療后肝癌組織會發生廣泛性缺氧,誘導血管內皮生長因子的激活和血管化,導致復發和轉移。故而本研究建議使用TACE聯合其他方式進行治療。目前市場上的載藥微球主要有生物降解型、非生物降解型兩種,我國臨床主要使用非生物降解型微球[15-16]。HepaSphere微球從藥代動力學上可獲得良好的栓塞效果,且釋放藥物能力突出。CalliSpheres載藥微球是一種新型藥物運輸系統,通過向腫瘤體內注入相對大劑量的化療藥物,可以延遲藥物釋放時間,減少化療藥物進入全血系統引起的不良反應,可以同時發揮栓塞劑的栓塞作用和化療藥物的局部毒性,腫瘤的局部反應明顯優于TACE。本次治療使用50~100 μm 規格HepaSphere微球,經加載藥物后其粒徑達到了200~300 μm。
李富永等[17]的研究發現,使用載藥微球聯合TACE治療后PHC患者AST、ALT及TBIL水平明顯降低,總有效率為89.47%,該研究得出PHC患者治療后的肝功能結果及近期療效與本研究一致。TACE可抑制肝癌細胞活力,誘導肝癌細胞發生凋亡。載藥微球具有較好韌性及可塑性,對腫瘤病灶供血血管的栓塞作用更好。載藥微球用于TACE能更有效地誘導肝癌細胞發生凋亡,進而抑制肝癌細胞活力,本研究中D-TACE組AFP-L3、GP73、AFU水平較C-TACE組低,也證實了該結論。同時,D-TACE組患者不良反應率為6.0%,明顯低于C-TACE組的25.4%(P<0.05),也低于蒲長宇等[18]報道的21.36%。常規TACE栓塞劑由碘化油及化療藥物混合而成,碘化油乳劑隨血液進入全身循環系統,從而增加了惡心嘔吐、發熱、腹痛等不良反應。同時病灶部位局部藥物濃度降低,腫瘤周圍側支循環沖刷碘化油,引起栓塞不徹底,進而影響預后效果。載藥微球配合TACE的加載藥物量大,能滿足治療需求,其位置相對固定,不易隨血流移動,既能提高腫瘤組織內的藥物濃度,延長化療藥物作用時間,也能減少相應化療藥物進入人體循環系統[19-20],減輕不良反應。
綜上所述,載藥微球聯合TACE治療PHC,既能改善肝功能,提升近期療效,又能抑制肝癌細胞活力,減輕不良反應。

