一種由對苯醌合成對苯二酚的工藝研究
潘學祥,王 芳,黃德奇,馮守佰,陳紹杰,劉紅紅
(1 揚州工業職業技術學院,江蘇 揚州 225127;2 江蘇揚農化工集團有限公司,江蘇 揚州 225009)
對苯二酚,又名氫醌,分子式為C6H6O2,白色針狀結晶,密度為1.328 g/cm3見光易變色,是苯的兩個對位氫被羥基取代形成的化合物。對苯二酚常溫下溶解度低,但易溶于熱水,溶于乙醚無味、乙醇、乙酸乙酯等溶液,微溶于苯[1]。受高熱分解易放出有毒氣體[2]。對苯二酚廣泛的應用于橡膠、染料、醫藥及農藥等相關化工領域[3-4]。對苯二酚主要用于制備蒽醌染料、偶氮染料、照相機的黑白顯影劑、涂料的抗氧化劑、橡膠單體的阻聚劑等。對苯二酚的合成工藝較多[5-7],包括Reppe法,苯胺法、苯酚和丙酮法等傳統方法,Reppe法為乙炔與一氧化碳在高溫高壓下,通過貴金屬Ru、Rh催化制備對苯二酚[8]。該法雖生產工藝簡單,副產物少,但貴金屬催化劑價格昂貴且難于回收造成生產成本高。苯胺法為在溫度5~8 ℃下加入由苯胺與硫酸配制成的苯胺硫酸鹽溶液后,加入錳漿溶液或重鉻酸鈉溶液,反應生成苯醌,將精餾出的對苯醌與鐵粉反應生成對苯二酚,該方法易于控制,且產率較高,但反應的副產物多,反應過程產生大量的錳鹽、鐵泥及硫酸鹽等廢液廢渣難以處理,不僅增加了生產成本同時也造成了環境污染[9]。丙酮與苯酚法又稱為雙酚A法,即苯酚與丙酮在鹽酸催化下反應生成雙酚A,向雙酚A中加入少許堿性催化劑,反應分解為苯酚與對異丙基苯酚,向分離出的對異丙基苯酚中加入少量雙氧水,氧化生成丙酮和對苯二酚[10]。該方法雖然無三廢產生,但生成的反應中間體對異丙基苯酚易發生聚合,嚴重影響了反應的收率,故該法被淘汰。因此開發出一種綠色環保的合成工藝,用于替代上述反應工藝迫在眉睫。
一直以來人們都青睞于苯酚羥基化生成對苯二酚,利用有機溶劑乙腈溶解苯酚,在催化劑和氧化劑的共同作用下,生成對苯醌[11],向對苯醌中加入還原劑得到對苯二酚,苯酚氧化得到對苯醌的方法是20世紀70年代的時候開發出來的,杜邦公司曾采用過該法,苯酚氧化法最開始的氧化劑為氧氣,反應過程需要的氧氣壓力較高,后逐漸由過氧化氫取代了氧氣,如徐等[12]報道以有機硒為催化劑苯酚經雙氧水選擇性氧化得到對苯醌,而對苯醌的進一步還原,需要以氫氣為還原劑,在催化劑的作用下,對苯醌催化加氫合成對苯二酚[13],然而氫氣的易燃易爆特性阻礙了其進一步的發展,本文系統研究了對苯醌催化加氫的工藝,優化加氫的反應工藝,提升反應的安全性,并篩選了合適的加氫催化劑,系統研究了反應溫度壓力及加氫方式對對苯醌催化加氫反應的影響,通過工藝條件優化,提高了反應的安全性,確定最佳合成工藝條件,實現對苯二酚綠色合成的工藝目標。
1 實 驗
1.1 儀器和試劑
主要試劑:對苯醌(質量分數為99%);骨架鎳催化劑;氫氣;氮氣;Pd/C(Pd:5wt%);Pt/C(Pt:5wt%)。
主要儀器:WHF-0.5高壓反應釜,威海自控;GC 2010 Pro氣相色譜儀,島津;N-1300旋轉蒸發儀,東京理化。
1.2 合成方法
1.2.1 綠色合成工藝研究
釜式反應:將5 g對苯醌溶于95 mL的溫水配成對苯醌水溶液加入到高壓反應釜內,按對苯醌:催化劑=100:1的質量比將催化劑加入到高壓反應釜內,加入密封反應釜,通入氮氣置換出釜內空氣,通入氫氣后,保持壓力在1.5 MPa,攪拌升溫在90 ℃下反應3 h。反應結束后冷卻降溫,排氣,過濾回收催化劑,同時檢測產物的收率及純度。
固定床反應:將對苯醌與溫水混合,配制成5%的對苯醌水溶液,將制備的骨架鎳催化劑造粒成4 mm的小球,裝天道固定床中,將反應裝置經過氮氣吹掃后,通入反應液,待反應液持續通入3 min后,向反應裝置中通入H2,在壓力為1.5 MPa,反應溫度為90 ℃下,考察反應30 min后對苯醌的轉化率及對苯二酚的收率。
超重力催化反應:將對苯醌與溫水混合,配制成5%的對苯醌水溶液,將制備的骨架鎳催化劑造粒成4 mm的小球,裝填入無擋板樹脂填料中,制備出填裝式催化劑填料,將反應裝置經過氮氣吹掃后,通入反應液,待反應液持續通入3 min后,向反應裝置中通入H2,在壓力為1.5 MPa,反應溫度為90 ℃下,考察反應30 min后對苯醌的轉化率及對苯二酚的收率。各種催化劑的合成是通過文獻相關方法合成。
2 結果與討論
2.1 催化劑對對苯醌催化加氫反應的影響
在催化劑作用下,對苯醌催化加氫的反應方程式如圖所示。反應體系中氫氣擴散至催化劑表面,被催化劑吸附并被活化為氫原子;被吸附在催化劑表面的對苯醌擴散到活性位點形成化學吸附,被吸附的對苯醌與活化后的氫原子發生親核加成反應,生成對苯二酚,生成的對苯二酚分子在活性位點進行解吸,進一步的由催化劑表面發生擴散并分離。氫氣催化加氫反應工藝的關鍵就是催化劑的選擇,不同的催化劑的選擇決定了反應物傳質速度和反應物化學吸附的速率。常用的還原醌類化合物的催化劑主要包括Pd/C、Pt/C、骨架鎳催化劑等。
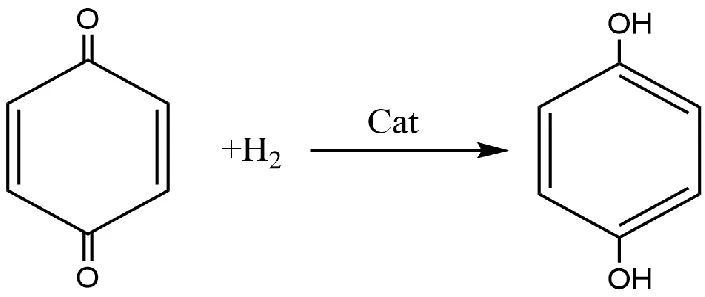
對苯醌與催化劑的投料比為100:1,反應溫度為100 ℃,反應時間3 h,進行不同催化劑催化效果對比研究,實驗結果見表1,如表1所示,在未加催化劑的條件下,對苯醌亦可在該反應條件下轉化為對苯二酚,該反應下對苯醌的轉化率為28.7%,采用貴金屬類催化劑Pd/C和Pt/C參與反應后,對苯二酚的收率較高,但貴金屬催化劑不僅價格昂貴,循環使用活性位點易中毒,活性下降快,使用壽命短,鎳基催化劑原料易得,催化加氫性能優異,故選擇了兩種鎳基催化劑,從表中可知使用鎳基催化劑時對苯醌轉化率和對苯二酚收率都得到顯著提高,同時負載型骨架鎳催化劑的催化性能與Pt/C催化劑的性能相當,故選擇負載型骨架鎳催化劑進行反應。
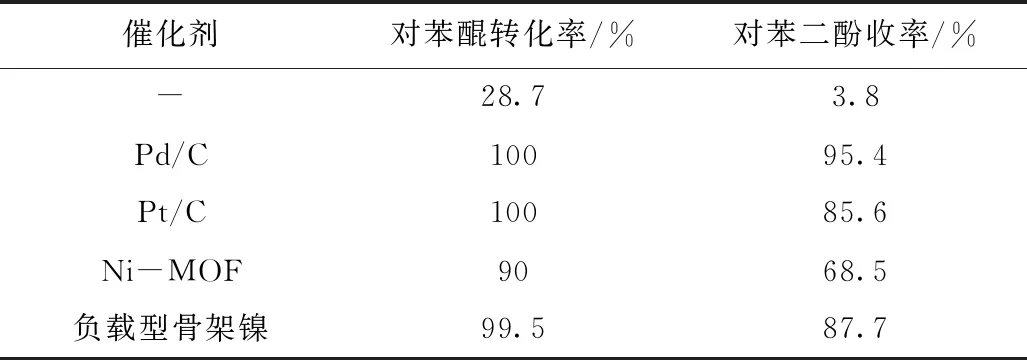
表1 催化劑種類對對苯醌加氫反應的影響
2.2 反應壓力及溫度對對苯醌催化加氫反應的影響
對苯醌催化加氫反應過程中,反應壓力不同,我們考察了不同反應壓力下,釜式反應中對苯二酚收率的變化,由圖1可知以骨架鎳為催化劑還原對苯醌,對苯二酚的收率隨著氫氣反應壓力的增大逐漸升高,當達到一定壓力后對苯二酚的收率基本不變。當反應壓力較低時,氫氣的壓力對反應速率的影響較為顯著,隨著壓力的升高,體系內催化劑吸氫速率加快,反應轉化率提高,當反應壓力逐漸升高時,反應體系內氣-液-固三相達到平衡,活化后的氫原子數量增加,利于反應的正向進行,當氫氣的反應壓力為1.5 MPa時反應轉化率基本不發生變化,故氫氣壓力為1.5 MPa時,反應轉化率最佳。
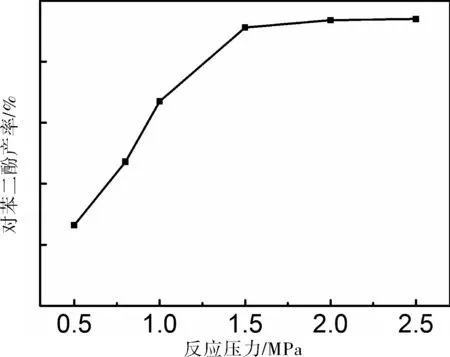
圖1 氫氣壓力對對苯二酚收率的影響
根據對苯醌還原反應的機理,當反應溫度過低時,不但影響對苯醌在水中的溶解度,同時會影響反應的轉化率,當反應溫度過高時,反應的選擇性下降,反應中出現了過度氫化的副產物,因此通過改變反應溫度來研究溫度對對苯醌催化加氫反應的影響情況。對苯醌與骨架鎳催化劑的投料比為100:1,反應壓力1.5 MPa,反應時間3 h,進行不同溫度反應對比研究,實驗結果見表2。如表2所示,在溫度低于90 ℃時,隨著反應溫度的升高,對苯二酚的收率明顯提高,在此階段,溫度升高催化劑的活性提高,有利于對苯醌的充分溶解分散,有利于反應的正向進行。當溫度為90 ℃時,對苯二酚的收率達到最佳。表明此時催化劑活化性能與主反應的選擇性達到最佳。當溫度高于90 ℃時,催化劑過度活化,導致副反應增多,同時該反應為放熱反應,過高的溫度抑制了反應的正向進行,對苯二酚的選擇性下降,主反應的收率出現下降趨勢。因此反應的最佳溫度為90 ℃。

表2 不同反應溫度對對苯醌加氫反應的影響
2.3 不同反應方式對對苯醌催化加氫反應的影響
為了更好地提高反應的轉化率,我們采用了不同的加氫催化反應方式,分別探究了固定床反應、超重力催化反應器進行催化加氫反應的影響。為了更好地對比反應效果,三種不同方式采用的催化劑為負載型骨架鎳造粒后的顆粒,反應結果如表所示。由表可知,采用造粒后的催化劑進行釜式反應,對苯醌的轉化率為92.3%,對苯醌的收率為84.3%,而采用超重力催化反應裝置進行反應,對苯醌的轉化率能達到100%,對苯二酚的收率可達到98%以上,采用固定床反應器進行反應,可以保證反應液充分的與催化劑接觸同時控制氫氣的流速,保證反應物在床層的停留時間,有利于提高反應的轉化率和選擇性。采用超重力催化反應器,在反應過程中模擬超重力環境,使流經轉子催化劑填料的流體形成大量的微米級到納米級的液滴及液膜,有利于提高反應中反應物與催化劑的接觸面積和界面更新速率,進一步強化不同相間的傳質和混合效果,同時采用超重力反應器反應可以減少氫氣的消耗量,精準控制氫氣的進入量,提高反應體系的安全性。同時采用超重力催化反應裝置進行反應可以大大縮短反應時間,采用釜式反應需3 h,而采用超重力反應器反應30 min后,反應轉化率達到987%,且為連續性出料。
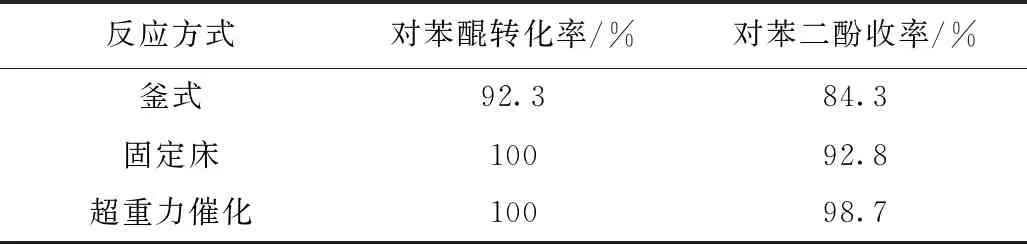
表3 不同反應方式對對苯醌加氫反應的影響
3 結 論
以對苯醌為原料,負載型骨架鎳為催化劑進行催化加氫反應制備對苯二酚,經工藝條件優化后其最佳反應條件為采用超重力催化裝置,在壓力為1.5 MPa,溫度為90 ℃條件下進行連續化反應,在該條件下反應3 h后對苯二酚的收率可達到98.7%。

