綜合創新實驗“電催化還原二氧化碳”的教學探索*
張魯華,丁曉墅,于豐收
(河北工業大學化工學院,天津 300401)
1 該實驗進入課程教學的重要性和價值
近年“生態優先、綠色發展”的新理念對化工行業發展提出了新要求,綠色低碳化工也成為適應時代要求的化工生產基本趨勢。電化學合成方法因其反應條件溫和、環境污染小、原子經濟性好等優點[1],已成為綠色化工典范,在氯堿工業、霍爾-埃魯法合成鋁工業及其他有機物合成中得到廣泛應用[2]。眾所周知,人才是技術、經濟發展的首要資源,這就要求化工類專業教育應與化工產業發展緊密聯系、互相支撐。目前電化學專業相關的學生通過前期專業導論課、專業基礎課、專業實驗等課程的學習,已經掌握了電化學合成的基本原理,具備了文獻檢索和總結歸納的能力[3-4]。但是面對工業生產中的工藝路線或者科學研究中電化學相關的測試評價裝置時,學生又很難將所學的電化學理論知識融會貫通地與實際操作進行有機銜接[5]。因此,如何通過設計實驗,增強學生的工程實踐能力,幫助學生樹立綠色化工理念,成為專業教育需要解決的問題。
氣候、能源問題已成為全社會關注的焦點問題,當代大學生對此也頗感興趣。2020年9月,習近平主席在第75屆聯合國大會上承諾中國將2030年前實現碳達峰,2060年實現碳中[6]。在此背景下,以電能為驅動力,在溫和條件下將CO2直接轉化為高附加值化學品的電催化還原CO2方法,同時實現了CO2資源化利用和潔凈電能的有效存儲,有望成為CO2規模化利用技術之一[7]。目前電催化還原CO2作為前沿的科研問題,僅是研究生的課題,相關實驗方法在本科生教學中仍鮮有報道。本文設計了一個綜合創新實驗,以國內外前沿的電化學相關課題:電催化還原CO2為基礎,通過設計合理電化學實驗,將目前的研究現狀、研究成果以及實驗方法融入到本科生的課堂教學中,希望在加深學生對電化學基本原理認識的同時,不斷提高學生的動手能力和工程實踐能力,牢固樹立綠色化工的理念。
2 實驗設計思路
如圖1所示,實驗設計環節遵循“學習-實踐-再學習”原則,充分考慮到對學生的知識運用和能力培養。完整的實驗方案,可促進多方面知識融合,使學生多方面能力得到鍛煉。

圖1 實驗設計環節與知識運用、能力培養對應關系
3 教學過程設計
該實驗項目將通過24學時完成,教學過程分為以下4部分:
(1)理論課講授。通過2學時的課上講授,讓學生了解該實驗的目的、基本的實驗原理、催化劑的設計思路、性能評價方法等。
(2)制定實驗方案。學生通過查閱文獻,提出實驗方案;教師審核學生的實驗設計,與學生討論互動,確定最終合理的實驗方法;教師根據學生的方案,進行實驗前的相關準備。
(3)開展實驗。實驗部分通過22學時完成:1)實驗前安全教育教育必不可少,包括實驗室基本安全規范、藥品的安全使用、以及實驗設備的正確操作,共計4學時;2)催化劑制備2個學時,性能測試8個學時,催化劑循環性能測試8個學時,各環節可以交叉進行。實驗涉及步驟較多,可將學生按每組3-5人分組,確保每位學生都能體驗每項操作。
(4)總結實驗和撰寫報告。實驗結束后,要求學生按照科技論文寫作要求,撰寫論文。
4 實驗的完整示例
4.1 實驗目的
(1)掌握電化學性能表征的基本手段及催化劑性能的評價方法;
(2)熟悉實驗室常規儀器的操作規范和使用方法;
(3)練習文獻檢索能力,實驗總結能力,提高論文寫作水平。
4.2 實驗原理
當電解質溶液不含底物CO2和其他可以被電活化的小分子例如O2時,質子還原反應(hydrogen evolution reaction, HER)是工作電極表面唯一可能發生的反應。當溶液中存在CO2時,除了HER,電極表面還會發生CO2還原反應(carbon oxide reduction reaction,CO2RR)。與HER類似,CO2還原反應同樣始于CO2分子在催化劑表面吸附。然后,經過多步質子耦合電子轉移過程,最終生成還原產物,如CO、HCOOH、CH4、C2H4等[8-9]。無論是HER還是CO2還原反應,都需要源源不斷地得到電子。這意味著,需要在對電極發生氧化反應,以補償還原反應消耗的電子。通常以水氧化反應(oxygen evolution reaction, OER)作為對電極補償反應,為工作電極還原過程提供電子。
4.3 實驗方法
由于催化劑的制備和表征過程涉及多種實驗室儀器設備,而且合成過程耗時較長。因此,催化劑由商業化的Ag片替代。接下來的實驗分為電解池組裝和電化學性能測試兩部分。
4.3.1 電解池組裝
本實驗采用的H-型電解池分為工作電極和對電極兩室,兩個腔室中的電解質通過Nafion膜分離(見圖2a)。測試過程中采用銀片作為催化劑(工作電極),以Ag/AgCl作為參比電極、鉑絲作為對電極。采用密封測試系統進行測試,需要保證電解池的氣密性。電解池組裝過程如圖2b所示:每組取一個H-電解池,將尺寸合適的Nafion 117質子膜放于電解池中間,用夾子加緊;工作電極室裝入工作電極和參比電極,對電極室裝入對電極;向兩個電極室分別加入35 mL的0.1 M KHCO3電解液,并通入N2保持20 min。
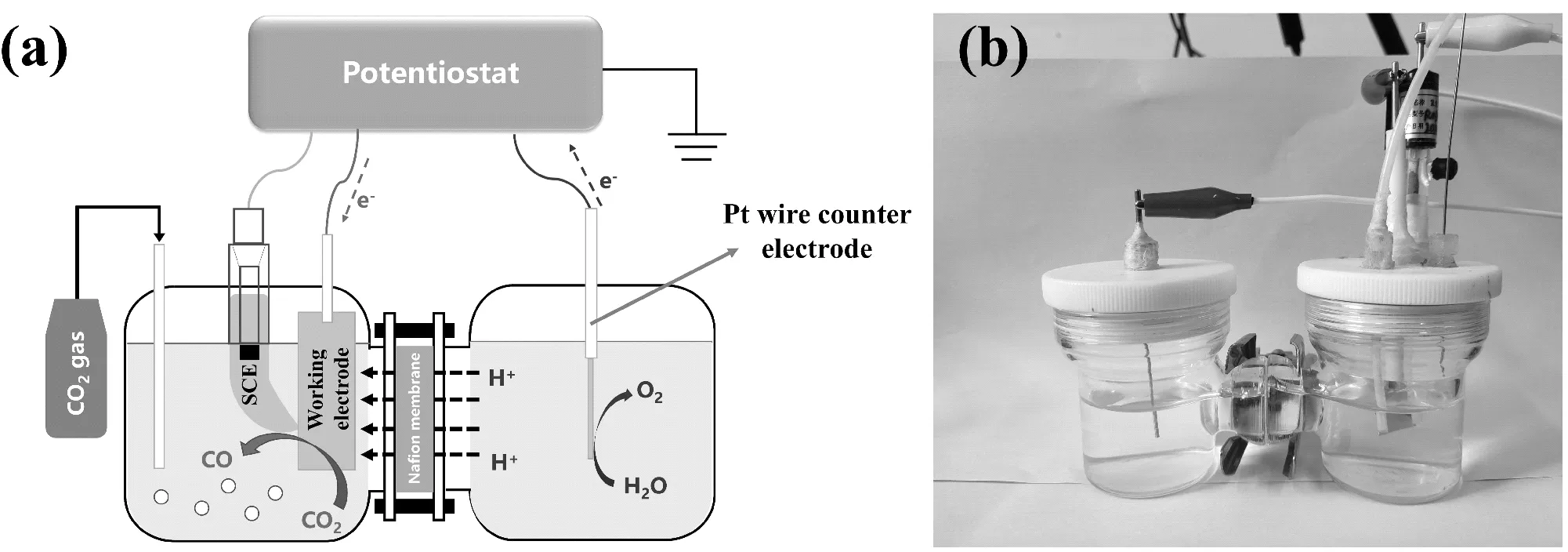
圖2 電化學還原CO2裝置示意圖(a)及其H-型電解池(b)
4.3.2 電化學性能測試
利用電化學工作站測試CO2還原性能,包括以下測試方法:
(1)線性掃描伏安曲線(LSV)測試
打開電化學工作站軟件,選擇LSV模式,設置起始電位與終止電位,掃速為0.05 V/s,并將三電極與電解池對應連接,測試得到N2氛圍下的LSV曲線;通入CO2并保持20 min使電解液達到飽和,重復上述步驟,得到CO2氛圍下的LSV曲線;對比N2與CO2氛圍下的LSV曲線,從而確定恒電位電解電位區間(見圖3a)。
(2)恒電位電解測法拉第效率(FE)
如3a圖所示,CO2氛圍下的電流密度在-0.4 Vvs. RHE明顯高于N2氛圍下的電流,說明在該電位下Ag電極開始活化CO2。從-0.4 Vvs. RHE開始,每隔0.1 V取6~8個電位,進行恒電位電解實驗。選擇電化學工作站軟件的i-t模式,設置相應的電解電壓,電解時間20 min(圖3b)。電解實驗結束后收集電解產物,利用氣相色譜定量分析產量,根據公式1計算不同電位下產物法拉第效率,得到圖3c。
計算不同電壓下各還原產物的FE。還原產物CO或H2的FE計算公式如下:
(1)
式中:Q是總電荷數,C;VCO2是密閉電解池中空腔體積,mL;C是氣體產品濃度,ppm;n是生成還原產物轉移的電子數;t是電解時間,s。
(3)催化劑穩定性評價
除了電化學CO2還原活性外,電化學穩定性也是評價電催化劑的重要指標。如圖3d所示,Ag電極在-0.7 Vvs. RHE電位下電解8 h,CO的法拉第效率仍能保持在90%以上。
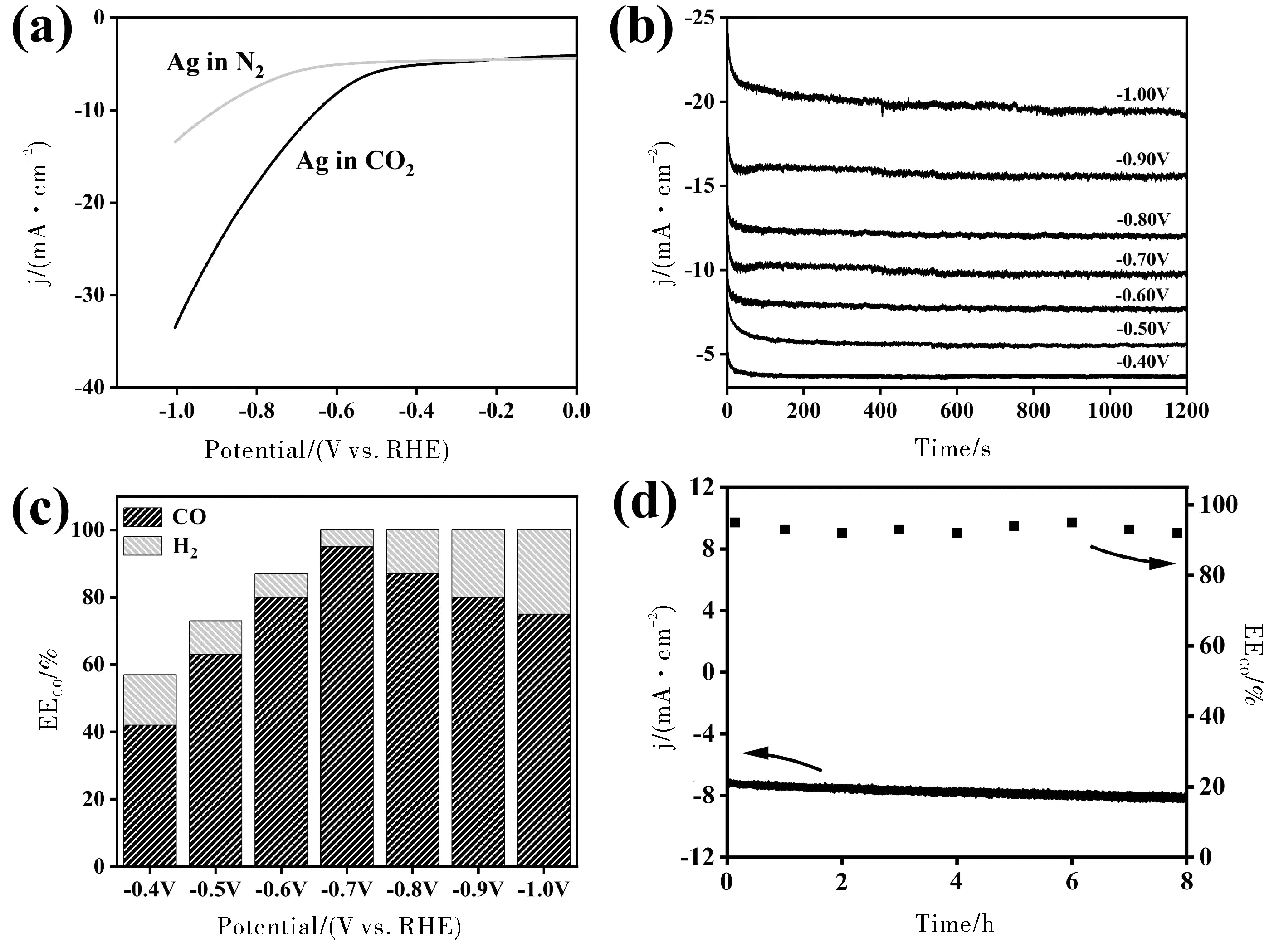
圖3 Ag電極(a)LSV曲線;(b)i-t曲線;(c)法拉第效率;(d)穩定性測試
5 結 語
本文將科學研究前沿課題:電化學還原CO2,引入本科生教學實驗中,介紹了電解池設計基本方法,催化劑性能評價方法等,改變了以往課程理論性強、知識點抽象、學生聽課效率低的不足,激發了學生的學習興趣。通過調整課程內容、優化作業及考核方式等對課程教學提出教學探索,力圖搭建應用化學課程由理論到實踐的橋梁,以及激發工科學生的創造力,響應“產教融合”教學改革,為國家培養專業性人才有一定的指導意義。將來會繼續遴選易于操作的前沿課題,凝練成綜合實驗,給予學生更多選擇,以開闊創新思維、提升創新能力。

