GSK3β、TLR-4在早期胃癌患者中的表達及與Hp感染的相關性探究
包華鑫 孫元鵬
早期胃癌主要是指胃癌浸潤深度在胃黏膜層或者是黏膜下層,研究結果顯示早期胃癌患者5年存活率達90%以上,目前我國早期胃癌患者發現率較低,大部分患者一旦發現已經處于晚期,雖然我國手術、放療、化療效果不斷提升,但是胃癌患者5年生存率只占40%[1-2]。臨床中關于胃癌發病機制尚不明確,公認幽門螺桿菌(Helicobacter pylori,Hp)感染是導致胃癌發病的主要原因[3]。Toll樣受體(Toll-like receptors,TLR)家族屬于一種模式識別受體,在機體免疫中發揮調節適應免疫作用,參與多種炎癥相關惡性腫瘤發生、發展過程,在細胞損傷、組織重構及修復過程中常常作為傳感器[4-5]。糖原合成酶激酶 -3β(glycogen synthase kinase-3β,GSK-3β)作為一種絲氨酸/蘇氨酸蛋白激酶其具有多功能作用,參與糖代謝、細胞增殖、凋亡等過程,并且在多種腫瘤中顯示異常表達[6]。目前缺少GSK3β、TLR-4表達與胃癌Hp感染的相關研究。鑒于此,本研究回顧性分析海安市中醫院收治的94例早期胃癌患者臨床資料,探討GSK3β、TLR-4表達與早期胃癌患者Hp感染的關系。
1 資料與方法
1.1 一般資料
本文選取2018年11月-2020年11月在本院就診的早期胃癌患者94例,納入標準:患者均經過胃鏡、病理學檢查確診為胃癌;患者臨床分為Ⅰ、Ⅱ期;患者均符合文獻[7]中華醫學會消化內鏡學分會制定的中關于早期胃癌的診斷標準。排除標準:合并其他惡性腫瘤;進行放療、化療抗腫瘤治療;妊娠期、哺乳期患者;精神異常;合并其他感染性疾病;近1個月服用抗生素、質子泵抑制劑、鉍制劑等藥物。早期胃癌患者中,男60例,女34例,年齡 35~70 歲,BMI 21~26 kg/m2;其中 Hp 感染陽性40例為陽性胃癌組,Hp感染陰性54例為陰性胃癌組。選取同時期在本院健康體檢正常志愿者30例為對照組,男20例,女10例,年齡32~70歲,BMI 20~25 kg/m2。三組性別、年齡、BMI、胃癌家族史等臨床基線資料比較,差異無統計學意義(P>0.05),見表1。陽性胃癌組與陰性胃癌組病灶直徑、病灶位置等基線資料比較,差異無統計學意義(P>0.05),有可比性,見表2。本文研究患者及其家屬均知情,簽署知情同意書,研究經過本院倫理委員會批準。

表1 三組臨床基線資料比較
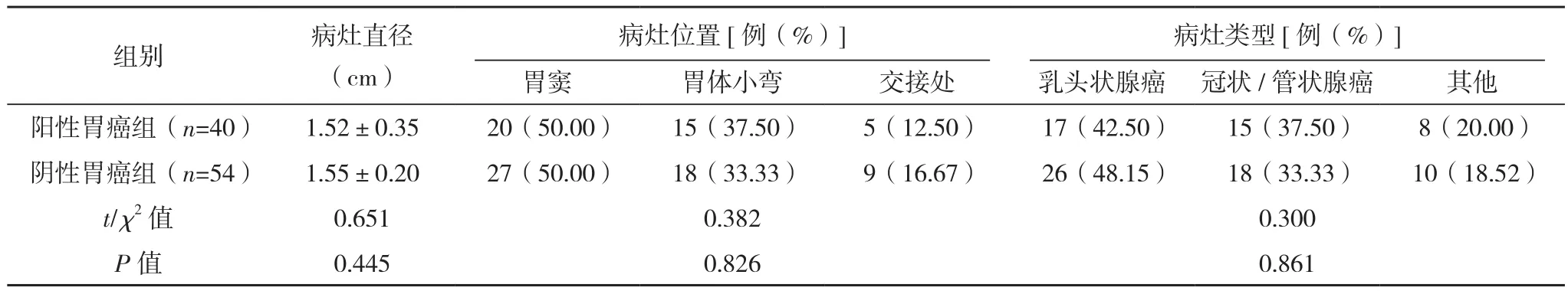
表2 陽性胃癌組與陰性胃癌組基線資料比較

表2(續)
1.2 方法
采用13C呼氣法檢測患者Hp感染:患者在檢查前1個月停止服用抗生素、質子泵抑制劑、鉍制劑等藥物,在患者空腹下進行,檢查前患者先在集氣袋中吹氣,之后口服13C膠囊,25 min后,患者向另一個集氣袋中吹氣,通過13C檢測呼吸儀觀察患者Hp感染結果。采集三組研究對象入院當天空腹肘部靜脈血 3 ml,2 000 r/min 離心處理 5 min,轉速為 2 000 r/min 離心干預 5 min,-20 ℃保持。采集到的血液標本,通過1 000 r/min離心處理后提取沉淀,滴加裂解液、反復凍融后,120 000 r/min離心處理,提取上清液,采用酶標儀檢測GSK3β、TLR-4蛋白濃度,保存。滴加10%的分離膠,封閉,吸干水分,給予5%的濃縮膠灌注,凝固后,將其在電泳槽中固定,加5μl Marker、變性蛋白樣品,電泳干預30 min,待蛋白分離膠底,結束電泳;轉膜成功后將硝酸纖維素膜(nitrocellulosefilter membrane,NC)膜在5%的脫脂奶粉中封閉固定1 h,加一抗(GSK3β、TLR-4 1∶1 000)孵育,經過震蕩洗膜后加二抗(GSK3β、TLR-4 1∶10 000),孵育,再次震蕩洗膜,使用紅外熒光成像系統對結果給予分析。以GAPDH為內參。
1.3 統計學處理
采用SPSS 25.0軟件進行數據處理。計量資料以(±s)表示,組間兩兩對比采用獨立樣本t檢驗,三組間比較采用方差齊性檢驗;以率(%)表示計數資料采用χ2檢驗。采用受試者工作特征(receiver operator characteristics,ROC)曲線分析GSK3β、TLR-4對早期胃癌患者Hp感染的預測價值;相關性采用Spearman分析;P<0.05為差異有統計學意義。
2 結果
2.1 GSK3β、TLR-4表達比較
與對照組相比,陽性胃癌組、陰性胃癌組GSK3β表達高,TLR-4表達低,差異有統計學意義(P<0.05);與陰性胃癌組相比,陽性胃癌組GSK3β表達高,TLR-4表達低,差異有統計學意義(P<0.05),見表 3。
表3 三組GSK3β、TLR-4表達比較(±s)
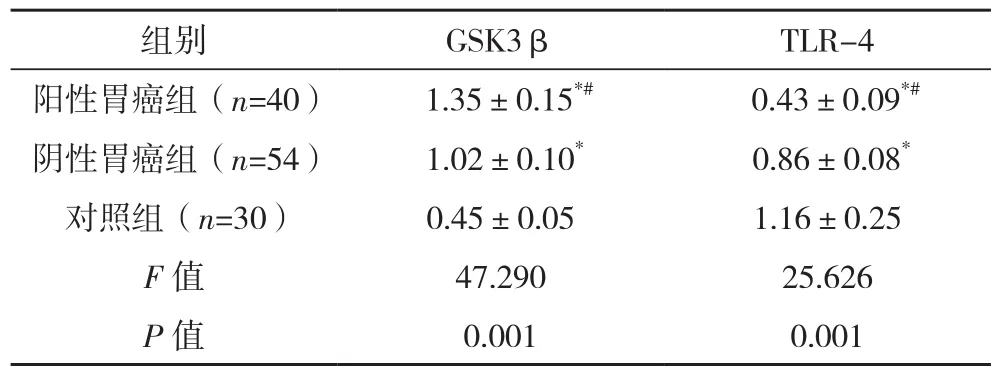
表3 三組GSK3β、TLR-4表達比較(±s)
*與對照組相比,P<0.05;#與陰性胃癌組相比,P<0.05。
組別 GSK3β TLR-4陽性胃癌組(n=40) 1.35±0.15*# 0.43±0.09*#陰性胃癌組(n=54) 1.02±0.10* 0.86±0.08*對照組(n=30) 0.45±0.05 1.16±0.25 F值 47.290 25.626 P值 0.001 0.001
2.2 GSK3β、TLR-4對早期胃癌患者Hp感染的預測價值
ROC曲線分析血清GSK3β、TLR-4預測早期胃癌患者Hp感染的曲線下面積(area under the curve,AUC) 分 別 為 0.745(95%CI:0.648,0.842,P=0.001)、0.721(95%CI:0.619,0.821,P=0.001),見表4、圖1。

表4 GSK3β、TLR-4診斷早期胃癌患者Hp感染的效能
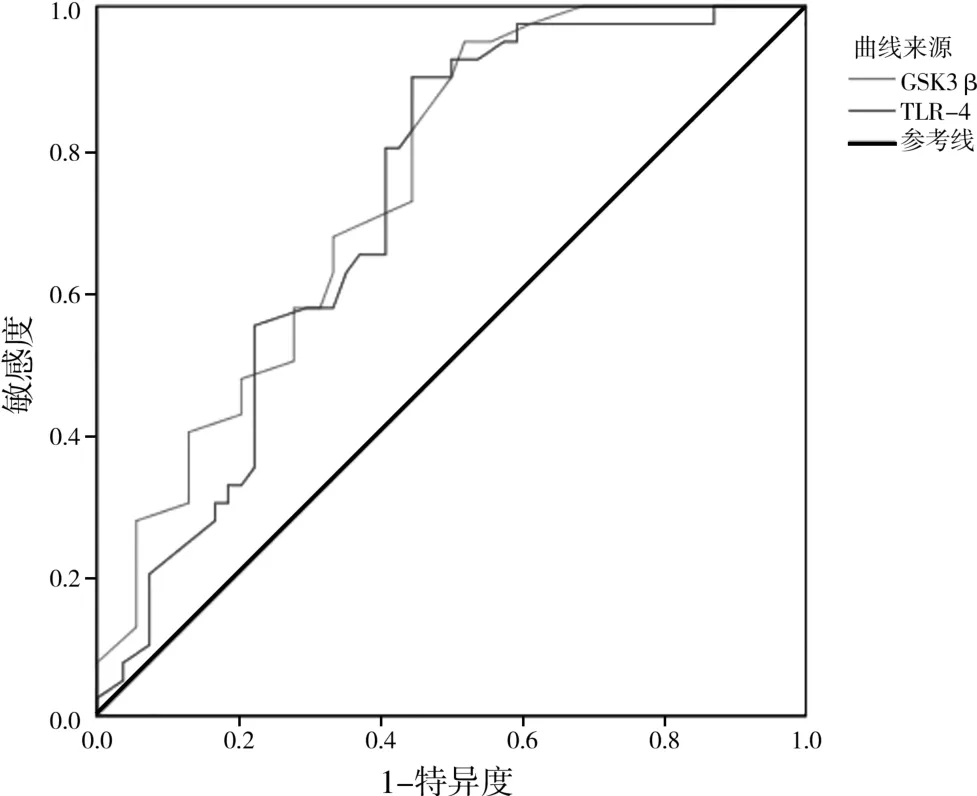
圖1 GSK3β、TLR-4診斷早期胃癌患者Hp感染的ROC曲線
2.3 GSK3β、TLR-4表達與早期胃癌患者Hp感染的相關性
采用Spearman相關性分析,以1表示Hp感染為陰性,以2表示Hp感染為陽性。GSK3β表達與Hp感染呈正相關(r=0.483,P=0.001);TLR-4表達與Hp感染呈負相關(r=-0.538,P=0.001)。
3 討論
大部分早期胃癌患者臨床表現不明顯,所以導致早期胃癌患者檢出率較低,在臨床中主要通過胃鏡直接觀察患者胃黏膜狀況,診斷胃癌的金標準是病理組織學檢測,但是其具有侵入性、價格高等缺點,部分患者依從性、耐受性較差,因此選擇操作簡單、無創、敏感性高的檢查手段對患者來說至關重要[8-9]。本研究通過ROC曲線,GSK3β、TLR-4表達均與早期胃癌患者Hp感染的獨立相關,提示GSK3β、TLR-4表達可以作為臨床預測早期胃癌Hp感染的預測指標。
Hp在患者胃黏膜損傷中屬于一種攻擊性因子,一旦革蘭陰性菌發生繁殖和崩解會釋放大量的脂多糖,將免疫系統激活,發揮著雙重作用:一方面對感染有一定的抵御作用;另一方面是對組織產生一定的損傷[10-11]。Hp感染導致癌癥發生的途徑較多,主要是加快硝酸鹽向亞硝酸鹽轉變進程,從而將胃黏膜環境改變,產生大量的細胞毒素相關基因A(CagA)、空泡毒素A(VacA)等毒性物質[12]。
研究數據顯示,在腫瘤細胞中有TLRs表達,TLRs信號參與腫瘤免疫逃逸、發展過程,與機體炎癥反應及免疫調節相關[13]。TLR-4主要存在于巨噬細胞、自然殺傷細胞、淋巴細胞等多種免疫細胞表面,發揮免疫作用。本研究中陽性、陰性早期胃癌患者血清TLR-4表達較高,其中陽性早期胃癌患者TLR-4表達高于陰性早期胃癌患者,提示早期胃癌患者TLR-4表達異常是導致早期胃癌患者Hp感染的危險因素,增加Hp感染風險。胃癌細胞不斷增殖會導致大量正常細胞發生壞死和凋亡,釋放大量的TLRs配體,TLRs會對腫瘤細胞產生刺激,死亡細胞發生“sterile”炎癥反應,導致患者病情不斷發展[14-15]。Li等[16]研究認為,在胃黏膜細胞表面存在的TLR4 mRNA能激活Hp的脂多糖介導轉換生長因子β活化酶發生磷酸化,提示Hp通過調節TLR4信號轉導,引起慢性萎縮性胃炎胃黏膜表面上皮細胞壞死速度加快。本研究ROC分析顯示TLR-4預測早期胃癌Hp感染的AUC達0.721,敏感度和特異度分別為92.50%、57.40%,提示血清TLR-4可用于評估早期胃癌Hp感染發生風險。
在腫瘤研究結果中,GSK-3β在Wnt/β-catenin、PI3K/Akt等信號通路中均有重要的參與作用,對磷酸化/去磷酸化過程發揮活性調節作用[17-18]。也有研究指出GSK-3β具有雙向調節作用,GSK-3β通過調節p53基因促進腫瘤細胞凋亡,對正常細胞生長有一定的抑制作用;此外,通過對維持NF-κB表達,抑制腫瘤細胞生長,促進正常細胞生長[19]。本研究陽性胃癌患者血清GSK3β表達低于陰性胃癌患者和對照組,且GSK3β表達與早期胃癌患者Hp感染存在密切關系,提示血清CysC水平升高是導致早期胃癌患者Hp感染的危險因素。楊學麗等[20]研究指出,GSK3β低表達對胃癌細胞增殖有明顯的促進作用,加快解聚APC/GSK3β/β-catenin復合物,造成β-catenin在細胞核內不斷積聚、活化,導致胃癌不斷轉移、浸潤。本研究ROC曲線分析顯示GSK3β預測早期胃癌Hp感染的AUC達0.745,提示GSK3β是早期胃癌Hp感染的警示指標。
本文Spearman研究結果證實,TLR-4表達水平與Hp感染呈負相關。蔡兆根等[21]研究指出,在Hp感染胃黏膜上皮組織中TLR4陽性表達占83.53%,提示Hp感染與TLR4呈正相關,提示胃癌患者Hp感染伴隨TLR-4介導機體免疫應答發生。本文研究結果與其研究不一致,分析原因,本文旨在研究早期胃癌患者血清中TLR-4表達水平變化狀況,未研究患者免疫組化狀況。本文中,GSK3β表達水平與Hp感染呈正相關。
綜上所述,早期胃癌Hp感染患者GSK3β、TLR-4表達異常,GSK3β、TLR-4表達水平高低與Hp感染具有相關性,GSK3β、TLR-4是早期胃癌Hp感染的風險預測因子。

