左乙拉西坦緩釋片制備工藝研究*
楊 鑫,楊廣德,張繼業,徐 晶
(1.西安交通大學第二附屬醫院,陜西 西安 710004;2.西安交通大學醫學部藥學院,陜西 西安 710061;3.陜西省人民醫院,陜西 西安 710068)
我國癲癇總體患病率7.0‰,年發病率28.8/10萬,每年新增癲癇患者40 萬,其在我國已成為僅次于頭痛的第二大常見病[1-2]。左乙拉西坦(LEV)屬吡咯烷酮衍生物,主要用于治療局限性及繼發性全身性癲癇[3-5],高效低毒,口服吸收快且安全,生物利用度幾近100%,其藥物代謝動力學(簡稱藥代動力學)分布與抗癲癇藥物理想的動力學分布模型相似[6-7]。2008 年美國批準UCB 公司的左乙拉西坦緩釋片(levetiracetam,Keppra XRTM)上市。2006 年11 月原國家食品藥品監督管理局(SFDA)批準進口LEV。目前國內僅原研產品在售,LEV原料藥成本較低,因此,其緩釋片的仿制藥在國內具有廣闊的應用前景。本研究中參考相關文獻、UCB公司在美國上市申請的專利、《美國藥典》(USP32-NF27)及《歐洲藥典》(EP8.0)關于LEV 質量標準的規定,擬研制以羥丙甲基纖維素(HPMC)為骨架材料、與Keppra XRTM的釋藥行為相似的LEV 緩釋片(規格為每片500 mg),且所建制備工藝需簡單易行,適合大規模生產,以為國產LEV緩釋片的開發提供參考。現報道如下。
1 儀器與試藥
1.1 儀器
高效液相色譜系統(含SPD -10Avp 型紫外檢測器、LC-10ATvp,LC-Solution 色譜工作站)、AY120 型電子天平(日本Shimadzu 公司);ZRS -8G 型溶出度測試儀、YD -I 型片劑硬度測試儀、CS -2 型脆碎度測試儀(天津市鑫洲科技有限公司);DP -30A 型單沖壓片機(北京國藥龍立科技有限公司);TD 型電子天平(余姚市金諾天平儀器有限公司);電熱鼓風干燥箱(天津市泰斯特儀器有限公司);PHS -29A 型pH 計(上海雷磁創益儀器儀表有限公司);KH5200 型超聲波清洗器(昆山禾創超聲儀器有限公司);SHZ-D(Ⅲ)型循環水式真空泵(鞏義市予華儀器有限責任公司);CH-10 型槽型混合機、YK-160 型搖擺式顆粒劑(上海天和制藥機械有限公司);HPX -250B 型恒溫恒濕箱(上海悅車儀器儀表有限公司)。
1.2 試藥
LEV原料藥(北京師宏藥物研制中心);LEV對照品(美國國家標準局);左乙拉西坦酸對照品(北京百靈威科技有限公司);左乙拉西坦緩釋片(比利時UCB 公司,商品名開浦蘭);HPMC(上海卡樂康公司,黏度類型包括K4M、K15M、K100M);滑石粉(廣西龍勝華美滑石開發有限公司);硬脂酸鎂、二氧化硅(浙江湖州展望藥業);聚乙烯吡咯烷酮K30(PVPK30,西安富力化學廠);無水乙醇(廣東省化學試劑工程技術研究開發中心);乙腈(天津市科密歐化學試劑有限公司);硫酸(北京化工廠);磷酸二氫鉀、氫氧化鈉(廣東光華化學廠有限公司);氫氧化鉀(中國化學試劑三廠);異丙醇(美國TEDIA公司);正己烷(美國Tedia公司)。
2 方法與結果
2.1 處方篩選
粘合劑選擇:稱取500 mg 左乙拉西坦原料藥和200 mg HPMC K15M,混勻后加入不同的粘合劑(85%乙醇、5%PVP溶液、10%PVP溶液、90%乙醇、95%乙醇)制軟材,過篩制顆粒,烘干,整粒后將干顆粒與5 mg二氧化硅、10 mg 硬脂酸鎂混勻、壓片,制備樣品緩釋片。原研片質量為(715 ± 15)mg,平均硬度為23,而兩種PVP 溶液作為粘合劑制備得到的樣品片劑硬度值均小于12,不符合要求;90%乙醇溶液制備得到的樣品片劑硬度大于18,同時片劑表面光滑無斑點,可壓性好,故選擇90%乙醇溶液作為粘合劑[8]。
緩釋材料選擇:稱取500 mg 左乙拉西坦原料藥和200 mg 不同黏度HPMC[9],分別混勻后加入90%乙醇制軟材,過篩制顆粒,烘干,整粒后將干顆粒與5 mg二氧化硅、10 mg 硬脂酸鎂混勻、壓片,制備樣品緩釋片,溶出曲線見圖1 A。可見,隨著HPMC 黏度的增加,藥物溶出度呈逐漸降低趨勢。K4M 溶出較快,8 h 時即基本釋放完全,與原研片溶出曲線的相似因子(f2)值為60.06(>60 為相似性較好),但與12 h 緩釋的實驗目的不符;K100M 和K15M 在前期溶出與原研片的溶出量差距較大,其12 h溶出曲線與原研片溶出曲線的f2值均小于60[10]。故考慮單用1 種緩釋材料不能很好控制LEV的12 h 有效釋放,采用不同配比的HPMC K15M 及HPMC K100M作為混合緩釋材料。結果配比為7∶3、8∶2、9∶1(m/m)時的f2值分別為78.61,68.5,65.9,可見,以7∶3 為配比的混合緩釋材料溶出曲線與原研片的溶出曲線相似度最高,12 h溶出釋放效果最理想,故選擇。溶出曲線見圖1 B。

圖1 溶出曲線A.Samples prepared by a single sustained-release material and original tablets B.Samples prepared by sustained-release materials with different ratios and original tabletssFig.1 Dissolution profiles
2.2 工藝篩選
制片方法:預試驗考察了粉末直接壓片法和濕法制粒壓片法對藥物釋放的影響。濕法制粒壓片法制得的樣品片劑表面光滑,質量為(720 ± 25)mg,且硬度值大于22,形狀與原研片接近;粉末直接壓片法制得的片劑可壓性差,片劑外表面光滑性較差,易松散,且制得的片劑質量差異較大,含量均勻度不如濕法制粒壓片。故選用濕法制粒壓片法。
篩網大小:根據常用篩網大小和文獻[11],按處方濕法制粒后分別過16 目和24 目篩,烘干后制備樣品片劑。兩種篩網制得的樣品片劑在質量、硬度及藥物釋放方面無明顯差異,但24目篩所得樣品片劑表面更光滑、色澤更均勻。故選擇24目篩。
壓片壓力:一般通過控制片劑硬度來控制壓片壓力的大小。根據原研片的硬度和緩釋制劑常見硬度[12],根據處方濕法制粒并干燥后考察,壓力為7 N 時,制得的樣品片劑表面光澤度較差,且有斑點出現,硬度值小于12,而壓力為8 N 及9 N 時,樣品片劑外觀無明顯差異,但以9 N 壓力壓制樣品片劑的硬度及質量均勻度與原研片更接近。故選擇壓片壓力為9 N。
2.3 中試樣品制備
按處方量1 萬片稱取LEV 原料藥粉末及選定的混合緩釋材料粉末,在槽型混合機中混勻,平行3 個批次(批號分別為20120209,20120210 -1,20120210 -2),按每片消耗約0.8 mL 90%乙醇制備軟材,使用搖擺式制粒機制成濕顆粒,放入真空干燥箱中70 ℃干燥3 h,取出,整粒。稱取處方量的二氧化硅、硬脂酸鎂和滑石粉粉末混合后,與整粒后的顆粒混勻,調節好壓力(9 N)及填充量后用單沖壓片機壓片。壓片得到的樣品片劑使用歐巴代包衣液包衣后進行包裝放置,即得中試樣品片劑3萬片。
2.4 中試樣品片劑質量檢查
硬度測定:取3 批中試樣品片劑各10 片,使用硬度儀測定中試樣品片劑和原研片的硬度值(長端)。結果3 批次中試樣品片劑硬度值與原研片接近,RSD均小于4.0%(n=10),符合檢查標準。詳見表1。

表1 中試樣品片劑硬度測定結果(n=10)Tab.1 Results of the hardness test of pilot sample tablets(n=10)
質量差異:取3 批中試樣品片劑各20 片,精密稱定總質量并計算平均片質量,再分別精密稱定各片的質量。比較每片質量與平均每片質量,超出質量差異限度的片劑不得多于2片,且不得有1片超出限度1倍。結果3 批中試樣品片劑質量差異小(RSD均小于2%),符合檢查標準。詳見表2。

表2 中試樣品片劑質量差異測定結果(n=20)Tab.2 Results of the determination of weight difference of pilot sample tablet(n=20)
脆碎度測定:按2015 年版《中國藥典》片劑脆碎度檢查法檢查。取3 批中試樣品片劑各10 片,稱定初始質量,吹去脫落粉末,精密稱定質量,置脆碎度檢查儀圓筒中,25 r/min轉動4 min;取出,同法除去粉末,精密稱定質量,計算減失的質量,觀察片劑本身有無斷裂、龜裂及粉碎。詳見表3。

表3 中試樣品片劑脆碎度檢查結果(n=10)Tab.3 Results of the fragility assay of pilot sample tablets(n=10)
含量測定:取3批中試樣品片劑各10片,精密稱定,研成細粉,分別稱取約72 mg,置50 mL 容量瓶中,加入40 mL流動相,超聲(功率200 W,頻率40 kHz,下同)處理20 min后,放至室溫,用流動相定容,搖勻,經0.45 μm濾膜濾過,取續濾液作為供試品溶液;取1 mL,置100 mL容量瓶中,用流動相定容,搖勻,作為自身對照溶液。取LEV 對照品和左乙拉西坦酸對照品適量,分別制成質量濃度為1 mg/ mL 的LEV 對照品溶液及質量濃度為0.78 μg/ mL 的左乙拉西坦酸對照品溶液,各取適量,進樣測定,計算樣品片劑中LEV 及左乙拉西坦酸的含量[13]。結果樣品片劑中LEV 含量為98%~102%,左乙拉西坦酸含量小于0.3%,供試品溶液和自身對照溶液中未檢測到雜峰。詳見表4。

表4 中試樣品片劑中左乙拉西坦及左乙拉西坦酸含量測定結果Tab.4 Results of content determination of levetiracetam and levetiracetamic acid of pilot sample tablets
溶出均一性考察:參照國家藥品監督管理局藥品審評中心局《普通口服固體制劑溶出度試驗技術指導原則》,量取經脫氣處理的溶出介質(pH 6.0 PBS)900 mL,置溶出杯,在溶劑溫度(37 ± 0.5)℃,轉速100 r/ min條件下,取同一批中試樣品片劑6 片,分別投入6 個轉籃,至1,2,4,6,8,12 h 時吸取溶出液1 mL(立即補加等溫等量溶出介質)、經0.45 μm 濾膜濾過,取續濾液,進樣測定,計算溶出液中LEV 濃度并計算該批制劑不同時間累計溶出度,結果的RSD均小于3%(n=6),詳見表5。表明其批內均一性良好。

表5 中試樣品片劑累計溶出率(%)Tab.5 Cumulative dissolution percentage of pilot sample tablets(%)
穩定性考察:取中試樣品片劑適量,分別在高溫(40 ℃、60 ℃)、高濕[相對濕度(RH)為75%、92.5%]和強光照[(4 500±500)lx]條件下貯存5 d 和10 d 時各取10 片,研成細粉,分別取3 份72 mg 粉末,置50 mL 容量瓶中,加入40 mL 流動相超聲處理20 min,放至室溫,加流動相定容,搖勻,經0.45 μm濾膜濾過,取續濾液進樣測定。結果左乙拉西坦、左乙拉西坦酸含量均符合《美國藥典》和《歐洲藥典》標準(正常值分別為98%~102%,<0.3%),表明樣品片劑在高溫、高濕、光照條件下穩定性良好。詳見表6。
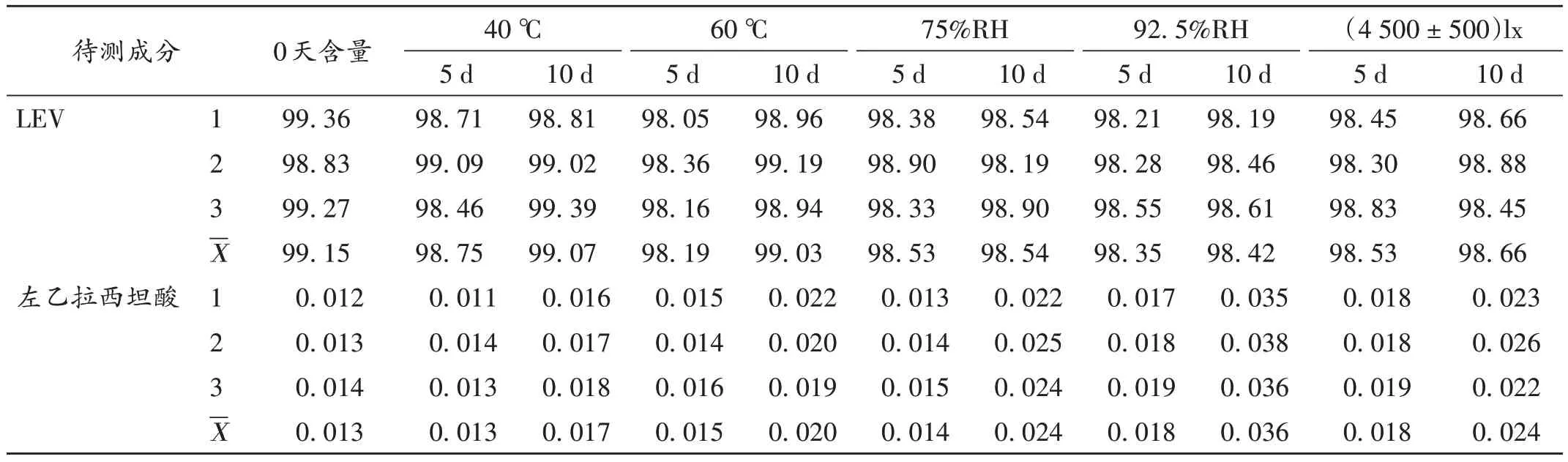
表6 樣品片劑高溫、高濕、光照條件下放置后含量測定結果(%)Tab.6 Results of content determination of sample tablets after placing under high temperature,high humidity and light conditions(%)
3 討論
LEV 緩釋片是比利時UCB 公司開發的抗癲癇新藥,與傳統抗癲癇藥物相比,其藥效好、安全性高、耐受性好,臨床廣泛應用[14-15],但其作用機制尚未明確。LEV 緩釋片可減少血藥濃度的峰谷現象,從而提高藥物的安全性;其次,LEV 緩釋片使血藥濃度在較長時間內維持在有效治療濃度范圍內,可降低給藥頻率,使用更方便。但該藥也存在一些不足,如生產工藝較普通制劑復雜,需特別謹慎對待藥物突然釋放導致的中毒,不能靈活調節給藥劑量和時間等[16]。
本研究結果顯示,中試樣品片劑質量差異及脆碎度檢查符合2015 年版《中國藥典(二部)》中有關規定,樣品片劑的硬度與原研片相近。不同溶出介質中12 h溶出曲線與原研片溶出曲線的相似度符合要求,兩者12 h 溶出度無明顯差異。還發現,中試樣品片劑中LEV含量、雜質含量及溶出度在加速和長期試驗放置后穩定性良好。本研究中確立了自制緩釋片劑處方及制備工藝和質量標準,對于國產LEV 緩釋片的早日問世具有一定意義。

