天然藥物化學史話:海洋毒素
王 磊,李 騭,張連珊,佟苗苗,付 炎,李力更*
1.河北醫科大學藥學院,河北 石家莊 050017
2.天津大學藥物科學與技術學院,天津 300072
3.河北醫科大學基礎醫學院,河北 石家莊 050017
占地球表面積超過70%的海洋是生命的發源地。從海洋中開始出現生命特征開始計,已經歷約40 多億年的歷史。據專家調查,海洋中現有生物總種類超過1000 萬種,生物總量約占地球總生物量的90%。正是海洋中如此巨大的資源,特別是海洋特殊的生態環境,使得更多的科學家越來越重視海洋生物的研究,海洋生物的次生代謝產物也成了藥物研發者寄予希望的領域,非常渴望能從其中獲得重大發現[1-2]。
近年來對海洋毒素(marine toxins)的研究越來越引起科學家們的重視。海洋毒素是海洋生物次生代謝產物中非常重要的一大類物質,指某些海洋生物體內具有特殊活性、對其他生物體具有敏銳刺激甚至滅絕作用的次生代謝產物。相對于蛋白類毒素,海洋毒素屬于相對分子質量較低的化合物,絕大部分具有新穎奇特的化學結構,而且這些特殊結構的化合物大多數僅僅在海洋生物的次生代謝產物中被發現。從化學結構角度,海洋毒素可以分聚醚類、生物堿類、大環內酯類等,但是大多數為結構復雜的聚醚類成分,所以海洋毒素最初以及現在主要所指的是這類化合物。也可以根據人類對海洋毒素產生的中毒癥狀不同,大致分類為腹瀉性貝毒、麻痹性貝毒、神經性貝毒、記憶缺失性貝毒等[3]。
從生物活性角度看,海洋毒素大多是海洋生物對其他生物進行捕殺或者對天敵進行防御的化學物質,海洋生物在釋放這些毒素時,由于巨量的海水稀釋作用,所以海洋毒素即使在濃度極低的情況下仍然會顯示出極大的毒性即殺傷力。對已發現的海洋毒素進行藥理研究表明,海洋毒素大多具有非常高的生物活性選擇性以及特異的細胞毒性,主要作用于其他生物體的神經系統、心血管系統,海洋毒素不僅可以作為開發抗癌、心血管等藥物的先導化合物,同時也可以為藥物研發提供更多的基礎試劑[4-5]。
海洋生物也是人類重要的食物來源,人類在食用海洋食物時也會遇到海洋生物體內的各種代謝產物即毒素的侵害。本文對目前發現的對人類有較大影響的代表性海洋毒素,從化學結構角度進行了簡要總結,為其進一步研發提供一定的參考。
1 聚醚類海洋毒素(polyether marine toxins)
從化學結構角度分析,海洋毒素主要指海洋聚醚類化合物,即分子結構中含有多個含氧醚環的海洋天然產物。此類化合物的雜原子與碳原子的比例很高,相對分子質量較大,生物活性廣泛,作用機制獨特,大多對神經或心血管系統有高特異性作用,是海洋天然產物中最主要、最重要的一類毒性成分。海洋聚醚類毒素分子按照化學結構,又分為梯形聚醚、線形聚醚、大環內酯聚醚等。目前已經公開報道海洋聚醚成分近200 個,其中具有明顯毒性且特殊結構特征的10 余個。以下簡要總結介紹代表性聚醚類海洋毒素。
1.1 梯形聚醚類(ladder-like polyethers)
此類海洋毒素分子結構骨架由多個含氧5~9元的醚環相互稠合而成,形成一種陡坡式的梯形,醚環之間以反式構型連續稠和,相鄰醚環上的氧原子交替位于環的上端或下端,分子梯形的兩端大多為連有醛酮酯、硫酸酯、羥基等極性基團。
短裸甲藻毒素(brevetoxin)A(BTX-A,1)、B(BTX-B,2)是從墨西哥海域中生長的渦鞭毛藻Gymnodinium breve(Ptychodiscus brevis)中分離得到的海洋毒素,結構見圖1。1981年哥倫比亞大學Nakanishi Koji(中西香爾)教授用X-衍射法首先確定了BTX-B 的化學結構[6]。中西香爾教授是當代最著名的天然產物化學家,對天然產物化學的發展做出了杰出貢獻,包括確定了250 多個結構獨特且具有良好生物活性的天然產物等。BTX-A 和BTX-B的骨架結構類似于梯狀,其中一端都是易于發生化學反應的α,β-不飽和醛,但是BTX-A 的另一端是五元飽和內酯,而BTX-B 的另一端是六元不飽和內酯。美國Nicolaou 教授領導的團隊歷經12年于1995年首先完成了BTX-B 的全合成[7],后在1998年又完成了BTX-A 的全合成[8]。BTX-A 和BTX-B 屬于神經性毒素,可造成肌肉麻痹,通過食用受此類毒素污染的貝類嚴重威脅生命安全,而且有可能通過沿海地區的氣溶膠傳播,對呼吸道產生刺激作用。目前已經發現約10 個短裸甲藻毒素類化合物的類似物[9-11]。

圖1 BTX-A(1)、BTX-B(2)的化學結構Fig.1 Chemical structures of BTX-A(1)and BTX-B(2)
1989年,日本科學家Yasumoto Takeshi(安元健)團隊從4000 kg 鰻魚Gynnothorax jauanicus內臟中純化出0.35 mg 西加毒素(又稱雪卡毒素,ciguatoxin,CTX,3,圖2)[12-14],并最終確定了其化學結構,也屬于梯形聚醚類化合物。此前美國科學家曾經從1100 kg 鰻魚的75 kg 內臟中分離出1.3 mg 西加毒素,但是僅僅確定了相對分子質量,沒有能夠確定結構式。CTX 的半數致死量(median lethal dose,LD50)為0.45 μg/kg,比河豚毒素(tetrodotoxin,TTX)的毒性還要強100 倍,是重要的神經毒素。另外,CTX 的生物毒性比較特殊,對人類的神經系統、心血管系統、消化系統等有較高的選擇性作用,屬于新型電壓依賴性Na+通道激動劑,目前在藥理毒理研究中常作為研究細胞膜結構與功能、局麻藥作用機制的分子探針使用。據調查,CTX 每年大約造成5 萬人中毒,是造成人類中毒分布最廣、人數最多的一種海洋毒素之一。2001年日本科學家Hirata Masahiro(平田正博)完成了CTX 的全合成。目前發現CTX 的類似物有30 余個[15-18]。
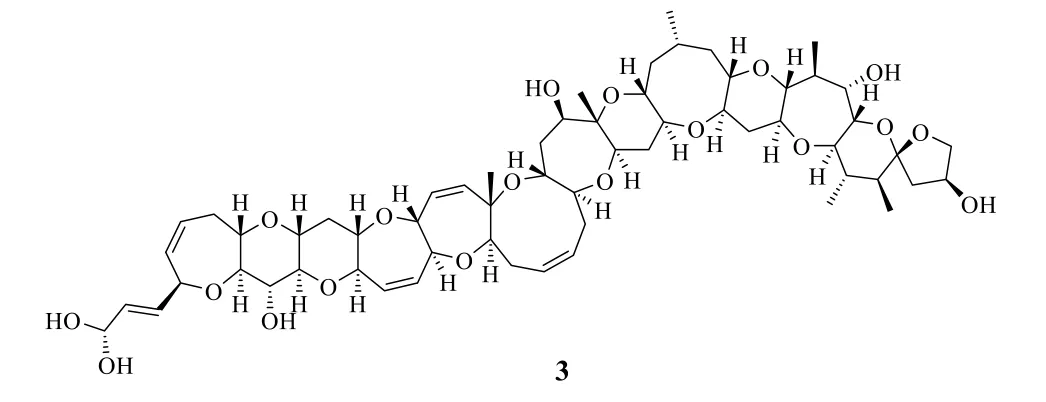
圖2 CTX 的化學結構Fig.2 Chemical structure of CTX
1992年日本科學家安元健團隊從海澡Gambierdiscus toxicus中發現了刺尾魚毒素(maitotoxin,MTX,4,圖3),MTX 的相對分子質量高達3422,是一個非常引人關注的梯形聚醚,特別是其毒性非常強烈,LD50僅為0.05 μg/kg,是目前毒素中毒性最強、相對分子質量最大的非蛋白類化合物。藥理實驗表明,MTX 屬于Ca2+離子通道激動劑,可作為研究Ca2+藥理活性的特異性工具藥,MTX 還可以參與神經生長因子的生物作用[19-21]。MTX 是目前發現的最為復雜的海洋聚醚類化合物,其結構的成功確定標志著現代結構鑒定技術的最高水平[22]。

圖3 MTX 的化學結構Fig.3 Chemical structure of MTX
2005年從赤潮甲藻Karenia mikimotoi中分離出1 個結構中含有15 個連續飽和醚環的梯形聚醚gymnocin B(5,圖4),這個化合物是已知含有連續醚環最多的聚醚類分子,其結構的一端連接的側鏈中含有不飽和雙鍵且與醛基共軛。實驗表明其具有明顯的細胞毒作用[23]。

圖4 Gymnocin B 的化學結構Fig.4 Chemical structure of gymnocin B
1.2 線性聚醚類(linear polyethers)
此類海洋毒素的分子結構中僅部分具有醚環結構,醚環一般為孤立或者與其他醚環以螺環的結構連接,同時醚環上大多還連接羥基或者側鏈,且側鏈也大多連接游離的羥基或不飽和雙鍵。
1981年,日本科學家Yoshimasza Hirata(平田義正)和美國科學家Richard E.Moore 幾乎同時報道了巖沙海葵毒素(palytoxin,PTX,6,圖5)的立體結構。PTX 最早是從海洋生物軟體生物巖沙海葵Palythoa toxica分離得到的海洋毒素,其分子結構中含有64 個手性碳和7 個不對稱雙鍵,是一個復雜的長鏈聚醚類化合物[24-25]。藥理實驗發現其LD50為0.15 μg/kg,比TTX 的毒性還要高一個數量級,也是毒性最強的代表性非蛋白毒素之一。更多生物活性研究表明,PTX 對離子通透性的作用與TTX 相反,能使Na+通道開放;也是目前發現的最強的冠脈收縮劑,作用強度比血管緊張素II強約100 倍;還具有明顯的抗腫瘤活性[26-27];PTX 還是一種新型的溶細胞素[28]。目前已經發現PTX 的類似物大約有10 個。
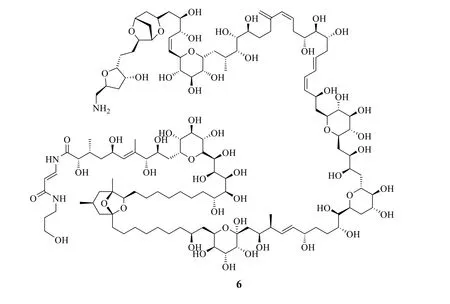
圖5 PTX 的化學結構Fig.5 Chemical structure of PTX
美國哈佛大學的Yoshito Kishi(岸義仁)領導的28 人團隊歷經14年終于在1994年完成了PTX的全合成。PTX 是一個非常復雜的線性聚醚類分子,理論上應該有271個立體異構體,是目前成功完成全合成的天然產物中相對分子質量最大、手性碳最多的化合物。PTX 的全合成堪稱成功攀登有機合成領域的珠穆朗瑪峰[29-30]。
20世紀70~80年代在日本及歐洲等地發生多起食用海鮮貝類引起腹瀉的事件發生,初步判斷可能是食用的貝類中有某種毒素造成的,后來經過深入研究,發現了其中的海洋毒素大田軟海綿酸[31](okadaic acid,OA,7,圖6)。從化學角度看,OA 是1 個具有38 個碳的線型聚醚類化合物,特別是結構中的一端還有1 個羧基。由于其最先是在1981年從大田軟海綿Halichondria okadai中分離得到,因此得名。進一步對生物鏈研究表明,OA 最初由海洋微藻產生,然后海綿通過濾食微藻而將其濃集于體內[32-33],海洋貝類再食用藻類而蓄積在體內,最終造成食用者中毒。藥理研究表明,OA 能抑制人體內的蛋白激酶,具有非常強的細胞毒性,OA 可引起許多類型細胞生長抑制或凋亡,包括腸細胞、神經元、肝細胞、血細胞等。該過程涉及的機制包括調節特定基因表達、降低線粒體膜電位、活化多個半胱天冬酶亞型、細胞色素C 從線粒體膜間隙釋放到細胞質基質、抑制蛋白質合成和破壞細胞骨架。目前已經發現OA 的類似物約有20 個,它們均具有相似的生物活性[34-36]。1995年在愛爾蘭發生因食用海洋食品貽貝Mytilus edulis的中毒事件,中毒癥狀主要是惡心、嘔吐伴隨腹瀉及胃部痙攣等[37-38],科學家后來從可能造成中毒的貝類中提取到了原多甲藻酸(azaspir acid,AZa-1,8,圖7)[39-40],目前已發現10 余個類似物(9~18,圖7)[41-42]。此類毒素也是線形聚醚結構,但是在結構的一端連接含有不飽和羧基的側鏈,另一端為1 個含有氮原子的六元環與1 個含氧五元形成螺環結構。藥理研究表明,AZA-1 未顯著改變電壓門控的Na+、Ca2+的流量,說明這種毒素并非依賴電壓門控通道而影響突觸在神經網絡傳遞[43]。

圖6 OA 的化學結構Fig.6 Chemical structure of OA
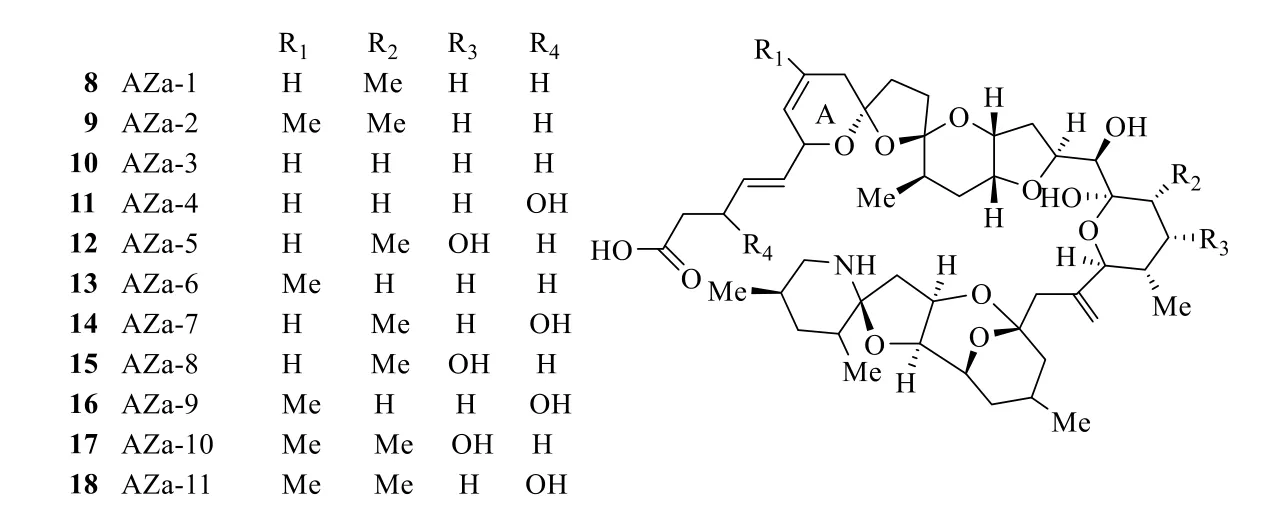
圖7 AZa-1(8)及其類似物(9~18)的化學結構Fig.7 Chemical structures of AZa-1(8)and its analogs(9—18)
1.3 大環內酯聚醚類(macrolide polyethers)
此類海洋毒素的分子中不但含有多個醚環,而且醚環首尾相連或局部以酯鍵成環形成大環內酯結構。食用貝類造成腹瀉的海洋毒素還包括扇貝毒素類(pectenotoxins,PTXs)和蝦夷扇貝毒素類(yessotoxins,YTXs),中毒嚴重者還會造成肝臟受損,因此也稱其為肝毒性貝毒(hepatotoxic shellfish poisoning)[44-45]。研究表明,此2 類海洋毒素并不是由海洋貝類產生,而是海洋貝類在食用某些海洋甲藻后在體內積蓄導致的,毒素是某些甲藻在生長代謝過程中產生的。PTXs 不但具有聚醚類的結構特點,而且其分子中多個醚環首尾相連或局部成環,形成大環內酯結構,可歸屬于大環內酯聚醚類。扇貝毒素(pectenotoxin,PTX)及其類似物(19~28)的化學結構見圖8。藥理實驗證明此類海洋毒素對腫瘤細胞有較強的細胞毒性,誘導腫瘤細胞的凋亡程度高于同一組織的正常細胞,推測肌動蛋白骨架是PTXs 的主要分子作用靶點[46]。

圖8 PTX 類似物(19~28)的化學結構Fig.8 Chemical structures of PTX’s analogs(19—28)
蝦夷扇貝毒素(yessotoxin,YTX,29,圖9)是1986年從扇貝Patinopecten yessoensis的消化腺中發現的[47]。YTX 是典型的梯形結構的聚醚類海洋毒素,骨架中含有11 個連續的醚環,結構中的一端含有2 個硫酸半酯基,另一端是含具有3 個雙鍵的不飽和側鏈,具有親脂性和一定的親水性。YTX 可引起多種細胞的凋亡,如神經母細胞瘤細胞BE(2)-M17、人宮頸癌HeLa S3 細胞、小腦神經元、鼠成肌細胞L6、小鼠腦瘤細胞 BC3H1、小鼠成纖維細胞NIH3T3、犬腎細胞MDCK、乳腺癌細胞MCF-7 和人肝癌細胞HepG2、Bel7402、HL7702 等,被認為是研究多種細胞死亡途徑的寶貴工具[48]。目前已鑒定出近40 個類似物[49]。

圖9 YTX 的化學結構Fig.9 Chemical structure of YTX
1.4 長鏈多羥基聚醚(polyethers with long-chain and multi-hydroxyl groups)
近年從海洋生物特別是藻類中發現較多長鏈多羥基聚醚類化合物,它們很可能是聚醚的前體化合物。例如,從海洋甲藻Amphidinium carterae菌株中分離出的多羥基魚毒素carteraol E(30,圖10),其69 個碳原子組成的線性骨架上連接3 個四氫吡喃環和19 個羥基、1 個羰基,實驗表明carteraol E 具有非常強的魚毒性(ichthyotoxicity,LD50=0.28 μmol/L)和抗真菌活性[50]。

圖10 Carteraol E 的化學結構Fig.10 Chemical structure of carteraol E
1.5 螺胺類聚醚(spiroimine polyethers)
此類海洋毒素的化學特征是分子中含有氮原子的螺胺(spiroimine)結構,其毒性類似TTX,屬于神經性毒素。1975—1981年日本人因吃牡蠣Pinna pectinata而發生食物中毒的多達2500 人[51-52],1995年日本科學家從牡蠣中分離出 4 個毒性成分pinnatoxins A~D(31~34,圖11)[53-54],其中pinnatoxins B、C(32、33)的結構中更是有α-氨基酸側鏈。2014年從中國南海采集的藻類Vulcanodinium rugosum中又分離得到了pinnatoxin H(35,圖11)[55]。從新西蘭海域采集的牡蠣中分離得到的gymnodimine(36,圖12)結構中除含有螺亞胺環外,還含有1 個不飽和五元內酯環側鏈[56]。1995—1996年,在對軟體動物提取物中毒性化合物的常規監測中,從加拿大東南沿海捕獲的扇貝Placopecten magellanicus和貽貝Mytilus edulis內臟中又分離出若干個螺胺的化合物(37~42,圖13)及其可能的前體物或水解物(43、44,圖13)[57-58]。
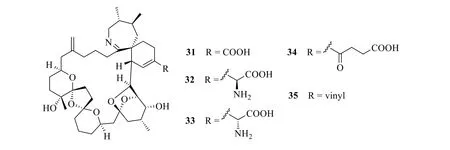
圖11 Pinnatoxins A~D(31~34)、H(35)的化學結構Fig.11 Chemical structures of pinnatoxins A—D(31—34)and H(35)

圖12 Gymnodimine 的化學結構Fig.12 Chemical structure of gymnodimine
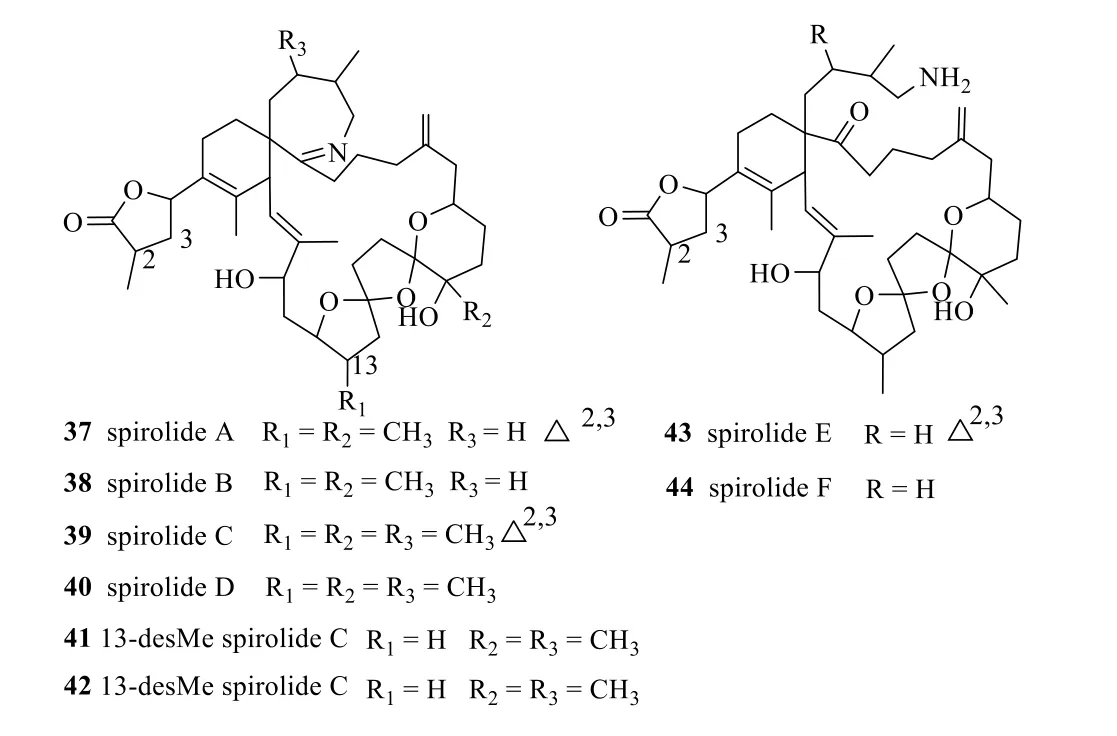
圖13 化合物37~44 的化學結構Fig.13 Chemical structures of compounds 37—44
此類海洋毒素分子中氮原子在螺環結構中大多以亞胺的形式存在,有的毒素同時還含有內酯結構,藥理實驗表明,此類毒素大多具有明顯的增加Ca2+通道功能[59]。目前已發現的螺胺類海洋產物約100個[60]。這些螺胺類海洋毒素雖然也可以列為生物堿類化合物,但是從結構上分析,大多也符合聚醚類骨架的結構特點。
2 其他結構類型的海洋毒素
2.1 海洋生物堿類毒素(marine alkaloid toxins)
海洋毒素除了聚醚類成分占主要外,也有其他結構類型的毒素成分對人類造成危害。在海洋生物體中也存在如陸生植物中數量眾多、生理活性特殊、結構新穎且復雜的生物堿類化合物,已發現的海洋生物堿總數量約占海洋天然產物總量的15%。海洋生物堿大多具有抗腫瘤、抗菌、抗病毒、抗炎等活性。其中最著名的生物堿類海洋毒素為TTX(45,圖14)。
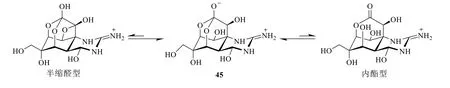
圖14 TTX 的化學結構Fig.14 Chemical structure of TTX
海洋生物是日本的主要食物來源之一,而在因食用海洋食物引起的中毒事件中,TTX 占據主要原因。據統計,僅1972—1993年的22年間日本全國發生食用河豚(puffer)中毒而死亡竟高達近300 人。早在1909年研究者將從河豚的魚卵中提取得到的毒性成分命名為河豚毒素,但是結構一直沒有被確定[61]。直到1964年在日本召開的第3 屆國際天然產物化學大會上,日本的Hirata Yoshimasa(平田義正)、Tsuda Kyosuke(津田恭介)、美國的Woodward 3 個研究團隊同時報道了TTX 的結構,一時引起科學界的轟動。TTX 的分子式為C11H17N3O8,相對分子質量為319,是1 個含有胍基、結構高度緊湊且呈籠形的原酸酯類生物堿。TTX 分子中幾乎所有的碳均為手性碳原子,在堿性和強酸性溶劑中不穩定,在有機溶劑和水中都不易溶解而僅溶于醋酸等弱酸性溶劑,在游離狀態下可能以3 種形態相互平衡的混合物存在(圖14),是在自然界中發現的結構最奇特的分子之一。1972年完成了TTX 外消旋體的全合成,2003年美國科學家和日本名科學家分別采用不同的路線完成了TTX 的不對稱全合成[62]。
藥理實驗發現,TTX 的LD50為8.7 μg/kg,是氰化物的1000 倍,對人的最小致死量(minimum lethal dose,MLD)為10 000 MU(相當TTX 結晶約2 mg),是毒性最強的小分子非蛋白神經毒素之一。TTX 能選擇性地抑制Na+通過神經細胞膜,但卻允許K+通過,可作為神經生物學和藥理學研究的工具藥。TTX 局部麻醉作用是普魯卡因(procaine)的4000 倍,臨床上可用于治療各種神經疼痛、創傷及緩解晚期腫瘤患者的疼痛等。目前已經發現TTX類似物10 余個[63-64]。
另一個重要類型的生物堿類海洋毒素是石房蛤毒素(saxitoxin,STX,46)和新石房蛤毒素(neosaxitoxin,neo-STX,47),結構見圖15。有人在食用某些貝類后出現神經麻痹性中毒,很短時間內即會出現中毒癥狀,嚴重者造成死亡。后來經研究發現了STX 和neo-STX,這2 個毒素是海洋毒素中毒性最強的麻痹性毒素之一[65]。其分子結構是高度緊湊的立體籠狀分子,1 個含有胍基的六元環與另1 個含有胍基的五元環彼此駢聯,另有1 個碳酰半胺通過碳酰半酯鍵與含有胍基的六元環相連構成一個側鏈。根據進一步研究推測,STX 及其類似物可能最初還是產生于海洋藻類,后經食物鏈傳遞被貝類食用后在體內蓄積。藥理實驗也表明,此類毒素的作用機制與TTX 類似,使神經傳導發生困難,對人的中樞神經系統產生麻痹,造成人或其他生物呼吸衰竭甚至死亡。研究發現STX 還具有高效的鎮痛、局麻或解痙等作用,已成為藥理學研究的工具藥以及外科手術的輔助藥物。據報道,約0.5 mg 的STX 即可使人斃命,其毒性與人工合成的神經毒氣沙林(sarin,LD50=0.172 mg/kg)相同,在國際條約中已被列為禁用的化學武器。目前已發現STXs 類化合物約30 多個,如2008年從加拿大海域生長的貽貝Alexandrium tamarense中又檢測出5 個STX 的類似物[66]。
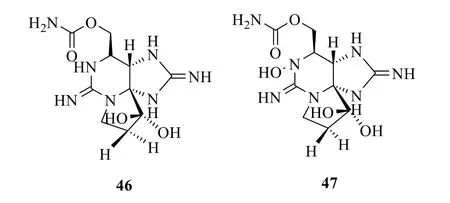
圖15 STX(46)和neo-STX(47)的化學結構Fig.15 Chemical structures of STX(46)and neo-STX(47)
2.2 海洋氨基酸(marine amino-acid)和多肽類毒素(polypeptide toxins)
20世紀80年代末,在加拿大發生因食用海洋貽貝Mytilus edulis造成百人食物中毒的事件,中毒癥狀主要是嘔吐、腹瀉且同時有記憶喪失癥狀,嚴重者處于昏迷狀態,最終造成3 人死亡。科學家對可能引起中毒的食物進行研究后,于1989年從中毒者食用的貽貝中分離得到了含有氨基酸骨架的羧酸類成分軟骨藻草酸(又稱多莫酸,domoic acid,DA,48,圖16)。進一步的調查發現DA 的最初來源是貽貝濾食的藻類[67-69]。藥理研究表明,DA 的LD50約10 mg/kg,具有一定興奮作用及驅蟲作用,可作為神經傳導研究的工具試劑[70]。

圖16 DA 的化學結構Fig.16 Chemical structure of DA
1970年在斐濟島曾發生一起食用海洋生物海兔Dolabella auricularia導致的食物中毒事件,主要表現為全身刺痛、發熱、嘔吐、腹瀉,嚴重者會出現肌肉麻痹、神經紊亂、呼吸困難等癥狀。后來從海兔Dolabella auricularia 中分離得到18 個含有特殊氨基酸的肽類化合物海兔毒素(dolastatins 1~18)[71]。抗腫瘤實驗表明,其中海兔毒素10(49,圖17)的IC50為0.5 nmol/L,具有較強烈抑制腫瘤細胞生長的活性[72]。
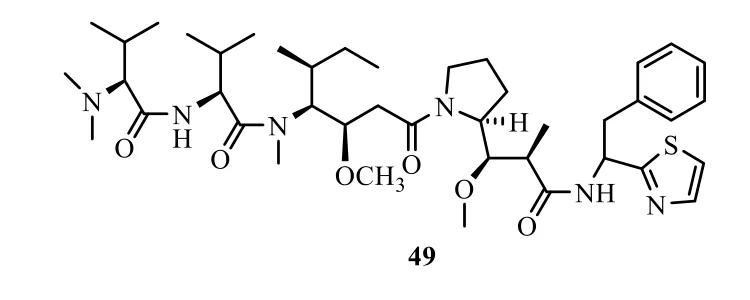
圖17 海兔毒素10 的化學結構Fig.17 Chemical structure of dolastatin 10
目前發現的芋螺毒素類(conotoxins,CTXs)由7~41 個甚至更多氨基酸殘基組成,此類毒素主要存在于海洋軟體生物芋螺的腺體中。芋螺毒素屬于神經毒素,能造成人類或其他動物神經性麻痹,嚴重者死亡。芋螺在全球廣泛分布,大約有數百種之多。每種芋螺的體內產生的芋螺毒素成分為多肽類分子的混合物,而且多肽的種類及數量各有不同,其中可能在幾十甚至上百種之多。目前的研究表明,芋螺毒素具有相對分子質量較小,但生物活性及選擇性高的特點,能特異性地作用于乙酰膽堿受體、其他神經遞質的各種受體亞型及鈉、鉀和鈣等多種離子通道,不僅可直接作為藥物,還可作為理想的分子模板用于開發新藥先導化合物,對研究神經生物學具有較大意義[73-74]。由于芋螺毒素的提取分離以及結構研究非常困難,對其更深入的研究正在進行中。
3 討論
3.1 海洋毒素的生物來源或生物合成途徑
海洋毒素特別是海洋聚醚類毒素與已發現的陸生天然產物毒素有明顯的不同,不但化學結構新穎奇特,而且毒性和機制各有不同。對海洋毒素深入了解后,發現化學結構仍可能存在更為復雜的骨架結構。例如,1988年從微藻Prorocentrum lima中分離得到的prorocentrolide(50,圖18)是1 種既含有亞胺氮原子又含有大環內酯結構,同時還含有多個醚環的新型骨架的分子[75],1996年從另一種微藻P.maculosum中分離得到了具有類似結構的化合物prorocentrolide B(51,圖18)[76],這2 個化合物均可以在幾分鐘內致大鼠死亡,目前這種快速致毒機理還在研究中[77]。
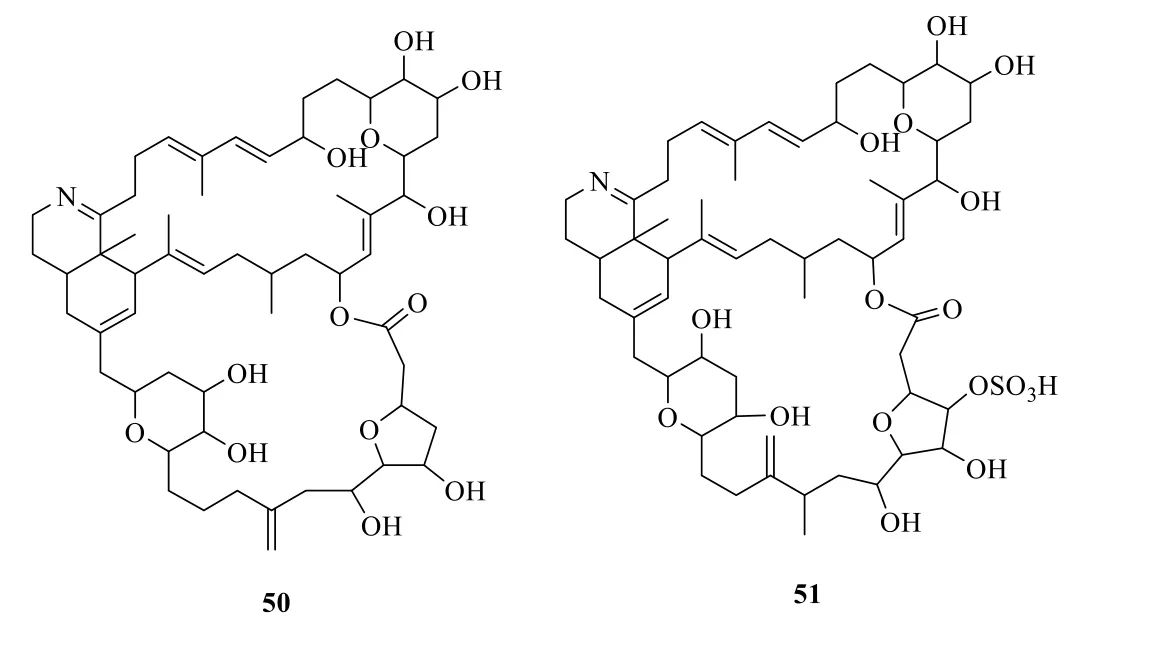
圖18 Prorocentrolides A(50)和B(51)的化學結構Fig.18 Chemical structures of prorocentrolides A(51)and B(52)
雖然人類可能是整個食物鏈中最后的中毒者,但是很多海洋毒素的前體物來自食物鏈最前端的海洋藻類,然后在下一個食物鏈生物體內繼續轉化;或者海洋藻類產生的毒素直接在下一個食物鏈生物體內不斷蓄積,從而影響下一個食物鏈的生物。對天然產物在生物體內的代謝途徑包括其轉化途徑即生物合成途徑的研究,也是近年來科學家越來越重視的研究內容,特別是針對海洋藻類的研究。
3.2 海洋毒素的應用
很多已經發現的海洋毒素不僅可以作為藥物的先導化合物,而且可以直接作為生命科學的研究工具,如TTX、STX 已經在神經生物學、藥理學領域成為標準工具試劑,臨床上也可用于治療各種神經肌肉痛、創傷及癌痛、局部麻醉藥等;CTX、刺尾魚毒素(maitotoxin)、巖沙海葵毒素(palytoxin)等可作為研究興奮細胞膜結構與功能、抗腫瘤作用機理的分子探針,OA 可用作研究細胞調控的工具試劑等[78-80]。
通過研究芋螺毒素(conotoxins)的構效關系后開發的具有高效鎮痛作用的ziconotide(52,圖19)已經作為藥物(商品名Prialt)被美國FDA(2004年)、歐盟歐洲藥品評估局(European Agency for the Evaluation of Medicinal Products,EMEA)(2005年)批準上市。Prialt 的鎮痛效果約為嗎啡的千倍,而且沒有成癮性,是第1 個來自于海洋的肽類藥物[2,81-82]。

圖19 Ziconotide 的化學結構Fig.19 Chemical structure of ziconotide
根據海兔毒素 10 開發的靶向抗腫瘤新藥brentuximab vedotin(商品名為Adcetris,53,圖20)已經在2011年被美國FDA 批準用用于治療霍奇金淋巴瘤(Hodgkin lymphoma)和系統性間變性大細胞淋巴瘤[2,83]。
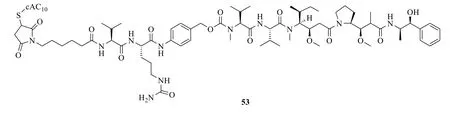
圖20 Brentuximab vedotin 的化學結構Fig.20 Chemical structure of brentuximab vedotin
4 展望
海洋是大自然賦予天然產物化學家進行藥物研究的廣闊領域,特別是近幾十年來各國科學家對海洋生物如藻類、微生物、海綿、棘皮動物、腔腸動物、軟體動物、被囊類動物和苔蘚蟲類等進行了廣泛的研究,從中分離和鑒定出了約30 000 余種海洋天然活性物質,并且已有50 余種進入了臨床和臨床前研究。對海洋聚醚毒素的深入研究已經為化學、生命科學提供了一些從陸生天然產物中難以預料的信息,并且在心血管藥物、抗腫瘤藥物研發中發揮重要作用。對海洋毒素的研究不僅會促進天然產物化學研究的發展,也會極大地促進各個學科的發展[84-86]。浩瀚且深不可測的海洋必將不斷地為人類提供結構新穎、生物活性獨特的海洋毒素,并貢獻出人類亟需的藥物[87-88]。
海洋生存環境的巨大差異意味著生物種類的多樣性,生物種類的多樣性意味著其次生代謝產物結構的多樣性,次生代謝產物結構的多樣性意味著其生物活性的多樣性,生物活性的多樣性意味著開發新藥的巨大可能性。相信海洋毒素或者海洋天然產物會給人類帶來更多的驚喜。
本文是作者所編寫的天然藥物化學史話系列文章之一。謹以此文紀念史清文教授(1964—2020)。
利益沖突所有作者均聲明不存在利益沖突

