十一種植物中原花青素單體和低聚體的比較分析
李倩 鄧艷紅 趙聰 趙鶴 張春晨 蔡慧珍 楊曉輝
摘?要:對十一種植物花瓣、籽、果實或果皮中的原花青素主要單體和低聚體進行檢測,分析比較不同植物中原花青素組成和含量的差異.十一種植物樣品分別經85%乙醇超聲提取、Oasis PRiME HLB固相萃取凈化后,采用高效液相色譜法(HPLC)分離分析其中的兒茶素、表兒茶素、沒食子酸、原花青素B2、原花青素B4、原花青素A2.結果表明,在所選色譜條件下,十一種植物中都能檢出原花青素單體或低聚體,且含量以原花青素低聚體為主.其中葡萄籽中原花青素含量最高、種類最多,六種原花青素單體和低聚體均有檢出;其次是玫瑰花瓣、花生紅衣,分別檢出兒茶素和沒食子酸兩種原花青素單體和原花青素B2、原花青素B4、原花青素A2三種低聚體;藍莓、核桃仁、黑枸杞和紫甘藍除檢出一種原花青素單體外,藍莓和核桃仁中三種原花青素低聚體均有檢出,而黑枸杞和紫甘藍只檢出了原花青素B2和原花青素B4兩種低聚體;紅皮土豆皮和紫薯皮中僅檢測到了原花青素低聚體;火龍果皮和紅辣椒中原花青素單體和低聚體種類少,含量低.此外,葡萄籽和皮、花生紅衣和花生仁為同一植物的不同部位,其原花青素種類和含量差別很大.不同植物中原花青素的種類和含量不同;同種植物不同部位的原花青素種類和含量也不同.原花青素在不同植物中分布情況、組成差別和含量上的差異,為植物原花青素的構效關系研究及其開發利用奠定了基礎.
關鍵詞:植物;原花青素;單體;低聚體;比較分析;高效液相色譜
中圖分類號:TS201.2
文獻標志碼: A
文章編號:2096-398X(2023)04-0058-06
Abstract:The major monomer and oligomer of proanthocyanidins from the petals,seeds,fruits or pericarps of 11 plants were detected,and the difference of proanthocyanidin contents were analyzed in a variety of plants in this study.The catechin (C),epicatechin (EC),gallic acid (GA),procyanidin B2 (PCB2),procyanidin B4 (PCB4),procyanidin A2 (PCA2) of the 11 plants were extracted by 85% ethanol solution under ultrasonic,purified by Oasis PRiME HLB solid phase extraction column and separated by high performance liquid chromatography (HPLC).The result showed that monomers or oligomers of proanthocyanidins could be detected in 11 plants under the selected chromatographic conditions,and the content was mainly proanthocyanidin oligomers (OPC).Among them,the content of proanthocyanidins in grape seeds was the highest and the types were the most.Six proanthocyanidin monomers and oligomers were all detected in grape seeds.Two monomers,C and GA,and three oligomers,PCB2,PCB4 and PCA2,were detected in rose petals and peanut seed coats,respectively.In blueberry,walnut kernel,lycium ruthenicum murray and purple cabbage,except one proanthocyanidin monomer was detected,three kinds of proanthocyanidin oligomers were detected in blueberry and walnut kernel,while only PCB2 and PCB4 were detected in lycium ruthenicum murray and purple cabbage.The pericarp of red potato and purple potato only had OPCs; and the types of proanthocyanidin monomers and oligomers in red pepper and pericarps of dragon fruit were few and the content was low.In addition,the seed and pericarp of grape,peanut kernel and its seed coat were different parts of the same plant,and the types and content of proanthocyanidins were different.The types and contents of proanthocyanidins in different plants were different.The types and contents of proanthocyanidins in different parts of the same plant were also different.The differences of distribution,composition and concentration of proanthocyanidins in different plants lay a foundation for the study of structure-activity relationship and its development and utilization.
Key words:plants; proanthocyanidins; monomer; oligomer; comparison and analysis; high performance liquid chromatography (HPLC)
0?引言
原花青素(proanthocyanidins,PC)是植物中廣泛存在的多酚類物質之一[1],是由不同數量的兒茶素(catechin,C)、表兒茶素 (epicatechin,EC)單體聚合而成的低聚體和高聚體組成的混合物[2,3].其中,由2-4個單體聚合而成的叫做低聚原花青素(oligomeric proanthocyanidins,OPCs),由5個以上單體聚合而成的叫高聚原花青素(polymeric proanthocyanidins,PPCs),高聚原花青素的聚合度可以高達數十,甚至數以上百 [4,5].據報道,PC具有多種生物學特性,包括抗氧化[6]、抗癌[7]、抗動脈粥樣硬化[8]、降血壓[9]、降血糖[10]、降血脂[11]、抗肥胖和美白等作用[12-15],尤其是其抗氧化活性極強,在人體內清除自由基的能力是維生素E的50倍 ,維生素C的20倍 ,還具有保護血管 、抗腫瘤作用[16].這些生物學特性,使得PC在醫學、營養學和化妝品領域得到廣泛應用[17,18].PC主要存在于植物的皮、殼、籽、核、花、葉中[19,20],其中葡萄籽和果皮、花生紅衣、黑果枸杞目前研究較為廣泛[21,22].國內外研究者對原花青素的生理活性和化學結構進行了探索,發現植物原花青素的抗氧化活性與單體組成、單體之間的連接方式及聚合程度等均有關[23-25].植物中原花青素的生理活性對于預防各種疾病具有明顯的優勢,但因植物原花青素的種類繁多、結構復雜,不同材料、提取方式和制備條件不同,甚至是同一種植物的不同部位,獲得的原花青素組成和含量都有所差異,也使得不同植物原花青素生理活性不同.植物原花青素的組成和結構的多樣性以及植物個體之間的差異性為其構效關系的研究帶來了極大的困難.
近年來,國內外學者對于植物中原花青素的提取及生理功效研究頗多,但大多集中于對單一植物原花青素的研究中,對于不同植物中原花青素的組成和含量的比較研究甚少.本文采用超聲提取、Oasis PRiME HLB固相萃取凈化,高效液相色譜法(HPLC)對葡萄、玫瑰花、花生、藍莓、黑枸杞、核桃仁、紫甘藍、紫薯、紅皮土豆、火龍果、紅辣椒11種植物花瓣、籽、果實或果皮中的主要單體和低聚體進行分離分析,比較原花青素在不同植物中分布情況、組成和含量的差異,為植物原花青素的構效關系研究及其開發利用提供依據.
1?材料與方法
1.1?材料與試劑
葡萄、玫瑰花、花生、藍莓、黑枸杞、核桃仁、紫甘藍、紫薯、紅皮土豆、紅心火龍果、紅辣椒均購買自寧夏銀川市新百大賣場;兒茶素標準品(純度≥98%)、表兒茶素標準品(純度≥98%)、沒食子酸標準品(純度≥98%)、原花青素B2標準品(純度≥98%)、原花青素B4標準品(純度≥98%)、原花青素A2標準品(純度≥98%),上海源葉生物科技有限公司;甲醇(色譜純),賽默飛世爾科技有限公司;乙醇(色譜純),天津市科密歐化學試劑有限公司;冰乙酸(色譜純),天津市大茂化學試劑廠;水為自制超純水.
1.2?儀器與設備
高效液相色譜儀(L-2000),日本日立公司;有機系進口NY濾膜(0.22 μm),Fount Beijing Biotech Co,LTD;Oasis PRiME HLB (3 cc,150 mg,2 mL,部件號186008717,使用前無需活化),沃特世科技(上海)有限公司;超聲波清洗器(KQ3200DA),昆山市超聲儀器有限公司;旋轉蒸發儀(RE-52AA),上海亞榮生化儀器廠;循環水式多用真空泵(SHB-Ⅲ),鄭州長城工貿有限公司;臺式高速離心機(TDL-5-A),上海安亭科學儀器廠;移液槍(H47039F),德國艾本德.
1.3?實驗方法
1.3.1?色譜條件
色譜柱:Agilent 5 TC-C18(250×4.6 mm);柱溫:27 ℃;流速:0.6 mL/min;進樣量:5.0 μL;波長:280 nm.流動相A:甲醇;流動相B:1.0%冰乙酸溶液.梯度程序洗脫:0~10 min,10%A;10 ~15 min,50%A;15 ~25 min,100%A;25~30 min,10%A.
1.3.2?標準溶液的配制
分別精密稱取兒茶素、表兒茶素、沒食子酸、原花青素B2、原花青素B4、原花青素A2標準品各2.5 mg,用甲醇溶解定容至25 mL的棕色容量瓶中,配制成質量濃度為100 mg/L的混合標準儲備液.用甲醇逐級稀釋混合標準儲備液,得到1 mg/L、10 mg/L、20 mg/L、50 mg/L和100 mg/L的混合標準系列溶液,搖勻,于4 ℃冰箱保存備用.
1.3.3?樣品前處理
將葡萄(葡萄籽和葡萄皮)、玫瑰花瓣、花生(花生紅衣和花生仁)、藍莓、黑枸杞、核桃仁、紫甘藍、紫薯皮、紅皮土豆皮、火龍果皮、紅辣椒清洗干凈烘干,分別研磨粉碎后各精密稱取2.5 g于50 mL具塞三角瓶中,分別加入25 mL 85%乙醇溶液,30 ℃下超聲輔助提取 30 min,提取液以3 000 r/min離心5 min后,將上清液轉移至圓底燒瓶中,殘渣重復上述操作,合并2次上清液,在旋轉蒸發儀中蒸至近干,用甲醇溶解并定容至10 mL棕色容量瓶中,取此溶液2 mL經Oasis PRiME HLB 固相萃取柱凈化[26]后,0.22 μm有機系微孔濾膜過濾,于4 ℃冰箱保存待測.
1.3.4?方法學考察
為了檢驗實驗樣品分析方法的準確性和可靠性,實驗同時做重復性實驗、精密度實驗、樣品加標回收率實驗和穩定性實驗,計算加標回收率和相對標準偏差,并考察了定量限和檢測限.
(1)重復性實驗
取葡萄籽和果皮、玫瑰花瓣、花生紅衣和果仁、藍莓、黑枸杞、核桃仁、紫甘藍、紫薯皮、紅皮土豆皮、火龍果皮、紅辣椒,每種原料各三份,每份各2.5 g,按照1.3.3方法進行處理,獲得的樣品溶液分別在1.3.1的色譜條件進行測定,計算各待測樣品中兒茶素、表兒茶素、沒食子酸、原花青素B2、原花青素B4、原花青素A2的相對標準偏差.
(2) 精密度實驗
取20 mg/L混合標準溶液經0.22 μm有機系微孔濾膜過濾后,按照1.3.1的色譜條件,在HPLC上連續進樣三次,分別通過兒茶素、表兒茶素、沒食子酸、原花青素B2、原花青素B4、原花青素A2的峰面積,計算出RSD值.
(3) 加標回收率實驗
準確稱取各植物待測花瓣、籽、果實或果皮樣品2.5 g,每種平行取三份,分別加入質量濃度為20 mg/L的混合標準溶液0.5 mL、1 mL、1.5 mL,并按照1.3.3方法進行樣品提取和凈化,經0.22 μm有機系微孔濾膜過濾后,按照1.3.1的色譜條件依次進樣分析,依據其峰面積計算各樣品的加標回收率.
(4)穩定性試驗
取20 mg/L混合標準溶液,分別于0 h、5 h、10 h、15 h、20 h、24 h按1.3.1項下試驗條件進行測定,記錄峰面積,計算日內相對標準偏差.
(5)定量限和檢測限
取1.3.2項下混合標準系列溶液按1.3.1項下試驗條件進樣測定,記錄兒茶素、表兒茶素、沒食子酸、原花青素B2、原花青素B4、原花青素A2的信噪比(S / N),以S/N為3∶1時的質量濃度為檢測限,以S / N為10∶1時的質量濃度為定量限.
1.4?數據處理
數據采用EXCEL 2021進行錄入計算,Origin8.6對兒茶素、表兒茶素、沒食子酸、原花青素B2、原花青素B4、原花青素A2標準系列進行線性回歸和色譜圖的繪制.
2?結果與討論
2.1?色譜分離條件的選擇
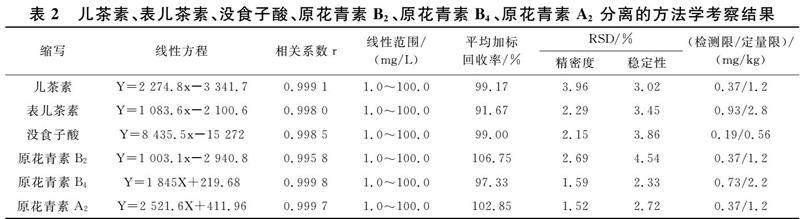
將1.3.2所配制的兒茶素、表兒茶素、沒食子酸、原花青素B2、原花青素B4、原花青素A2混合標準溶液在1.3.1所列的色譜條件下采用HPLC進行分離分析,其色譜圖如圖1所示.
由圖1可知,兒茶素、表兒茶素、沒食子酸、原花青素B2、原花青素B4、原花青素A2在此實驗條件下都能夠得到較好的分離,經同條件下單標定性分析,確定其歸屬,按照出峰順序依次為沒食子酸、原花青素B4、兒茶素、原花青素B2、表兒茶素和原花青素A2.采用此色譜條件測定各植物原花青素中兒茶素、表兒茶素、沒食子酸、原花青素B2、原花青素B4、原花青素A2的含量,分離效果良好,結果較為滿意.
2.2?植物原花青素單體和低聚體含量比較
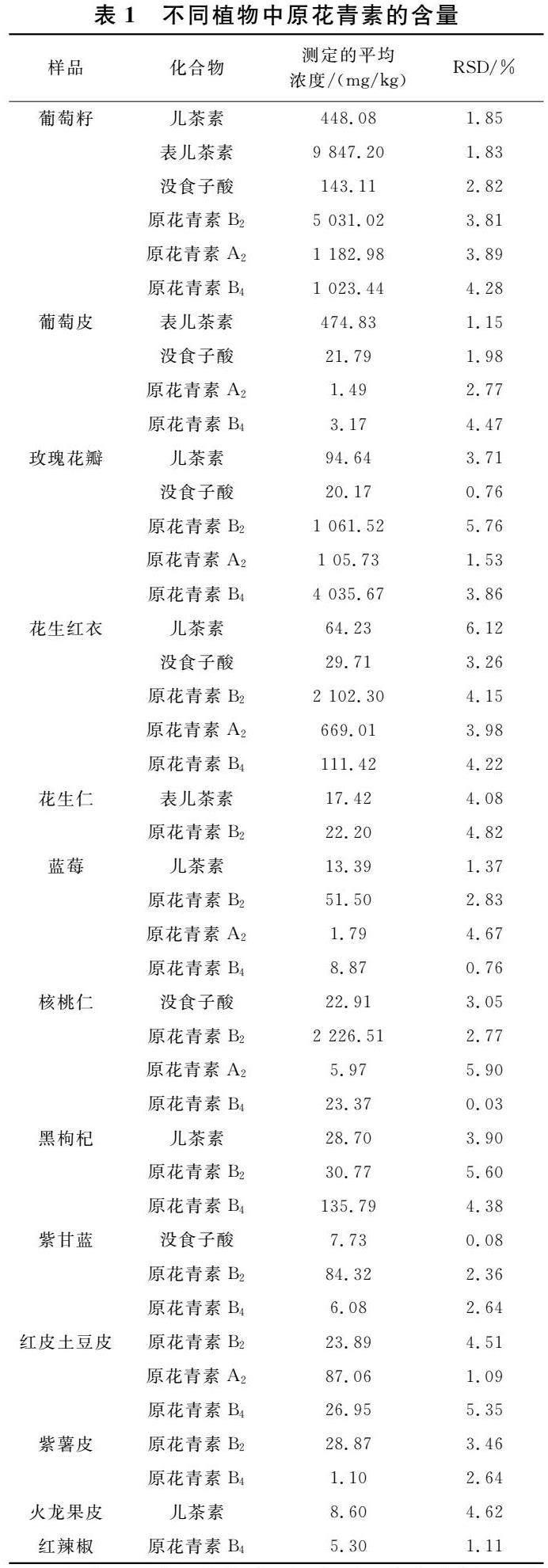
實驗采用乙醇作為提取溶劑,經超聲輔助提取十一種植物花瓣、籽、果實或果皮中的原花青素,Oasis PRiME HLB 固相萃取柱凈化后采用HPLC在上述色譜條件下分離分析,分別得到不同植物中總兒茶素、表兒茶素、沒食子酸、原花青素B2、原花青素B4、原花青素A2的含量,并以重復性實驗計算相對標準偏差,結果如表1所示.
由表1可知,在實驗所用提取、分離條件下,十一種植物中都能檢出原花青素單體或低聚體,含量以原花青素低聚體為主.其中葡萄籽、玫瑰花瓣、花生紅衣、核桃仁中三種原花青素低聚體含量高達2 225~7 236 mg/kg.
實驗結果顯示,相同的提取、分離、檢測條件下,不同植物中原花青素的種類和含量不同.由表1可以看出,葡萄籽中六種原花青素單體和低聚體均可檢出,且總含量最高;玫瑰花瓣和花生紅衣中原花青素種類和含量次之,除表兒茶素以外,均可檢出兒茶素和沒食子酸兩種原花青素單體和原花青素B2、原花青素B4、原花青素A2三種低聚體,且低聚體含量遠高于單體含量;藍莓、核桃仁、黑枸杞和紫甘藍中原花青素單體種類少,僅檢出兒茶素或沒食子酸一種單體,且含量低,藍莓和核桃仁中檢出三種原花青素低聚體,黑枸杞和紫甘藍中檢出了兩種低聚體,其中藍莓、核桃仁和紫甘藍中原花青素B2含量最高,而黑枸杞中原花青素B4含量最高;紅皮土豆皮和紫薯皮中未能檢出原花青素單體,僅檢測到了原花青素低聚體,且紅皮土豆的含量和種類都多于紫薯皮;火龍果皮和紅辣椒中原花青素種類少,含量較低.
實驗還對比了同一提取、分離、檢測條件下同一植物不同部位的原花青素,其種類和含量差別也很大.從表1可以看出,葡萄籽中三種原花青素單體和三種原花青素低聚體均可檢出,且含量均高,而同條件下葡萄皮中僅檢測到了兩種單體和兩種低聚體,且含量均遠遠低于葡萄籽;花生紅衣和花生仁相比,原花青素單體的種類和含量差異明顯,花生紅衣中原花青素低聚體種類和含量遠遠多于花生仁.
植物原花青素屬于天然抗氧化劑,廣泛存在于自然界中,由不同的的單體連接而成聚合體.國內外學者對原花青素的生理活性和化學結構關系的研究發現,原花青素單體組成和聚合程度、結構和含量都是是影響生理活性的重要因素[23-25].植物原花青素的種類繁多、結構復雜,表1所示的實驗結果表明,不同植物,甚至是同一種植物的不同部位,獲得的原花青素組成和含量都有所差異,這為不同植物原花青素生理活性的差異提供了支撐,也為其構效關系的研究提供了有力的依據.
2.3?方法學考察結果
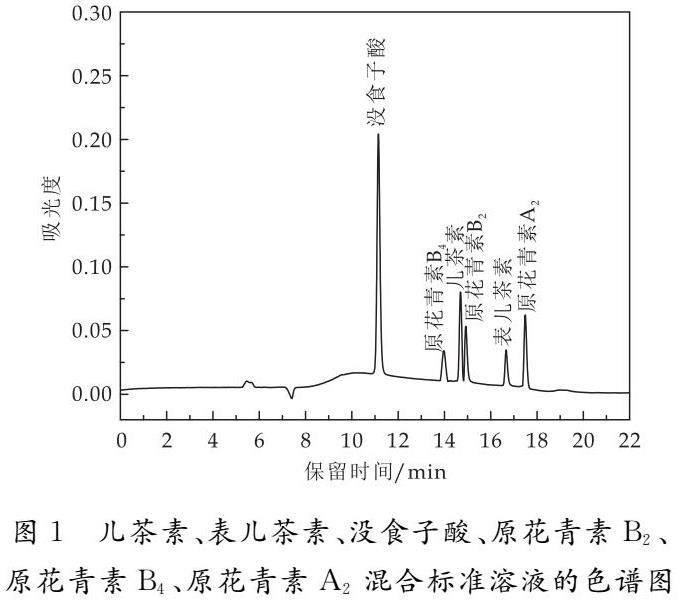
將1.3.2所配混合標準系列溶液在1.3.1所列液相色譜條件下進樣分析,以峰面積為縱坐標,混合標準系列溶液的質量濃度為橫坐標進行線性回歸,同時做樣品加標回收率、精密度實驗和穩定性實驗.兒茶素、表兒茶素、沒食子酸、原花青素B2、原花青素B4、原花青素A2的線性回歸方程、相關系數、線性范圍、平均加標回收率(添加水平為4 mg/kg、8 mg/kg、12 mg/kg)、相對標準偏差(RSD)和檢測限、定量限如表2所示.由表2可知,兒茶素、表兒茶素、沒食子酸、原花青素B2、原花青素B4、原花青素A2在1.0~100.0 mg/L濃度范圍內具有較良好的線性關系,相關系數均大于0.99,平均加標回收率在91%~106%,符合分析方法的要求;相對標準偏差為1.52%~3.96%,方法的精密度良好;穩定性實驗表明混合標準溶液在常溫下24 h內穩定性良好.
3?結論
植物原花青素的種類繁多、結構復雜,不同植物中原花青素的種類和含量不同,同種植物間不同部位的原花青素種類和含量差異較大,這也是導致不同植物原花青素生理活性不同的主要原因.實驗分離分析了十一種植物中原花青素的三種單體和三種低聚體,比較其在不同植物和同種植物不同部位中分布情況、組成和含量的差異,為進一步研究植物原花青素的構效關系及其藥物的研制和開發利用提供了有利的依據.
參考文獻
[1] Yang H X,Tuo X X,Wang L B,et al.Bioactive procyanidins from dietary sources:The relationship between bioactivity and polymerization degree [J].Trends in Food Science & Technology,2021,111:114-127.
[2] 張慧文,張?玉,馬超美.原花青素的研究進展[J].食品科學,2015,36(5):296-304.
[3] Kawakami W,Oshima A,Yanase E.Structural characterization of proanthocyanidins from adzuki seed coat [J].Food Chemistry,2018,239:1 110-1 116.
[4] Machado K N,Freitas A A D,Cunha L H,et al.A rapid simultaneous determination of methylxanthines and proanthocyanidins in Brazilian guaraná (Paullinia cupana Kunth) [J].Food Chemistry,2018,239:180-188.
[5] Gadon A,Linforth R,Harding S E,et al.Characterisation of high molecular weight hop proanthocyanidins using analytical ultracentrifugation [J].Scientific Reports,2019,9(1):12 650.
[6] Saito A,Mizushina Y,Tanaka A,et al.Versatile synthesis of epicatechin series procyanidin oligomers,and their antioxidant and DNA polymerase inhibitory activity[J].Tetrahedron,2009,65(36):7 422-7 428.
[7] Gopalakrishnan S,Ediga H H,Reddy S S,et al.Procyanidin-B2 enriched fraction of cinnamon acts as a proteasome inhibitor and anti-proliferative agent in human prostate cancer cells[J].Iubmb Life,2018,70(5):445-457.
[8] Zhang J,Liang R,Wang L,et al.Effects of an aqueous extract of Crataegus pinnatifida Bge.var.major N.E.Br.fruit on experimental atherosclerosis in rats[J].Journal of Ethnopharmacology,2013,148(2):563-569.
[9] Kim K J,Hwang E S,Kim M J,et al.Antihypertensive effects of polyphenolic extract from Korean red pine (Pinus densiflora Sieb.et Zucc.) bark in spontaneously hypertensive rats[J].Antioxidants,2020,9(4):333.
[10] Lu Z,Jia Q,Wang R,et al.Hypoglycemic activities of A-?and B-type procyanidin oligomer-rich extracts from different Cinnamon barks[J].Phytomedicine,2011,18(4):298-302.
[11] Downing L E,Ferguson B S,Rodriguez K,et al.A grape seed procyanidin extract inhibits HDAC activity leading to increased Pparα phosphorylation and target-gene expression[J].Molecular Nutrition & Food Research,2017,61(2):1-7.
[12] Wei S J,Zheng Y Y,Zhang M M,et al.Grape seed procyanidin extract inhibits adipogenesis and stimulates lipolysis of porcine adipocytes in vitro[J].Journal of Animal Science,2018,96(7):2 753-2 762.
[13] Cao J L,Yu X L,Deng Z Y,et al.Chemical compositions,antiobesity,and antioxidant effects of proanthocyanidins from Lotus seed epicarp and Lotus seed pot[J].Journal of Agricultural and Food Chemistry,2018,66(51):13 492-13 502.
[14] Vazquez Flores A A,Martinez-Gonzalez A I,Alvarez Parrilla E,et al.Proanthyocyanidins with a low degree of polymerization are good inhibitors of digestive enzymes because of their ability to from specific interactions:A hypothesis[J].Journal of Food Science,2018,83(12):2 895-2 902.
[15] Tsuchiya T,Fukui Y,Izumi R,et al.Effects of oligomeric proanthocyanidins (OPCs) of red wine to improve skin whitening and moisturizing in healthy women-a placebo-controlled randomized double-blind parallel group comparative study[J].European Review for Medical and Pharmacological Science,2020,24(3):1 571-1 584.
[16] 田建華.沙棘原花青素測定方法學考察及含量測定[J].山西林業科技,2021,50(4):11-13.
[17] 張長貴,董家寶,謝伍容,等.原花色素抗氧化生物活性研究進展[J].糧食與油脂,2009(6):10-12.
[18] 伍?勇,鄒?蝶,盧?倩,等.巨峰葡萄籽原花青素的純化與抗氧化活性分析[J].食品研究與開發,2022,43(1):131-138.
[19] Zeng Y X,Wang S,Wei L,et al.Proanthocyanidins:Components,pharmacokinetics and biomedical properties[J].The American Journal of Chinese Medicine,2020,48(4):813-869.
[20] Zhou P Y,Zhang L M,Li W,et al.In vitro evaluation of the anti-digestion and antioxidant effects of grape seed procyanidins according to their degrees of polymerization [J].Journal of Functional Foods,2018,49:85-95.
[21] 楊清山,張?燕,連運河,等.葡萄籽、松樹皮和花生衣提取物中原花青素成分研究[J].食品研究與開發,2017,38(10):159-164.
[22] Kumar R,Sharma R,Thakur M S,et al.Comparative study of phytochemicals,antioxidant activities and chromatographic profiling of different parts of lycium ruthenicum murr of trans-himalayan region[J].Phytomedicine Plus,2022,2(4):100 339.
[23] 孫?蕓.葡萄籽原花青素的聚合度與功效關系的研究[D].無錫:江南大學,2004.
[24] Du H,Wu J,Li H,et al.Polyphenols and triterpenes from chaenomeles fruits:Chemical analysis and antioxidant activities assessment[J].Food Chemistry,2013,141(4):4 260-4 268.
[25] 高?潔,趙?妍.黑苦蕎麥殼高聚原花青素降解及其抗氧化活性分析[J].食品研究與開發,2022,43(12):147-154.
[26] 覃國新,李慧玲,何?潔,等.固相萃取凈化HPLC法同時檢測荔枝皮中的幾種原花青素[J].現代食品科技,2021,37(7):310-314,373.
【責任編輯:陳?佳】
基金項目:寧夏自然科學基金項目(2021AAC03141);寧夏醫科大學大學生創新創業訓練計劃項目(X202210752003)
作者簡介:李?倩(1997—),女,山西呂梁人,在讀碩士研究生,研究方向:營養與食品衛生學
通訊作者:楊曉輝(1979—),女,寧夏中寧人,副教授,研究方向:分析化學及食品分析檢驗,20060008@nxmu.edu.cn

