非酒精性脂肪性肝病診斷——病理的重要性
田愛平 楊永峰
摘要:對于非酒精性脂肪性肝病的明確診斷、單純性脂肪肝(NAFL)及非酒精性脂肪性肝炎(NASH)區分及疾病嚴重程度的分級評分,均需依靠肝穿刺活檢組織病理學評估完成,而臨床上仍多依賴于血液學及影像學檢測手段。盡管目前已有大量相關研究針對非酒精性脂肪性肝病的無創纖維化評估、疾病診斷模型出現,其敏感性及特異性仍有待提高。本文擬分別從NAFL及NASH的主要病理學特征、纖維化及分級分期評分方法,NASH肝硬化的病理學診斷等方面進行論述,以期提高臨床醫師對于該疾病組織學診斷的重視。
關鍵詞:非酒精性脂肪性肝病; 病理學; 診斷, 鑒別
基金項目:甘肅省高等學校創新能力提升項目(2020B-016); 蘭州大學第一醫院院內基金(ldyyyn2018-62)
Diagnosis of nonalcoholic fatty liver disease: The importance of pathology
TIAN Aiping1, YANG Yongfeng2. (1. Department of Infectious Diseases, The First Hospital of Lanzhou University, Lanzhou 730000, China; 2. Department of Hepatology, Nanjing Hospital Affiliated to Nanjing University of Chinese Medicine &
Nanjing Second Hospital, Nanjing 210003, China)
Corresponding author:YANG Yongfeng,yyf1997@163.com (ORCID:0000-0002-3214-0038)
Abstract:
Histopathological evaluation based on liver biopsy is required to make a confirmed diagnosis of nonalcoholic fatty liver disease, differentiate nonalcoholic fatty liver (NAFL) from nonalcoholic steatohepatitis (NASH), and perform the grading and scoring of disease severity, while hematological and radiological examinations are often used in clinical practice. Although there have been a large number of studies on noninvasive models for fibrosis assessment and disease diagnosis in nonalcoholic fatty liver disease, the sensitivity and specificity of such models need to be further improved. This article reviews the main pathological features of NAFL and NASH, fibrosis and grading/staging/scoring systems, and the pathological diagnosis of NASH liver cirrhosis, in order to improve the awareness of the histological diagnosis of such disease among clinicians
Key words:
Non-alcoholic Fatty Liver Disease; Pathology; Diagnosis, Differential
Research funding:
The Project of Gansu Province Academic Innovative Promotion(2020B-016); The Inner Project of the 1st hospital of Lanzhou University(ldyyyn2018-62)
非酒精性脂肪性肝病(NAFLD)的疾病譜包括單純性脂肪肝(NAFL)、非酒精性脂肪性肝炎(NASH)及其相關肝硬化和肝細胞癌。NAFLD是指通過影像學或組織學檢查,發現患者肝臟中存在脂肪沉積,但沒有出現繼續性脂肪沉積的病因(如大量飲酒、藥物或遺傳性疾病),現已成為全球慢性肝病的主要原因[1]。NAFL在組織學上定義為存在≥5%的肝脂肪變性,但無肝細胞損傷的證據;NASH定義為存在≥5%的肝脂肪變性和伴有肝細胞損傷的炎癥如氣球樣變、炎癥反應,伴或不伴纖維化[2]。至少20%~30%的NAFLD患者發生NASH,可導致肝硬化和/或肝細胞癌[1-2]。對于NAFLD的診斷,尤其是NAFL和NASH的鑒別,目前沒有可靠的臨床或放射學檢查,肝穿刺活檢組織學檢查仍然是診斷的金標準。本文就NAFLD的組織學檢查作一綜述,以期盡可能提高臨床醫師對于該疾病組織學診斷的重視。
1 NAFLD的基本病理特征
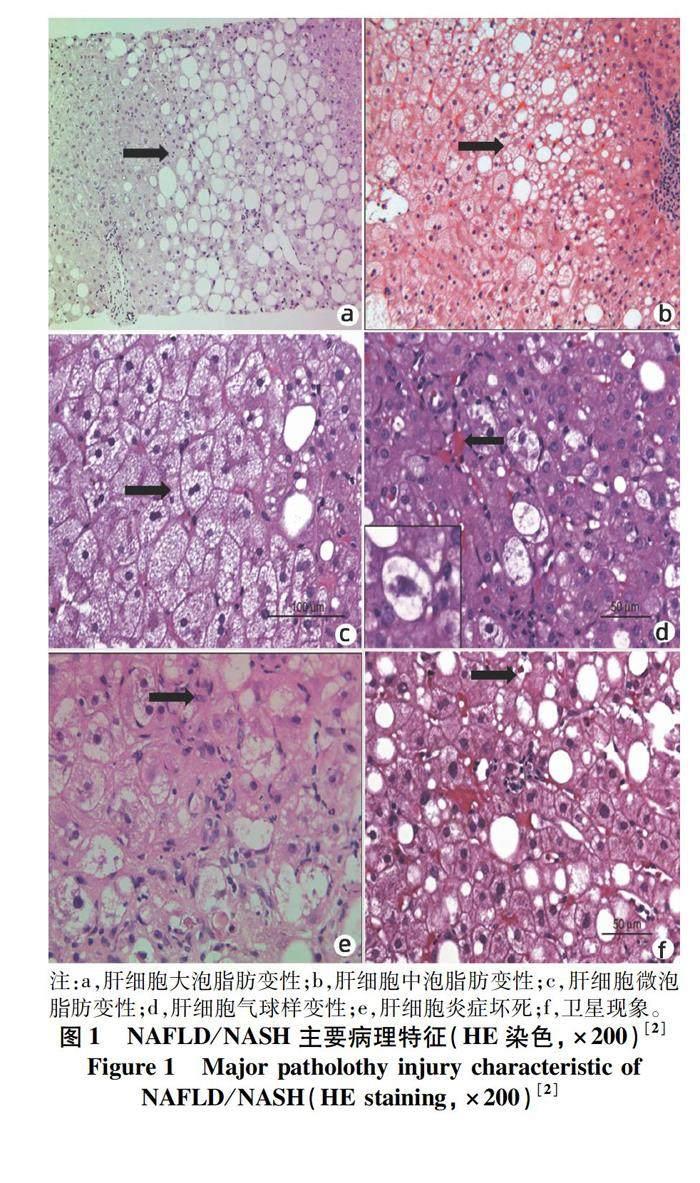
1.1 NAFL的主要病理特征 NAFL的主要病理特征為肝細胞大泡性脂肪變性[2](圖1),表現為細胞漿內出現明顯脂滴。脂滴的主要成分為甘油三酯[3]。在石蠟切片制片過程中會被脂溶劑二甲苯溶掉,故常規切片中僅留有圓形空泡。可用油紅O染色或鋨酸化的組織做HE染色或Masson三色染色來證明脂
變。正常情況下,肝臟內可有占肝臟總比<5%的脂肪變性,少量出現的肝細胞脂肪變性也可能是非特異性改變或見于衰老細胞。當脂滴占到50%以上時,大體上肝臟會表現為肝大,會有蒼白或發黃、有油膩感。鏡下脂變形式有大泡性脂肪變性、微泡性
脂肪變性。大泡性脂肪變性在肝細胞胞漿內出現的是單個脂滴或少數圓形脂滴或孤立的大脂滴,該脂滴將細胞核擠向細胞邊緣(圖1a),脂滴大者可達4~5個肝細胞大。NAFL大泡性脂肪變性輕者通常見于肝小葉腺泡3區,重者可達2區及匯管區周圍區域[4](表1)。
大泡性脂肪變性的發生主要是由于肝細胞的脂質攝取、合成和輸出間失衡。大泡性脂肪變性最常見于慢性酒精性及非酒精性脂肪性肝病、糖尿病、也可見于營養不良、飲食蛋白缺乏、慢性感染(如HCV)、消耗性疾病及一些遺傳代謝性疾病(如Wilson病)等。若脂滴肉眼可見并較小,多被定義為小泡性脂肪變性[4]。大泡性脂肪變性與小泡性脂肪變性之間的界限不絕對,在一些情況下可能會混合出現在同一肝臟病變中。而有些情況下,大泡脂肪變性的脂滴呈現中等大小,被稱之為中泡性脂肪變性(圖1b)。有時可以見到小泡性脂肪變性向中泡性脂肪變性,中泡性脂肪變性向大泡性脂肪變性過渡的情況,或幾種脂變并存。由于小泡、中泡及大泡性脂肪變性可能是個連續的過程,故上述脂變情況同時存在時多考慮病變在進展過程中。
微泡性脂肪變性的特點是肝細胞胞漿內擠滿了微小脂泡,脂泡大小較均一,直徑1~3 μm,細胞核仍位于細胞中央(圖1c),肝小葉結構基本不受影響,通常需特殊脂肪染色來證實。微泡性脂肪變性主要由于線粒體受損,脂肪酸在線粒體內β氧化受到影響,酯化形成甘油三酯增加,從而形成微小脂滴在胞漿內蓄積[5]。同時線粒體損傷嚴重,生化氧化障礙常導致代謝嚴重紊亂,引起急性肝衰竭,故廣泛微泡性脂肪變性是肝病重癥化的標志之一。
1.2 NASH主要病理特征 NASH主要病變除了大泡性脂肪變性,還需共存肝細胞氣球樣變性及一定程度的炎癥[6],以點灶壞死多見。氣球樣變性的存在為診斷脂肪性肝炎的必備條件之一(圖1d)。通常表現為肝細胞體積增大,并可能擴大至圓形,胞質明顯淡染,在電鏡下可見到胞漿基質疏松,線粒體腫脹,內質網擴張,斷裂呈絲狀,或空泡狀,胞核濃染,胞膜加厚等現象。氣球樣變性不僅僅出現在脂肪性肝炎,也可出現在其他任何一種肝臟病變中。脂肪性肝炎中的氣球樣變性肝細胞細胞骨架被破壞,可應用CK8/18免疫組化染色來鑒別脂肪性肝炎與其他肝病損傷導致的氣球樣變性[3]。
NASH氣球樣變性可能是肝細胞進展為溶解性壞死的主要成因。然而在趨于肝細胞壞死的過程中可能需要很長的時間。凋亡也是NASH肝細胞死亡的原因之一。在NASH中融合壞死與橋接壞死較為少見,但在酒精性脂肪性肝炎中多見。在大多數脂肪性肝炎中,小葉炎癥程度較輕,或最多至中度,肝細胞壞死通常與淋巴細胞、吞噬細胞、中性粒細胞浸潤等同時出現(圖1e)。酒精性脂肪性肝炎中的中性粒細胞聚集數量往往多于NASH,中性粒細胞通常出現在有或無mallory小體的氣球樣變性肝細胞周圍,被稱作“衛星現象(satellitosis)”(圖1f),出現這種現象多可能是由于脂滴所引發的細胞因子趨化現象,也可能與細胞因子如IL-8的出現相關[7-8]。NASH的炎癥在肝小葉及匯管區周圍均可能出現,而酒精性脂肪性肝炎的炎癥以匯管區周圍分布多見。
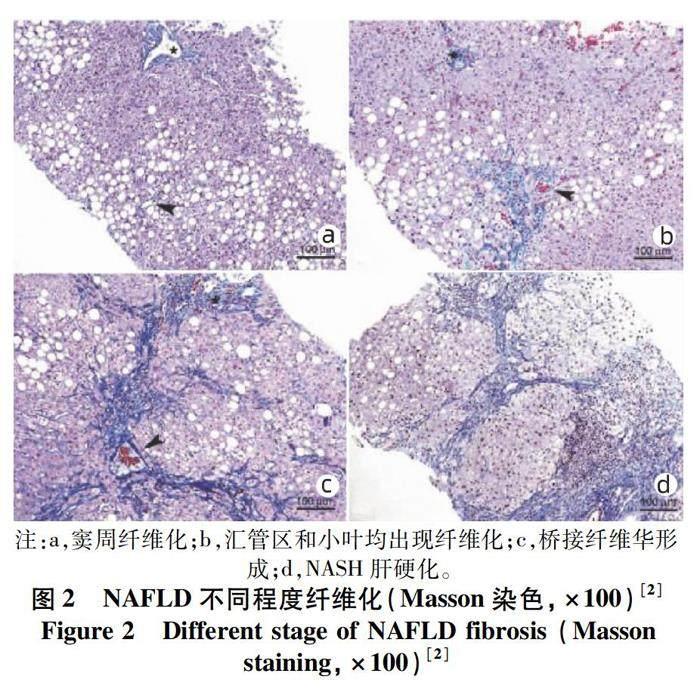
1.3 NAFLD纖維化 成年NAFLD,在肝細胞脂肪變性伴或不伴有炎癥背景下,偶爾會見到輕度小葉腺泡3區竇周纖維化或匯管區纖維化[9]。出現纖維化時,考慮NAFLD可能在向NASH進一步發展。通常NAFLD不伴有纖維化[5-6]。在NASH中往往可見到不同程度纖維化。纖維化即指異常膠原沉積,目前對于NASH的診斷并非必要條件。但NASH疾病進展的早期即可見到纖維化。非硬化階段的脂肪性肝炎(不論是酒精性或非酒精性),其纖維化分布,與先于匯管區發展起始的其他病因所致纖維化不同,其膠原沉積往往從腺泡3區竇周開始(圖2)[10]。纖維化膠原沉積可應用特殊染色如Masson、van Gieson、網銀、天狼星紅來確認,不同染色可標志出不同種類膠原沉積。當纖維化明顯時,HE染色即可辨認出嗜伊紅條帶的竇周纖維化,而當纖維化程度較輕時,則需要上述特殊染色來分辨。腺泡3區纖維化條索往往伴隨肝細胞氣球樣變性、脂肪變性及一定程度炎癥細胞浸潤。當病情逐步進展,可于匯管區見到纖維增生,小葉間動脈可見纖維沉積增多,隨著匯管區逐步擴大,小葉間質結構重塑,匯管區間纖維間隔形成進一步將肝細胞包繞并伸入小葉,橋接纖維(中央靜脈-中央靜脈,匯管區-匯管區,中央靜脈-匯管區)繼續發展,最終肝硬化形成[9]。
研究[4,11]顯示纖維化程度是影響NAFLD預后的最主要因素,纖維化程度越重,則死亡風險越高。經單因素分析發現,NAFLD出現匯管區炎癥和肝細胞氣球樣變性與肝移植術后相關不良事件有關,該結果也進一步提示這兩個因素可能與NAFLD短期疾病進展的預后相關[12]。
2 NAFLD與NASH分級分期評分系統
較好的慢性肝炎分級分期評分系統、多位病理醫生閱片、高質量的肝穿刺組織共同決定了NAFLD評分結果的一致性。而NAFLD病變程度的評定標準與慢性病毒性肝炎、自身免疫性肝炎及其他病因肝病不同[13]。1999年,Brunt等[5]首次提出基于51份成人NASH肝臟標本的評分系統。該方法同時囊括了NAFLD炎癥及纖維化的半定量評分。炎癥分級分別基于脂肪變性、肝細胞氣球樣變性、小葉炎癥及匯管區炎癥幾個方面,共有1~3級。該評分系統重點強調炎癥程度,對于脂肪變性比例較大而不伴有明顯炎癥的患者,評分分級可能較低,此外,Mallory-小體的存在也沒有納入評分判定標準內。故在病理報告中,不能僅依據評分系統給出評分結果,而應將每一個病理特征的程度客觀一一描述。
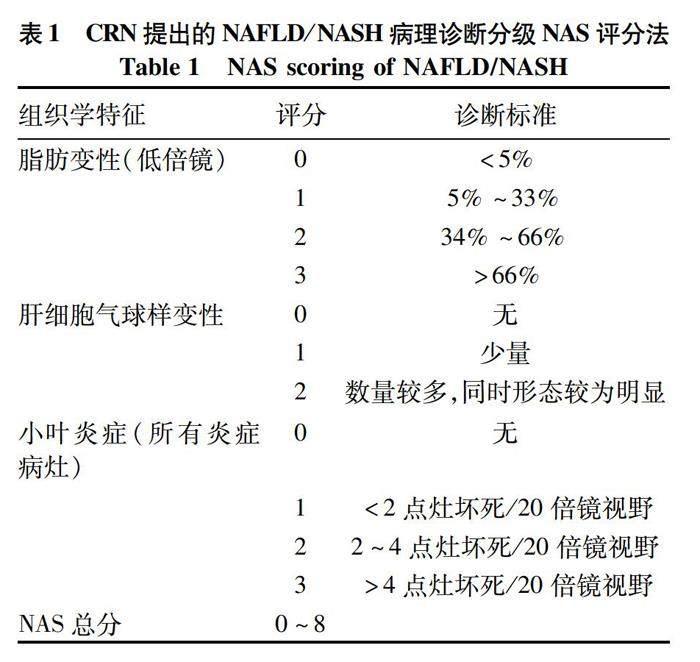
在2005年,NIDDK-NASH臨床研究小組(CRN)提出了針對成人及兒童的優化NAFLD分級評分標準[14](表1、2)。因其將5%脂肪變性作為脂肪程度最低線,故該標準包含了更早期的NAFLD。纖維化分期也在Brunt標準上進行了優化,具體細化了纖維化程度,表現在HE可分辨為1b,需特殊染色分辨者為1a,僅匯管區可見者為1c。實際應用中,病理醫生發現脂肪變性、小葉炎癥、肝細胞氣球樣變性和嗜酸性小體均是NAFLD與NASH劃分的獨立因素。基于上述發現,NAS評分法包括:脂肪變性評分0~3分,小葉炎癥0~3分,氣球樣變性0~2分,共0~8分。總分<3或≥5時,NAS評分能夠較好地診斷“不考慮NASH”及“確定為NASH”[14]。研究發現NAS評分在≥5時的敏感度和特異度分別為57%和95%。NAS評分目前已被廣泛應用于NAFLD及NASH分級當中。
2012年,歐洲脂肪肝研究小組基于脂肪變性程度(S)、炎癥程度(A)及纖維化程度(F)三者半定量基礎上建立了SAF評分法[15](表3)。因脂肪變性不是NAFLD進展的因素,故脂肪變性程度不算在炎癥活動度中,炎癥活動僅為小葉炎癥和肝細胞氣球樣變性的總和。纖維化分為5級,于CRN提出的NAFLD纖維化評分相似。SAF評分中,當A<2和/或F<2時視為“輕度NAFLD”,當A≥2和/或F≥2則視為“嚴重NAFLD”。綜上可見SAF評分主要取決于肝細胞氣球樣變性、小葉炎癥及纖維化三個方面,均與NAFLD預后直接相關。
兒童NAFLD評分系統在肝細胞脂肪變性比例、氣球樣變性及小葉炎癥程度的基礎上,加入了匯管區炎癥的半定量評分,該系統能夠較為可觀的反應兒童NAFLD及NASH嚴重程度,但在實際臨床應用中仍需被反復驗證[16]。
3 NASH肝硬化
NASH進展至肝硬化階段,可能不再見到竇周纖維化。同樣的,NAFLD及NASH的特征性改變即肝細胞脂肪變性可能消失殆盡,當可以看到脂肪變性時,可明確診斷脂肪性肝炎所致肝硬化。研究發現當應用NAS評分>4分時,考慮肝硬化由NASH引起,而當NASH特征性病理改變不再出現,或應用NAS評分<4分時,對于肝硬化是否與NASH直接相關無法直接明確。一定比例的隱源性肝硬化在臨床究因溯源時,最終診斷被NASH相關肝硬化,這部分人群由于缺乏病理典型特征,給臨床病因診斷帶來較大難度[17]。為此,NASH肝硬化診斷相關定義工作小組共識將NASH肝硬化定性區分為“確定”“很可能”“可能”三個等級[18](表4),當病理診斷依據不足時,若患者合并代謝相關疾病如:2型糖尿病、肥胖、高脂血癥等疾病時,將加強NASH病因診斷的權重。在“確定”診斷中,“a”對NASH導致肝硬化診斷的確定性最強,“b”及“c”的診斷確定性稍差。從表中也可以看出,盡可能詳細追問患者在肝穿刺之前的合并疾病病史對于肝硬化病因的診斷會更加全面。然而部分肝硬化患者不僅缺乏NASH病理學特征,其臨床特征也很難確定或不典型,如既往肥胖的患者可能因糖尿病或肝硬化營養不良而變瘦;既往脂代謝是否異常可能無法明確;肝臟脂肪含量減少,應用B超、CT或MRI等無創檢查亦無脂肪肝表現。因此在診斷隱源性肝硬化病因診斷的過程中,需詳細追問患者20年內體質量變化;若既往有糖尿病、高血壓、脂代謝異常等疾病2項以上,患病>5年以上;IgA升高則更加支持NASH肝硬化。其中需始終警惕的是,進展至肝硬化階段,未見明顯脂肪變性不能夠作為排除NASH肝硬化的證據。
4 NAFLD合并其他疾病及與其他肝病的鑒別
NAFLD病理診斷一方面用于評估病情程度,另一方面用于排除或鑒別其他病因如酒精性肝病、藥物性肝損傷、慢性丙型肝炎、遺傳代謝性疾病、營養障礙、乳糜瀉及其他惡性疾病。臨床中,最常見需與酒精性脂肪性肝病鑒別,后者通過病史結合病理特征提供可基本明確。而NAFLD與其他疾病合并或鑒別需要根據具體疾病的主要病理學特征來判斷。
對于有CHB基礎疾病的患者,在病毒量持續低于檢測下限時,仍長期轉氨酶升高,或未經治療的CHB患者,出現轉氨酶升高(以ALT為例),具體主導損傷病因是否是CHB,經肝穿刺活檢可基本確定。對于CHB所致轉氨酶升高或肝臟炎癥,通常無論炎癥或纖維化,均多以匯管區分布為主,而NASH除了有特征性病理改變外,炎癥及纖維化均多見于腺泡3區或竇周纖維化為主。同樣,對于NASH合并其他疾病,區分思路與合并CHB時相似。
5 NAFLD無創診斷
肝活檢的有創性和相對較高的費用、等待活檢結果等因素是其在臨床應用中受到一定限制,因此需要更敏感和特異的NASH無創診斷方法[19]。有效評估肝纖維化程度及必要時動態監測纖維化進展的手段逐年增加[20]。
MRI/MRE為基礎的影像學手段在評估NAFLD/NASH中的優越性遠遠高于其他影像學手段[21]。質子密度脂肪分數(PDFF)對于脂肪變性程度預測較超聲診斷更為精確[22],同時可用于脂肪變化的動態評估,然而PDFF對于NASH炎癥程度、氣球樣變性程度并無線性關系[23],為解決這一矛盾,無創診斷模型MAST評分被提出[24],即PDFF加上AST形成MAST評分,結果提示對于NAS評分≥4,纖維化F≥2的NASH患者疾病進展最為嚴重,而MRI-PDFF和MRI肝臟彈性成像對于肝纖維化程度與組織學纖維化分期較為匹配,MAST評分相較于FIB-4,FAST評分等均能更好的評估患者炎癥及纖維化程度。但仍無法明確區分NAFL和NASH,故無創診斷手段仍存在很大局限性。鑒于以上原因,FDA建議NASH新藥研發2期和3期臨床試驗需以組織學作為研究終點[25]。
6 小結
綜上所述,組織病理學對NAFLD的分級分期診斷至關重要,在準確診斷輕度脂肪變性、精確區分NAFL和NASH、鑒別脂肪變性的病因方面具有不可替代性。有學者建議以脂肪變性為主要損傷模式的肝組織,病理報告需包括下列內容:(1)病理描述部分需評估脂肪變肝損傷的模式,及有無合并其他肝損傷;(2)病理診斷部分繼續列出損傷的總體模式,還需描述主要病變的嚴重程度;(3)如能從臨床資料中得出脂肪變病因,需一并診斷;(4)如能從組織學特征或臨床資料中分析出合并的其他病因肝損傷,需一并診斷;(5)半定量評分作為可選項,在病理醫生和臨床醫生取得共識后可列出。臨床醫生需準確理解NAFLD各階段的組織學特征,方能更好的診治NAFLD。
利益沖突聲明:所有作者均聲明不存在利益沖突。
作者貢獻聲明:田愛平負責撰寫文章;楊永峰負責修改和審核文章。
參考文獻:
[1]
LOOMBA R, ADAMS LA. The 20% rule of NASH progression: The natural history of advanced fibrosis and cirrhosis caused by NASH[J]. Hepatology, 2019, 70(6): 1885-1888. DOI: 10.1002/hep.30946.
[2]SAXENA R. Practical hepatic pathology, a diagnostic approach[M]. 2nd edition. Philadelphia, PA : Elsevier, 2017.
[3]
BRIL F, BARB D, PORTILLO-SANCHEZ P, et al. Metabolic and histological implications of intrahepatic triglyceride content in nonalcoholic fatty liver disease[J]. Hepatology, 2017, 65(4): 1132-1144. DOI: 10.1002/hep.28985.
[4]
POUWELS S, SAKRAN N, GRAHAM Y, et al. Non-alcoholic fatty liver disease (NAFLD): a review of pathophysiology, clinical management and effects of weight loss[J]. BMC Endocr Disord, 2022, 22(1): 63. DOI: 10.1186/s12902-022-00980-1.
[5]
BRUNT EM, KLEINER DE, CARPENTER DH, et al. NAFLD: Reporting histologic findings in clinical practice[J]. Hepatology, 2021, 73(5): 2028-2038. DOI: 10.1002/hep.31599.
[6]BRUNT EM. Pathology of fatty liver disease[J]. Mod Pathol, 2007, 20 (Suppl 1): S40-S48.
[7]FELDSTEIN AE, WIECKOWSKA A, LOPEZ AR, et al. Cytokeratin-18 fragment levels as noninvasive biomarkers for nonalcoholic steatohepatitis: a multicenter validation study[J]. Hepatology, 2009, 50(4): 1072-1078. DOI: 10.1002/hep.23050.
[8]DUAN Y, PAN X, LUO J, et al. Association of inflammatory cytokines with non-alcoholic fatty liver disease[J]. Front Immunol, 2022, 13: 880298. DOI: 10.3389/fimmu.2022.880298.
[9]SANYAL AJ, HARRISON SA, RATZIU V, et al. The natural history of advanced fibrosis due to nonalcoholic steatohepatitis: data from the simtuzumab trials[J]. Hepatology, 2019, 70(6): 1913-1927. DOI: 10.1002/hep.30664.
[10]BRUNT EM. Grading and staging the histopathological lesions of chronic hepatitis: the Knodell histology activity index and beyond[J]. Hepatology, 2000, 31(1): 241-246. DOI: 10.1002/hep.510310136.
[11]LUO J, LIU LW, LIU JM, et al. Comparative study of clinicopathological features, and risk factors of advanced fibrosis between genders with non-alcoholic fatty liver disease[J]. Chin J Hepatol, 2021, 29(4): 356-361. DOI: 10.3760/cma.j.cn501113-20200203-00027.
羅娟, 劉立偉, 劉紀民, 等. 非酒精性脂肪性肝病臨床和病理特點及進展期纖維化危險因素性別差異的對比研究[J]. 中華肝臟病雜志, 2021, 29(4): 356-361. DOI: 10.3760/cma.j.cn501113-20200203-00027.
[12]
ANGULO P, KLEINER DE, DAM-LARSEN S, et al. Liver fibrosis, but no other histologic features, is associated with long-term outcomes of patients with nonalcoholic fatty liver disease[J]. Gastroenterology, 2015, 149(2): 389-397. e10. DOI: 10.1053/j.gastro.2015.04.043.
[13]
TIAN AP, YANG YF. A comparative analysis of pathological grading and staging systems for chronic hepatitis[J]. J Clin Hepatol, 2018, 34(11): 2271-2277. DOI: 10.3969/j.issn.1001-5256.2018.11.002.
田愛平, 楊永峰. 慢性肝炎病理學分級分期評分系統比較[J]. 臨床肝膽病雜志, 2018, 34(11): 2271-2277. DOI: 10.3969/j.issn.1001-5256.2018.11.002.
[14]KLEINER DE, BRUNT EM, van NATTA M, et al. Design and validation of a histological scoring system for nonalcoholic fatty liver disease[J]. Hepatology, 2005, 41(6): 1313-1321. DOI: 10.1002/hep.20701.
[15]BEDOSSA P, POITOU C, VEYRIE N, et al. Histopathological algorithm and scoring system for evaluation of liver lesions in morbidly obese patients[J]. Hepatology, 2012, 56(5): 1751-1759. DOI: 10.1002/hep.25889.
[16]ALKHOURI N, de VITO R, ALISI A, et al. Development and validation of a new histological score for pediatric non-alcoholic fatty liver disease[J]. J Hepatol, 2012, 57(6): 1312-1318. DOI: 10.1016/j.jhep.2012.07.027.
[17]CLEVELAND E, BANDY A, VANWAGNER LB. Diagnostic challenges of nonalcoholic fatty liver disease/nonalcoholic steatohepatitis[J]. Clin Liver Dis (Hoboken), 2018, 11(4): 98-104. DOI: 10.1002/cld.716.
[18]LONGERICH T, SCHIRMACHER P. Determining the reliability of liver biopsies in NASH clinical studies[J]. Nat Rev Gastroenterol Hepatol, 2020, 17(11): 653-654. DOI: 10.1038/s41575-020-00363-8.
[19]CASTERA L, FRIEDRICH-RUST M, LOOMBA R. Noninvasive assessment of liver disease in patients with nonalcoholic fatty liver disease[J]. Gastroenterology, 2019, 156(5): 1264-1281.e4. DOI: 10.1053/j.gastro.2018.12.036.
[20]KWOK R, TSE YK, WONG GL, et al. Systematic review with meta-analysis: non-invasive assessment of non-alcoholic fatty liver disease-the role of transient elastography and plasma cytokeratin-18 fragments[J]. Aliment Pharmacol Ther, 2014, 39(3): 254-269. DOI: 10.1111/apt.12569.
[21]MIDDLETON MS, HEBA ER, HOOKER CA, et al. Agreement between magnetic resonance imaging proton density fat fraction measurements and pathologist-assigned steatosis grades of liver biopsies from adults with nonalcoholic steatohepatitis[J]. Gastroenterology, 2017, 153(3): 753-761. DOI: 10.1053/j.gastro.2017.06.005.
[22]TAOULI B, SERFATY L. Magnetic resonance imaging/elastography is superior to transient elastography for detection of liver fibrosis and fat in nonalcoholic fatty liver disease[J]. Gastroenterology, 2016, 150(3): 553-556. DOI: 10.1053/j.gastro.2016.01.017.
[23]WILDMAN-TOBRINER B, MIDDLETON MM, MOYLAN CA, et al. Association between magnetic resonance imaging-proton density fat fraction and liver histology features in patients with nonalcoholic fatty liver disease or nonalcoholic steatohepatitis[J]. Gastroenterology, 2018, 155(5): 1428-1435.e2. DOI: 10.1053/j.gastro.2018.07.018.
[24]NOUREDDIN M, TRUONG E, GORNBEIN JA, et al. MRI-based (MAST) score accurately identifies patients with NASH and significant fibrosis[J]. J Hepatol, 2022, 76(4): 781-787. DOI: 10.1016/j.jhep.2021.11.012.
[25]RINELLA ME, TACKE F, SANYAL AJ, et al. Report on the AASLD/EASL joint workshop on clinical trial endpoints in NAFLD[J]. J Hepatol, 2019, 71(4): 823-833. DOI: 10.1016/j.jhep.2019.04.019.
收稿日期:
2022-01-15;錄用日期:2022-02-20
本文編輯:林姣

