阿奇霉素:多功能的抗生素藥物
趙麗鳳 袁征 李鷹飛
摘要:阿奇霉素是一種在紅霉素化學結構基礎上修飾而得到的大環內酯類抗生素。作為第二代大環內酯類抗生素,阿奇霉素抗菌譜與紅霉素相仿,具有廣譜抗菌的特點,但其抗菌活性明顯改善。近些年研究發現,除基本的抗菌作用外,阿奇霉素還具有抗炎、調節免疫、抗病毒以及抗瘧疾等藥理作用,其臨床應用范圍不斷擴大。本文對阿奇霉素的藥理作用及相關作用機制進行了綜述,以期為其臨床應用提供科學指導。
關鍵詞:阿奇霉素;抗菌;抗炎;免疫調節;抗病毒;抗瘧
中圖分類號:R978.1? ? ? ? ?文獻標志碼:A? ? ? ? ?文章編號:1001-8751(2023)01-0033-06
Azithromycin: A Multifunctional Antibiotic Drug
Zhao Li-feng,? ?Yuan Zheng,? ?Li Ying-fei
(Institute of Chinese Materia Medica, China Academy of Chinese Medical Sciences,? ?Beijing? ?100700)
Abstract: Azithromycin is a macrolide antibiotic obtained by modifying the chemical structure of erythromycin. As a second-generation macrolide antibiotic, azithromycin has a similar antibacterial spectrum to erythromycin, so it has the characteristics of broad-spectrum antibacterial, but its antibacterial activity is significantly improved. In recent years, researchers have found that in addition to the basic antibacterial effect, azithromycin has other pharmacological effects, such as anti-inflammatory, immune regulation, antiviral and antimalarial. Therefore, the scope of clinical application of azithromycin continues to expand. This article reviews the pharmacological effects and mechanism of action of azithromycin for its scientific clinical application.
Key words: azithromycin; antibacterial; anti-inflammatory; immune regulation; antiviral; antimalarial
阿奇霉素是一種半合成的十五元環大環內酯類抗生素,由紅霉素A9-酮基產生肟化作用后經貝克曼重排、N-甲基化等一系列反應所得[1]。阿奇霉素于1980年由克羅地亞普利瓦制藥公司研制,次年被推出市場[2]。阿奇霉素對革蘭陰性細菌、厭氧菌及其他病原體均有很強的活性,尤其對流感嗜血菌具有明顯的抑制作用。由于用藥安全系數高,阿奇霉素被世界衛生組織列為最安全的藥物之一[3],也被列入基本藥物清單,并在全球大規模生產[4]。
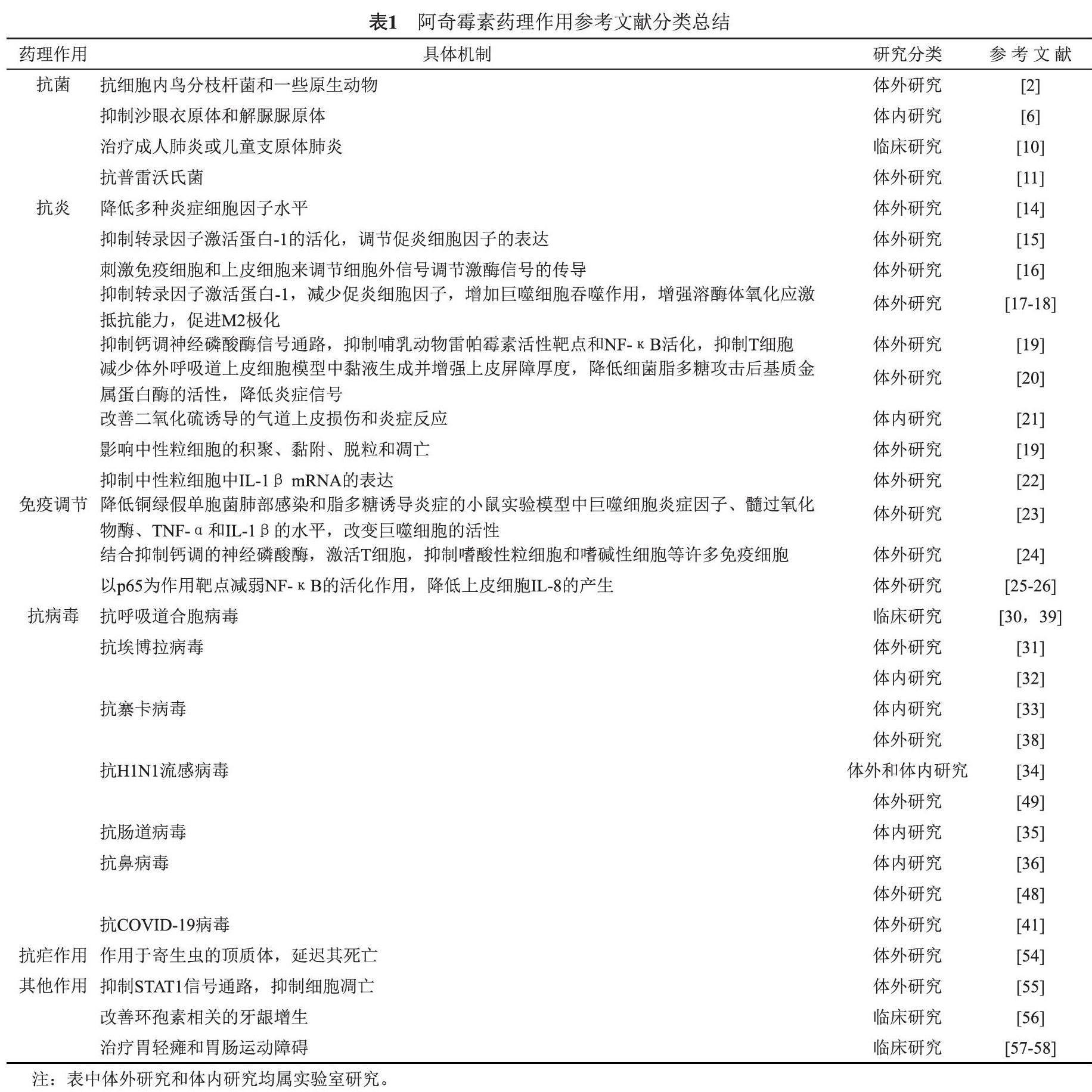
研究表明,作為一種長效抗生素,阿奇霉素不僅具有較好的抗菌活性,還具有抗炎、調節免疫功能、抗病毒、抗瘧疾等作用。此外,在近兩年肆虐全球的新型冠狀病毒肺炎(COVID-19)的治療中,阿奇霉素也表現出較好的抗炎及免疫調節作用。因此,阿奇霉素可能會成為一個老藥新用的典型范例。本文查找了近二十年來關于阿奇霉素的相關文獻報道,就阿奇霉素的抗菌、抗炎、調節免疫功能、抗病毒、抗瘧疾等藥理作用進行了綜述,按照其藥理作用差異將相關文獻進行了分類(詳見表1),并討論了其藥理作用的分子機制及臨床應用,旨在為阿奇霉素的科學研究及臨床應用提供指導。
1 抗菌作用
阿奇霉素具有紅霉素的重組結構,對革蘭陽性菌的活性不如紅霉素,但對流感嗜血桿菌、卡他莫拉菌等革蘭陰性菌的活性要比紅霉素高得多,對大腸埃希菌、沙門菌和志賀菌等腸桿菌目也有活性。此外,阿奇霉素對嗜肺軍團菌、伯氏疏螺旋體、肺炎支原體等也有抑制作用。已有研究發現,阿奇霉素比紅霉素抗大腸埃希菌、肺炎鏈球菌的能力至少強5倍,抗流感嗜血桿菌的能力至少強10倍[5]。更有意義的是,阿奇霉素對沙眼衣原體和解脲脲原體的抑制能力比紅霉素更強[6]。此外,阿奇霉素對細胞內鳥分枝桿菌和一些原生動物也具有較強活性[2]。
一般來說,阿奇霉素的抗菌機制與紅霉素大致相同,即通過可逆地結合敏感微生物的50S核糖體亞基,以阻止新生肽鏈的翻譯與組裝,最終抑制依賴細胞中心法則的細菌蛋白質的翻譯過程以抑制細菌生長,實現抗菌作用[7-8]。但是,阿奇霉素的酸穩定性強于紅霉素,更容易通過胃腸道吸收。同時,阿奇霉素的細胞組織分布更加均勻,并且具有持久的高濃度組織,半衰期可長達40 h,因而抗菌時間較紅霉素更長。
在呼吸道感染、口腔厭氧菌感染、皮膚感染、軟組織感染及泌尿生殖系統感染等臨床疾病的治療中,阿奇霉素發揮了重要作用。并且,在臨床上由于服用阿奇霉素而引起的不良反應發生率相對較低,因此阿奇霉素安全性高,可靠性強,易于患者接受[9]。此外,因具有廣泛抗菌譜,阿奇霉素也常用于成人肺炎或兒童支原體肺炎的治療[10]。另有研究表明,阿奇霉素可以減少普雷沃菌引起的炎癥,是普雷沃菌感染的可能治療藥物[11]。
2 抗炎作用
阿奇霉素具有顯著的抗炎活性[12-13]。研究表明,阿奇霉素能夠降低多種炎癥細胞因子的水平,包括白細胞介素(IL)-1β、IL-2、腫瘤壞死因子(TNF)和粒細胞—巨噬細胞集落刺激因子(GM-CSF)等[14]。阿奇霉素也被認為能夠抑制IL-6和IL-12,并促進活化的小鼠巨噬細胞產生IL-10。有證據表明,這些抗炎作用是通過抑制核因子-κB(NF-κB)的激活來實現的。此外,阿奇霉素還可以抑制轉錄因子激活蛋白-1(AP-1)的活化,而這些激活因子能夠調節IL-8、IL-6、TNF-α和IL-1β等促炎細胞因子的表達[15]。因此,阿奇霉素降低IL-8產生也可能是通過其抑制絲裂原活化蛋白激酶和細胞外調節激酶。
阿奇霉素的抗炎作用主要表現在免疫細胞和上皮細胞中。一些研究發現,阿奇霉素對免疫細胞和上皮細胞具有刺激作用,并通過刺激中性粒細胞脫粒和吞噬作用相關的氧化暴發來調節細胞外信號調節激酶1/2(ERK1/2)信號傳導[16]。這些初始刺激作用之后,AP-1、NF-κB、炎癥細胞因子和黏蛋白得到釋放,從而發揮阿奇霉素整體的抗炎作用。在巨噬細胞中,阿奇霉素通過抑制AP-1靶點來減少脂多糖誘導的促炎細胞因子,增加細胞吞噬作用,實現溶酶體對氧化應激抵抗能力的增強以及巨噬細胞M2極化的促進[17-18]。阿奇霉素還可以通過抑制鈣調神經磷酸酶信號通路、哺乳動物雷帕霉素活性靶點和NF-κB活化來抑制T細胞[19]。此外,在體外呼吸道上皮細胞模型中,阿奇霉素能夠減少黏液生成并增強上皮屏障厚度,還可以降低細菌脂多糖攻擊后基質金屬蛋白酶(MMP)的活性,從而降低炎癥信號,這有助于保持細胞的完整性和上皮屏障的功能性[20]。已有研究證實,阿奇霉素可以改善二氧化硫誘導的氣道上皮損傷和炎癥反應[21]。
阿奇霉素以粒細胞為靶點具有一定程度的特異性,富集于粒細胞溶酶體中,影響中性粒細胞的積聚、黏附、脫粒和凋亡[19]。Gibson等[22]的體外研究證實,8 μg/mL濃度的阿奇霉素可以持續抑制中性粒細胞中IL-1β mRNA的表達。阿奇霉素易集中于中性粒細胞浸潤增加的感染和炎癥部位,可能與中性粒細胞攝取阿奇霉素和其在感染部位釋放緩慢有關,延長了其作用時間。此外,阿奇霉素通過影響黏附蛋白的表達、降低趨化性和氧化暴發來調節多形核中性白細胞的功能。因此,阿奇霉素通過多種機制抑制中性粒細胞對細胞因子和趨化因子基因的表達。
3 免疫調節作用
阿奇霉素具有多種免疫調節作用,其免疫調節作用與抗炎作用是密切聯系的。在銅綠假單胞菌肺部感染和脂多糖誘導炎癥的小鼠實驗模型中,阿奇霉素能夠明顯降低巨噬細胞炎癥因子、髓過氧化物酶、TNF-α和IL-1β的水平,進而改變巨噬細胞的活性[23]。
以阿奇霉素為代表的大環內酯進行免疫調節的主要途徑包括:大環內酯與抑制鈣調的神經磷酸酶結合,從而激活T細胞,隨后嗜酸性粒細胞和嗜堿性細胞等許多免疫細胞被抑制[24]。此外,阿奇霉素能夠以p65為作用靶點減弱其下游成分肺上皮細胞NF-κB的活化作用,從而降低上皮細胞IL-8的產生[25-27]。另外,在哺乳動物細胞中,阿奇霉素能夠以細胞內絲裂原活化蛋白激酶(MAPK)為靶點,影響ERK1/2和ERK下游的NF-κB通路。ERK1/2和NF-κB通路涉及炎癥細胞因子表達、細胞增殖和黏蛋白分泌等細胞功能,因而阿奇霉素的免疫調節功能可通過此通路進行解釋。值得關注的是,COVID-19對人體免疫系統的影響也與ERK1/2和NF-κB通路有關,因此阿奇霉素在COVID-19患者中的免疫調節作用也可用此機理進行解釋[28]。
由于具有免疫調節作用,阿奇霉素可以有效治療囊性纖維化(CF)、非CF型支氣管擴張、慢性阻塞性肺病、慢性鼻竇炎、敗血癥和彌漫性全細支氣管炎等多種慢性肺部疾病[29]。
4 抗病毒作用
阿奇霉素具有抗病毒特性,可以與其他抗病毒藥物協同工作。大量病毒臨床用藥和科學實驗證實了阿奇霉素的抗病毒活性,這些病毒種類包括呼吸道合胞病毒[30]、埃博拉病毒[31-32]、寨卡病毒[33]、H1N1流感病毒[34]、腸道病毒[35]和鼻病毒[36]。體外抗病毒活性研究顯示,除H1N1流感病毒外,阿奇霉素對上述病毒的50%抑制濃度范圍為1~6 μmol/L[37]。在治療寨卡病毒的2 177種藥物篩選實驗中,阿奇霉素被證實能夠減少神經膠質細胞系和人類星形膠質細胞中的病毒增殖和病毒誘導所致的細胞病變效應[38]。此外,阿奇霉素對呼吸道合胞病毒的抑制活性在嬰兒的隨機研究中亦得到了證實[39]。另外,阿奇霉素對埃博拉病毒的有效預防也在小動物模型實驗中得以驗證[32]。更具有現實意義的是,阿奇霉素抑制COVID-19病毒活性,且能夠與其他藥物協同抵抗COVID-19病毒循環[40]。Andreani等[41]報道了阿奇霉素單獨用藥也具有顯著抗COVID-19病毒的作用。
阿奇霉素抵抗不同病毒的具體作用機制不同。阿奇霉素能減少病毒進入細胞,并通過多種作用增強機體對病毒的免疫應答[34,42]。數據表明,阿奇霉素具有誘導模式識別受體、干擾素(IFN)和IFN刺激基因的能力以使病毒復制減少。阿奇霉素還能夠直接作用于支氣管上皮細胞,維持其功能,以減少黏液分泌,促進肺功能[28]。在病毒感染的宿主細胞中,阿奇霉素誘導細胞內抗病毒基因的mRNA和IFN刺激基因的表達,最終通過增加IFN通路介導的抗病毒反應實現抗病毒功能[43]。阿奇霉素還可通過上調I型、Ⅲ型干擾素(尤其是干擾素-β和干擾素-λ)[44-45]、病毒識別的基因如MDA5和RIG-I的表達實現抗病毒功能[46-47]。阿奇霉素可以減少原代人支氣管上皮細胞體外感染期間鼻病毒的復制和釋放,這一發現也在囊性纖維化患者中得到證實,阿奇霉素再次治療可使病毒脫落大幅減少[48]。最近的研究數據也顯示阿奇霉素可以使A549細胞中的H1N1病毒復制減少,半抑制濃度(IC50值)為68 μmol/L[34,49]。阿奇霉素可以有效地抑制寨卡病毒感染,在病毒感染后期,阿奇霉素還能上調I型和Ⅲ型的IFNs及其下游ISGs表達。阿奇霉素還能誘導抗病毒模式識別受體(PRRs)MDA5和RIG-1的表達并提升TBK1和IRF3的磷酸化水平實現抗病毒作用[44]。
值得注意的是,因其有抗COVID-19病毒的作用[40-41],阿奇霉素在臨床上曾被納為治療COVID-19的處方之一,但經Molina等[50]和Hraiech等[51]研究,發現阿奇霉素單獨以及聯合用藥并未展現出降低死亡率或消除病毒方面的作用,因而阿奇霉素僅適用于與該疾病相關的細菌合并感染的治療,世界衛生組織不再建議在新冠肺炎的治療中使用阿奇霉素[52-53]。因此,阿奇霉素對于新冠肺炎的有效性有待深入研究。
5 抗瘧作用
阿奇霉素聯合青蒿琥酯或奎寧應用對瘧疾有效。阿奇霉素—青蒿琥酯和阿奇霉素—奎寧是治療無并發癥惡性瘧疾安全有效的聯合途徑,值得在特殊患者人群中進一步研究。Dahl等[54]也通過實驗證明了阿奇霉素的抗瘧作用,發現阿奇霉素可以作用于寄生蟲的頂質體,延遲其死亡,但其確切機制有待研究。
6 其他作用
阿奇霉素具有抑制細胞凋亡的功能。有學者將阿奇霉素作用于高糖誘導的足細胞,發現細胞凋亡明顯減少,這可能與阿奇霉素能夠通過抑制STAT1信號通路抑制細胞凋亡有關[55]。此外,阿奇霉素還具有某些抗感染功效,可能對遲發性哮喘有效。另外,在早期給藥時,阿奇霉素可改善環孢素相關的牙齦增生[56]。目前研究發現,阿奇霉素在治療胃輕癱和胃腸運動障礙方面也具有廣闊的應用前景[57-58]。
7 結語
因其多種藥理作用,阿奇霉素的臨床應用越來越廣泛。但阿奇霉素作為一種抗生素藥物,其耐藥性仍然是一個世界范圍內的健康問題,可能導致阿奇霉素治療失敗。據估計,12%使用1 g阿奇霉素治療的感染患者在治療后會產生大環內酯耐藥。因此,亟需有更多阿奇霉素耐藥性的相關研究,以對阿奇霉素耐藥性的發展進行監測,從而建立阿奇霉素耐藥性的分子機制,使其發揮更安全、更有效的臨床作用。此外,阿奇霉素雖然被世界衛生組織列為最安全的藥物之一,但在實際應用中仍然具有厭食、消化不良、脹氣、頭暈、頭痛等潛在的副作用,因此在臨床應用中,開具阿奇霉素處方時需加以謹慎,以使其更好地發揮臨床價值。
參 考 文 獻
Kirst H A. Recent progress in the chemical synthesis of antibiotics[M]. Springer-Verlag, 1990:44-45.
Bakheit A H, Al-Hadiya B M, Abd-Elgalil A A. Azithromycin[J].? Profiles Drug Subst Excip Relat Methodol, 2014, 39:21-40.
World Health Organization Model List of Essential Medicines: 21st List[Z]. World Health Organization, Geneva, 2019, 7:10.
Laopaiboon M, Panpanich R, Swa Mya K. Azithromycin for acute lower respiratory tract infections[J].? Cochrane Database Syst Rev, 2015, (3):CD001954.
吳超男, 陳娜娜, 李玉琴. 阿奇霉素研究進展[J]. 泰山醫學院學報, 2016, 37(11): 1317-1320.
Kuehne J J, Yu A L, Holland G N, et al. Corneal pharmacokinetics of topically applied azithromycin and clarithromycin[J]. Am J Ophthalmol, 2004, 138(4): 547-553.
Shi J, Liu Y, Zhang Y, et al. PA5470 counteracts antimicrobial effect of azithromycin by releasing stalled ribosome in Pseudomonas aeruginosa [J]. Antimicrob Agents Chemother, 2018, 62(2): 1867-1877.
Lin L, Lu L, Cao W, et al. Hypothesis for potential pathogenesis of SARS-CoV-2 infection—a review of immune changes in patients with viral pneumonia[J]. Emerg Microbes Infect, 2020, (9): 727-732.
紀慧. 阿奇霉素的藥理作用和臨床應用研究[J]. 中國現代藥物應用, 2019, 13(01): 129-131.
林銀英, 黃燦坤, 李莉. 阿奇霉素藥理作用和臨床應用效果研究[J]. 海峽藥學, 2019, 31(06): 219-220
Choi E Y, Jin J Y, Choi J I, et al. Effect of azithromycin on Prevotella intermedia lipopolysaccharide-induced production of interleukin-6 in murine macrophages[J]. Eur J Pharmacol, 2014, (729): 10-16.
Jaffé A, Bush A. Anti-inflammatory effects of macrolides in lung disease[J]. Pediatr? Pulmonol, 2001, (31): 464-473 .
Gibson P G, Yang I A, Upham J W, et al. Effect of azithromycin on asthma exacerbations and quality of life in adults with persistent uncontrolled asthma (AMAZES): a randomised, double-blind, placebo-controlled trial[J].? Lancet, 2017, 390(10095): 659-668.
Cigana C, Assael B M, Melotti P. Azithromycin selectively reduces tumor necrosis factor alpha levels in cystic fibrosis airway epithelial cells[J]. Antimicrob Agents Chemother, 2007, 51(3): 975-981.
Desaki M, Takizawa H, Ohtoshi T, et al.Erythromycin suppresses nuclear factor-kappa B and activator protein-1 activation in human bronchial epithelial cells[J]. Biochem Biophys Res, 2000, (267): 124-128
Ishimoto H, Mukae H, Sakamoto N, et al. Different effects of telithromycin on MUC5AC production induced by human neutrophil peptide-1 or lipopolysaccharide in NCI-H292 cells compared with azithromycin and clarithromycin[J]. J Antimicrob Chemother, 2009, 63(1): 109-114.
Hodge S, Hodge G, Jersmann H, et al. Azithromycin improves macrophage phagocytic function and expression of mannose receptor in chronic obstructive pulmonary disease[J]. Am J Respir Crit Care Med, 2008, 178(2): 139-148.
Hodge S, Hodge G, Brozyna S, et al. Azithromycin increases phagocytosis of apoptotic bronchial epithelial cells by alveolar macrophages[J]. Eur Respir J, 2006, 28(3): 486-495.
Oliver M E, Hinks T S C. Azithromycin in viral infections[J]. Rev Med Virol, 2021, 31(2): 2163.
Nuji?c K, Banjanac M, Muni?c V, et al. Impairment of lysosomal functions by azithromycin and chloroquine contributes to anti-inflammatory phenotype[J]. Cell Immunol, 2012, 279 (1):78-86.
Joelsson J P, Kricker J A, Arason A J, et al. Azithromycin ameliorates sulfur dioxide-induced airway epithelial damage and inflammatory responses[J]. Respir Res, 2020, 21(1): 233.
Gibson M P, Walters J D. Inhibition of neutrophil inflammatory mediator expressiony bazithromycin[J]. Clin Oral Investig, 2020, 24(12): 4493-4500.
Parnham M J, Haber V E, Giamarellos-Bourboulis E J, et al. Azithromycin: mechanisms of action and their relevance for clinical applications[J]. Pharmacol Ther, 2014, (143): 225-245.
Rolfe F G, Valentine J E, Sewell W A. Cyclosporin A and FK506 reduce interleukin-5 mRNA abundance by inhibiting gene transcription[J]. Am J Respir Cell Mol Biol, 1997, 17(2): 243-250.
Lendermon E A, Coon T A, Bednash J S, et al. Azithromycin decreases NALP3 mRNA stability in monocytes to limit inflammasome-dependent inflammation[J]. Respir Res, 2017, 18(1): 131.
Yamauchi K, Shibata Y, Kimura T, et al. Azithromycin suppresses interleukin-12p40 expression in lipopolysaccharide and interferon-gamma stimulated macrophages[J]. Int J Biol Sci, 2009, 5(7): 667-678.
Desaki M, Okazaki H, Sunazuka T, et al. Molecular mechanisms of anti-inflammatory action of erythromycin in human bronchial epithelial cells: possible role in the signaling pathway that regulates nuclear factor-κB activation[J]. Antimicrob Agents Chemother, 2004, 48(5): 1581-1585.
Kanoh S, Rubin B K. Mechanisms of action and clinical application of macrolides as immunomodulatory medications[J]. Clin Microbiol Rev, 2010, 23(3): 590-615.
Cramer C L, Patterson A, Alchakaki A, et al. Immunomodulatory indications of azithromycin in respiratory disease: a concise review for the clinician[J]. Postgrad Med, 2017, 129(5): 493-499.
Srinivasan M, Bacharier L B, Goss C W, et al. The azithromycin to prevent wheezing following severe RSV bronchiolitis-Ⅱ clinical trial: rationale, study design, methods, and characteristics of study population[J]. Contemp Clin Trials Commun, 2021, 22: 100798.
Du X, Zuo X, Meng F, et al. Combinatorial screening of a panel of FDA-approved drugs identi es several candidates with anti-Ebola activities[J]. Biochem Biophys Res Commun,? 2020, 522: 862-868.
Madrid P B, Panchal R G, Warren T K, et al. Evaluation of ebola virus inhibitors for drug repurposing[J].? ACS Infect Dis, 2015, 1(7): 317-326.
Wu Y H, Tseng C K, Lin C K, et al. ICR suckling mouse model of Zika virus infection for disease mode- ling and drug validation[J]. PLoS Neglected Trop Dis, 2018, 12: 6848.
Tran D H, Sugamata R, Hirose T, et al. Azithromycin, a 15-membered macrolide antibi- otic, inhibits in uenza (H1N1)pdm09 virus infection by inter- fering with virus internalization process[J]. J Antibiot, 2019, 72: 759-768.
Zeng S, Meng X, Huang Q, et al. Spiramycin and azithromycin, safe for administration to children, exert antiviral activity against enterovirus A71 In vitro and in vivo[J]. Int J Antimicrob Agents, 2019, 53: 362-369.
Mosquera RA, De Jesus-Rojas W, Stark JM, et al. Role of prophylactic azithromycin to reduce air- way in ammation and mortality in a RSV mouse infection model[J]. Pediatr Pulmonol, 2018, 53: 567-574.
Damle B, Vourvahis M, Wang E, et al. Clinical pharmacology perspectives on the antiviral activity of azithromycin and use in COVID-19[J]. Clin Pharmacol Ther, 2020, 108(2): 201-211.
Retallack H, Di Lullo E, Arias C, et al. Zika virus cell tropism in the developing human brain and inhibition by azithromycin[J]. Proc Natl Acad, 2016, 113(50): 14408-14413.
Beigelman A, Isaacson-Schmid M, Sajol G, et al. Randomized trial to evaluate azithromycins effects on serum and upper airway IL-8 levels and recurrent wheezing in infants with respiratory syncytial virus bronchiolitis[J]. J Allergy Clin Immunol, 2015, 135: 1171-1178.
Echeverría-Esnal D, Martin-Ontiyuelo C, Navarrete-Rouco M E, et al. Azithromycin in the treatment of COVID-19: a review[J]. Expert Rev Anti Infect Ther, 2021,19 (2): 147-163.
Andreani J, Le Bideau M, Duflot I, et al. In vitro testing of combined hydroxychloroquine and azithromycin on SARS-CoV-2 shows synergistic effect[J].? Microb Pathog, 2020, 145: 104228.
Yao X, Ye F, Zhang M, et al. In vitro antiviral activity and projection of optimized dosing design of hydroxychloroquine for the treatment of severe acute respiratory syndrome coronavirus 2 (SARS-CoV-2)[J].? Clin Infect Dis, 2020, 71(15): 732-739.
Cure M C, Kucuk A, Cure E. Colchicine may not be effective in COVID-19 infection; it may even be harmful[J]. Clin Rheumatol, 2020, 39 (7): 2101-2102.
Li C, Zu S, Deng Y Q, et al. Azithromycin protects against zika virus infection by upregulating virus-induced type I and Ⅲ interferon responses[J].? Antimicrob Agents Chemother, 2019, 63(12): 394-419.
Menzel M, Akbarshahi H, Bjermer L, et al. Azithromycin induces anti-viral effects in cultured bronchial epithelial cells from COPD patients[J]. Sci Rep, 2016, 6: 28698.
Gautret P, Lagier J C, Parola P, et al. Hydroxychloroquine and azithromycin as a treatment of COVID-19: results of an open-label non-randomized clinical trial[J].? Int J Antimicrob Agents, 2020, 56(1): 105949.
Sch?gler A, Kopf B S, Edwards M R, et al. Novel antiviral properties of azithromycin in cystic fibrosis airway epithelial cells[J]. Eur Respir J, 2015, 45: 428-439.
Gielen V, Johnston S L, Edwards M R. Azithromycin induces anti-viral responses in bronchial epithelial cells[J]. Eur Respir J, 2010, 36(3): 646-654.
Du X, Zuo X, Meng F, et al. Direct inhibitory effect on viral entry of influenza A and SARS-CoV-2 viruses by azithromycin[J]. Cell Prolif, 2021, 54 (1): 12953.
Molina J M, Delaugerre C, Le Goff J, et al. No evidence of rapid antiviral clearance or clinical benefit with the combination of hydroxychloroquine and azithromycin in patients with severe COVID-19 infection[J]. Med Mal Infect, 2020, 50(4): 384.
Hraiech S, Bourenne J, Kuteifan K, et al. Lack of viral clearance by the combination of hydroxychloroquine and azithromycin or lopinavir and ritonavir in SARS-CoV-2-related acute respiratory distress syndrome[J]. Ann Intensive Care, 2020,10(1):63.
Rosenberg E S, Dufort E M, Udo T, et al. Association of treatment with hydroxychloroquine or azithromycin with in-hospital mortality in patients with COVID-19 in New York State[J]. JAMA, 2020, 323: 2493-2502.
Kim D, Lee J Y, Yang J S, et al. The architecture of SARS-CoV-2 transcriptome[J]. Cell, 2020, 181: 914-921.
Dahl E L, Rosenthal P J. Multiple antibiotics exert delayed effects against the plasmodium falciparum apicoplast[J]. Antimicrob Agents Chemother, 2007, 51: 3485-3490.
Xing Y W, Liu K Z. Azithromycin inhibited oxidative stress and apoptosis of high glucose-induced podocytes by inhibiting STAT1 pathway[J]. Drug Dev Res, 2021, 82(7): 990-998.
Gomez E, Sanchez-Nunez M, Sanchez J E, et al. Treatment of cyclosporin-induced gingival hyperplasia with azithromycin[J]. Nephrol Dial Transplant, 1997, 12 (12): 2694-2697.
Chini P, Toskes P P, Waseem S, et al. Mcdonald, B. moshiree, effect of azithromycin on small bowel motility in patients with gastrointestinal dysmotility[J]. Scand J Gastroenterol, 2012, 47(4): 422-427.
Moshiree B, Mcdonald R, Hou W, et al. Comparison of the effect of azithromycin versus erythromycin on antroduodenal pressure profiles of patients with chronic functional gastrointestinal pain and gastroparesis[J]. Dig Dis Sci, 2010, 55 (3): 675-683.

