益氣活血藥方對心肌缺血再灌注損傷模型大鼠氧化應激及線粒體能量代謝的影響※
黃小樓 平蘭芝 譚曉波 王 惠 蔡 倩 郭書文△
(1.貴州中醫藥大學針灸推拿學院,貴州 貴陽 550025;2.北京中醫藥大學中醫學院,北京 100029)
心肌缺血再灌注損傷是心力衰竭患者圍手術期常見的并發癥之一,不僅影響再灌注的治療效果,還可加劇心力衰竭[1-2]。益氣活血藥方是由黃芪、當歸、人參、川芎、三七等組成,是在經典方劑當歸補血湯的基礎上加味形成的治療心系疾病的經驗方劑[3]。前期研究表明,益氣活血藥方具有保護心臟作用,可促進心臟微血管形成,改善心肌細胞肥大,減輕心肌凋亡[4]。代謝組學研究也發現,益氣活血藥方可能通過轉化生長因子β1(TGF-β1)/Notch信號調節心臟功能,在能量代謝上對心室重塑有一定改善,并對線粒體動力學相關蛋白有一定影響[5],但具體作用機制尚不明了。為進一步研究益氣活血藥方作用機制,本研究構建心肌缺血再灌注損傷大鼠模型,觀察益氣活血藥方對實驗大鼠心肌缺血再灌注損傷時線粒體功能和能量代謝的影響,探討其對心肌保護作用,結果如下。
1 材料與方法
1.1 實驗動物 無特定病原體(SPF)SD雄性大鼠50只,體質量(200±20)g,于北京中醫藥大學東直門醫院中醫內科學重點實驗室SPF級實驗動物房分籠飼養,均購于北京維通利華實驗動物技術有限公司,生產許可證編號:SCXK(京)2016-0006。
1.2 實驗藥物 益氣活血藥方:由生黃芪、人參、當歸、川芎、三七組成,按照2∶2∶1∶1∶1藥量配伍[5],依據口服劑工藝制備,按處方比例稱取中藥材,加9倍量水,煎煮3次,每次2 h,共6 h,煎液過濾,濃縮,分裝后滅菌備用,藥材提供及制備均由中日友好醫院藥劑科完成;氯喹(自噬抑制劑,美國Sigma公司);注射用異戊巴比妥鈉(上海新亞藥業有限公司,國藥準字H31021724)。
1.3 主要試劑及儀器 活性氧(ROS)、過氧化氫酶(CAT)、總抗氧化能力(T-AOC)檢測試劑盒(上海酶聯生物科技有限公司);三磷酸腺苷(ATP)檢測試劑盒、超微量鈉離子(Na+)-鉀離子(K+)-ATP酶檢測試劑盒、超微量鈣離子(Ca2+)-ATP酶檢測試劑盒(南京建成生物工程研究所);線粒體蛋白分離緩沖液(天津科維諾生物科技有限公司);磷酸鹽緩沖液(PBS,中國上海碧云天生物工程研究所);ALC-V8型小動物呼吸機(上海奧爾科特生物科技有限公司);VevoTM2100高分辨率小動物超聲成像系統(加拿大Visual Sonics公司);BX53生物顯微鏡(日本Olympus公司);Pheom Prox電子顯微鏡[復納科學儀器(上海)有限公司]。
1.4 實驗方法
1.4.1 實驗分組 將50只SD大鼠隨機分為假手術組、模型組、益氣活血藥組、氯喹組、益氣活血藥+氯喹組,每組各10只。
1.4.2 模型制備 除假手術組外,其余各組均采用左冠狀動脈前降支結扎法構建心肌缺血再灌注損傷模型,1%注射用戊巴比妥鈉(40 mg/kg)腹腔麻醉,經口氣管插管,連接小動物呼吸機行機械通氣,監測導聯心電圖。于左側胸壁第3~4肋間距離胸骨左緣約0.5 cm做切口,逐層鈍性分離開胸,經左冠狀動脈前降支進行結扎,缺血30 min后松開結扎線,以心肌缺血區恢復紅潤、ST段回落、T波恢復為再灌注成功的標志[6]。假手術組于左冠狀動脈前降支穿線但不進行結扎,其余步驟同建模組。
1.4.3 給藥方法 益氣活血藥組于造模后次日按8.2 g/(kg·d)予益氣活血藥液灌胃,氯喹組在造模前30 min腹腔注射10 mg/kg氯喹,造模后次日予2 mL無菌蒸餾水灌胃;益氣活血藥+氯喹組在造模前30 min腹腔注射10 mg/kg氯喹,造模后次日按8.2 g/(kg·d)予益氣活血藥液灌胃;模型組和假手術組均于術后次日給予2 mL無菌蒸餾水灌胃,各組均連續灌胃4周后進行下一步實驗。
1.5 觀察指標及方法
1.5.1 心肌組織病理 采用蘇木素-伊紅(HE)染色觀察心肌組織病理變化。1%注射用戊巴比妥鈉(40 mg/kg)腹腔注射麻醉大鼠,麻醉生效后,頸椎脫臼法處死,解剖,取適量心肌均勻切成片,厚度約5.0 μm,置于包埋盒內,4%多聚甲醛中固定過夜,常規脫水,石蠟包埋,依次浸泡脫蠟,蘇木素染色40 s,沖洗后置于伊紅溶液染色3 s,自來水沖洗,沖洗后進行脫水和透明處理[7],隨后使用中性樹脂覆蓋玻片進行封固。光學顯微鏡下觀察心肌組織病理情況并采集圖片,各組取10個樣本。
1.5.2 心功能指標 采用超聲檢測心功能指標。1%注射用戊巴比妥鈉(40 mg/kg)腹腔注射麻醉大鼠,麻醉生效后,取左側側臥位,取胸骨旁長軸觀,測量記錄左室舒張末期內徑(LVEDd)、左室收縮末期內徑(LVESd),計算左室射血分數(LVEF)和左室短軸縮短率(LVFS),各組取10個樣本。
1.5.3 心肌組織氧化應激指標 各組取新鮮心肌組織約200 mg,預冷0.9%氯化鈉注射液中漂洗后,除去血液,采用手術剪將心肌組織塊剪碎,轉移至勻漿管中,制成10%的組織漿液,離心10 min,取上清液,檢測心肌組織中ROS、CAT、T-AOC水平,各組取10個樣本。
1.5.4 心肌細胞線粒體超微結構變化 各組取新鮮心肌組織約200 mg,浸入5%戊二酸溶液,經過固定,脫水,包埋,超薄切片,梓檬染色10 min,去二氧化碳的雙蒸水清洗,醋酸鈾染色30 min,雙蒸水清洗,干燥,然后在電子顯微鏡下觀察細胞線粒體超微結構變化情況并采集圖片,各組取10個樣本。
1.5.5 心肌細胞線粒體能量代謝指標 各組取大鼠新鮮心肌組織約200 mg,預冷0.9%氯化鈉注射液中漂洗,將心肌組織塊剪碎,轉移至勻漿管中,制成10%的組織漿液,加入1 mg/mL線粒體蛋白分離緩沖液及1 mL 10%三氯醋酸(TCA),培養箱中常規孵育60 min,加入1 mL 10%TCA 終止反應,4 ℃離心15 min,取上清液采用超微量ATP酶測試盒檢測大鼠心肌細胞中ATP Na+-K+-ATP酶和Ca2+-ATP酶的水平變化,各組取10個樣本。
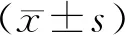
2 結果
2.1 各組大鼠心肌組織病理變化情況 假手術組心肌纖維排列規律,肌絲清晰,無炎性改變,細胞形態正常,核膜完整,染色質分布均勻。模型組和氯喹組梗死邊緣區結構不規則,肌纖維斷裂、核碎裂,心肌細胞數量顯著減少,肌細胞增粗,可見不同程度炎癥細胞浸潤。益氣活血藥組及益氣活血藥+氯喹組心肌排列較假手術組紊亂,可見炎癥細胞帶,但較模型組或氯喹組肌纖維略整齊,肌細胞略腫脹,胞漿內嗜酸性改變較明顯。見圖1。

圖1 各組大鼠心肌組織病理變化情況(HE,×400)
2.2 各組大鼠心功能指標LVEDd、LVESd、LVFS、LVEF水平比較 與假手術組大鼠比較,模型組大鼠心功能指標LVEDd、LVESd均升高(P<0.05),LVFS、LVEF均降低(P<0.05)。與模型組比較,益氣活血藥組及益氣活血藥+氯喹組大鼠心功能指標LVEDd、LVESd均降低(P<0.05),LVFS、LVEF均升高(P<0.05),氯喹組LVEDd、LVESd、LVFS、LVEF與模型組比較差異均無統計學意義(P>0.05)。與益氣活血藥組比較,氯喹組及益氣活血藥+氯喹組大鼠心功能指標LVEDd、LVESd均升高(P<0.05),LVFS、LVEF均降低(P<0.05)。見表1。

表1 各組大鼠心功能指標LVEDd、LVESd、LVFS、LVEF比較
2.3 各組大鼠心肌組織氧化應激相關指標ROS、CAT、T-AOC水平比較 與假手術組比較,模型組大鼠心肌組織ROS水平升高(P<0.05),CAT、T-AOC水平均降低(P<0.05)。與模型組比較,益氣活血藥組及益氣活血藥+氯喹組大鼠心肌組織ROS水平均降低(P<0.05),CAT、T-AOC水平均升高(P<0.05),氯喹組ROS、CAT、T-AOC水平與模型組比較差異均無統計學意義(P>0.05)。與益氣活血藥組比較,氯喹組及益氣活血藥+氯喹組大鼠心肌組織ROS水平均升高(P<0.05),CAT、T-AOC水平均降低(P<0.05)。見表2。

表2 各組大鼠心肌組織氧化應激相關指標ROS、CAT、T-AOC水平比較
2.4 各組大鼠心肌細胞線粒體超微結構變化情況 假手術組線粒體形態結構正常,呈橢圓形,雙層膜清晰。模型組和氯喹組線粒體大小不一,內室腫脹,內嵴水腫、紊亂,甚至斷裂消失。益氣活血藥組及益氣活血藥+氯喹組線粒體基質呈氣球樣改變,出現自噬泡,線粒體可見受損線粒體被自噬體吞噬,并與溶酶體融合。見圖2。

圖2 各組大鼠心肌細胞線粒體超微結構變化情況[比例尺(scale bar)∶1 μm]
2.5 各組大鼠心肌細胞能量代謝指標ATP、Na+-K+-ATP酶、Ca2+-ATP酶水平比較 與假手術組比較,模型組大鼠心肌細胞ATP、Na+-K+-ATP酶、Ca2+-ATP酶水平均降低(P<0.05)。與模型組比較,益氣活血藥組及益氣活血藥+氯喹組大鼠心肌細胞ATP、Na+-K+-ATP酶、Ca2+-ATP酶水平均升高(P<0.05),氯喹組ATP、Na+-K+-ATP酶、Ca2+-ATP酶水平與模型組比較差異均無統計學意義(P>0.05)。與益氣活血藥組比較,氯喹組及益氣活血藥+氯喹組大鼠心肌細胞ATP、Na+-K+-ATP酶、Ca2+-ATP酶水平均降低(P<0.05)。見表3。

表3 各組大鼠心肌細胞能量代謝指標ATP、Na+-K+-ATP酶、Ca2+-ATP酶水平比較
3 討論
臨床上針對心肌梗死最為重要且常見的治療方法是以實現血管再通為目的,由此恢復心肌細胞的血液供應。近年來,隨著動脈搭橋技術、溶栓療法、經皮腔內冠狀血管成形術、心臟外科體循環等醫療技術的不斷發展及推廣,心肌梗死患者在發病后已經可充分實現血液的再灌注[8]。但部分患者缺血之后的再灌注不能促使心肌功能恢復至正常范圍,甚至可導致心肌細胞損傷的加重,這種現象被稱為心肌缺血再灌注損傷[9]。目前對于心肌缺血再灌注損傷的發病機制尚未明確,一般認為與氧化應激反應、能量代謝障礙、細胞內鈣超載等因素有關,是誘發并導致缺血再灌注損傷的重要病理機制[10]。ROS是機體有氧代謝過程中的一種產物,高水平的ROS會對細胞和基因結構造成損壞,而CAT是天然的抗氧化酶,對機體的氧化/抗氧化平衡起著至關重要的作用,T-AOC可反映機體內總體的抗氧化水平,其含量可決定機體的抗氧化能力[11]。研究表明,心肌細胞能量代謝障礙貫穿從心肌代償性肥大到心力衰竭的全過程,心肌缺血再灌注損傷的始動環節也可能與能量代謝障礙有關。ATP作為心肌細胞直接供能物質,ATP含量的減少與心肌細胞凋亡密切相關,而線粒體作為釋放能量的場所,心肌細胞中90%的ATP來源于線粒體,提高線粒體ATP及能量代謝ATP酶含量可有效減輕心肌細胞的損傷[12]。本實驗結果顯示,與假手術組比較,模型組大鼠造模后心功能指標LVEDd、LVESd均升高(P<0.05),LVFS、LVEF均降低(P<0.05),心肌組織ROS水平升高(P<0.05),CAT、T-AOC水平均降低(P<0.05),心肌細胞ATP、Na+-K+-ATP酶、Ca2+-ATP酶水平均降低(P<0.05)。提示模型組大鼠造模后心肌組織生理形態和線粒體結構均出現不同程度損害,心功能出現嚴重障礙,心肌抗氧化能力下降,并伴有心肌細胞能量代謝障礙的出現。
心肌梗死屬中醫學胸痹范疇,屬本虛標實之證,以心氣虛為本,氣滯血瘀為標。中醫學認為,心主血脈,統攝全身血液運行,負責機體組織、器官的營養供給。《素問·五臟生成》言:“諸血者,皆屬于心。”氣為血之帥,氣行則血行,氣滯則血瘀,心氣充足,氣血相輔相成,則可維持機體正常生理活動,若心氣不足,推動無力,氣血運行滯澀,痹阻心脈,不通則痛,發為胸痹。雖然西醫采取相關治療措施可以短時間內實現心肌缺血再灌注,但由于本虛尚在,欲速不達,故而會出現再灌注損傷。益氣活血藥方是在經典方劑當歸補血湯基礎上化裁而來,方中黃芪、人參健脾益氣,生津養血;當歸、川芎、三七補血活血,行氣化瘀。前期研究已經表明,益氣活血藥對心臟有保護作用,具有減輕炎性反應損傷、促進心肌重構、調節細胞骨架結構穩定性、改善冠狀動脈微循環障礙等多方面作用[13-16]。現代藥理學研究表明,黃芪含有黃芪多糖、黃酮類、皂苷類、氨基酸等多種有效成分,可促進一氧化氮(NO)的生成,降低內皮素水平,清除氧自由基,對血管內皮產生較強的保護作用,還能調節血脂,改善血流動力學指標,抑制血栓形成等[17];人參具有抗血小板活化及抗氧化應激的作用,還可保護內皮細胞,避免不良心血管事件的發生[18];丹酚酸B作為丹參的一種有效成分,對內皮細胞氧化損傷具有保護作用[19];三七具有較強的抗血栓、抗炎、抗氧化及調節血管內皮細胞功能等作用[20];當歸、川芎能夠明顯改善血瘀模型大鼠的血液流變學指標及凝血功能異常[21]。本研究結果顯示,與模型組比較,益氣活血藥組及益氣活血藥+氯喹組大鼠心功能指標LVEDd、LVESd均降低(P<0.05),LVFS、LVEF均升高(P<0.05),心肌組織ROS水平均降低(P<0.05),CAT、T-AOC水平均升高(P<0.05),心肌細胞ATP、Na+-K+-ATP酶、Ca2+-ATP酶水平均升高(P<0.05),且益氣活血藥組各指標的改善均優于益氣活血藥+氯喹組(P<0.05),而氯喹組各指標水平與模型組比較差異均無統計學意義(P>0.05)。提示經益氣活血藥方干預治療后可有效促進心肌組織和線粒體結構修復,改善心肌功能,提高心肌抗氧化能力,改善心肌細胞能量代謝,而氯喹作為一種自噬抑制劑對心肌細胞損傷的修復、抗氧化能力的提升及能量代謝障礙的改善并沒有明顯治療作用。
綜上所述,益氣活血藥方對心肌缺血再灌注損傷具有保護作用,可明顯促進心功能恢復,其作用機制可能與提高心肌抗氧化能力,改善線粒體功能和能量代謝有關。將來可進一步開展大樣本、多指標、長時間的臨床研究,以更好的對益氣活血藥方的臨床治療優勢進行分析和探討。

