基于16S rDNA測序探究電針干預(yù)對自發(fā)性高血壓大鼠腸道菌群的影響*
徐夢月,白 娟,王 強(qiáng)
(1.陜西中醫(yī)藥大學(xué)第二臨床醫(yī)學(xué)院,陜西 咸陽 712000;2.西安交通大學(xué)第一附屬醫(yī)院,陜西 西安 710061)
高血壓是全球最常見的慢性心血管疾病,嚴(yán)重危害人類健康。充分的證據(jù)表明,針灸降壓療效確切、真實(shí)、可靠,且能在降壓的同時減少藥物所帶來的毒副反應(yīng),是一種值得在臨床上推廣應(yīng)用的治療方法[1-4]。但針灸降壓的具體機(jī)制至今尚未明確,一定程度上限制了該項(xiàng)療法的推廣應(yīng)用,因此明確針灸降壓的機(jī)制顯得尤為重要。中醫(yī)學(xué)認(rèn)為,針灸以人體經(jīng)絡(luò)理論為基礎(chǔ),通過對人體臟腑氣血陰陽之失衡進(jìn)行良性調(diào)節(jié),從而促使人體恢復(fù)陰平陽秘的正常生理狀態(tài)。針灸治療效應(yīng)是機(jī)體多靶點(diǎn)共同作用的結(jié)果。研究發(fā)現(xiàn),針灸可以通過調(diào)節(jié)腸道菌群的結(jié)構(gòu)和組成,增加有益菌豐度而降低致病菌豐度,從而改善肥胖、糖尿病及結(jié)腸炎等疾病[5-7]。腸道菌群是定植在人類胃腸道內(nèi)數(shù)以萬計(jì)的微生物的總稱,其組成變化在誘導(dǎo)和促進(jìn)高血壓的發(fā)生發(fā)展中發(fā)揮重要作用[8]。研究顯示,腸道菌群可通過調(diào)節(jié)迷走神經(jīng)、分泌神經(jīng)遞質(zhì)、免疫調(diào)節(jié)、產(chǎn)生微生物代謝物及影響腸神經(jīng)系統(tǒng)參與血壓的調(diào)控[9-10]。因此,本研究擬采用16S rDNA測序分析自發(fā)性高血壓大鼠(spontaneously hypertension rats,SHR)與Wistar京都種(Wistar-Kyoto,WKY)大鼠大腸內(nèi)容物菌群變化,探索電針干預(yù)對SHR腸道菌群的影響,進(jìn)一步豐富電針降壓的機(jī)制。
1 材料與方法
1.1 實(shí)驗(yàn)動物 12周齡SPF級雄性SHR大鼠20只,同周齡SPF級雄性WKY大鼠10只,兩種大鼠體質(zhì)量均為240~260 g,均購自北京維通利華實(shí)驗(yàn)動物技術(shù)有限公司,動物生產(chǎn)許可證編號:SCXK(京)2021-0006。大鼠飼養(yǎng)在西安交通大學(xué)基礎(chǔ)醫(yī)學(xué)院動物房,飼養(yǎng)環(huán)境:室溫(22±2)℃,濕度55%~65%,12 h光照/12 h黑暗交替,所有大鼠均可自由攝食和飲水。實(shí)驗(yàn)結(jié)束后,動物均在麻醉狀態(tài)下(10%水合氯醛腹腔注射)進(jìn)行處死,以盡可能減少痛苦。所有動物實(shí)驗(yàn)方案和程序均經(jīng)西安交通大學(xué)醫(yī)學(xué)部生物醫(yī)學(xué)倫理委員會批準(zhǔn)(批準(zhǔn)號:2020-286)。
1.3 主要儀器 BP-100A型全自動大小鼠無創(chuàng)血壓測量系統(tǒng)(成都泰盟科技有限公司);SDZ-Ⅱ型華佗牌電子針療儀(蘇州醫(yī)療用品廠有限公司);環(huán)球無菌針灸針(蘇州針灸用品有限公司,規(guī)格:0.25 mm×13 mm);Bio-rad T100型梯度PCR儀(美國BIO-RAD公司);Qubit@ 2.0Fluorometer(美國Thermo Scientific公司)。
1.4 分組與干預(yù) 將20只雄性SHR隨機(jī)分成模型組和電針組,每組10只;10只雄性WKY大鼠作為對照組。3組大鼠適應(yīng)性喂養(yǎng)1周后開始電針干預(yù)。電針組大鼠周一至周五09:00:00—12:00:00用自制鼠袋捆綁固定上半身后,取仰臥位,選取雙側(cè)足三里(位于后膝關(guān)節(jié)外下方,腓骨小頭下5~7 mm)進(jìn)行干預(yù),穴位定位和具體針刺方法參照《實(shí)驗(yàn)針灸學(xué)》,連接電針治療儀的輸出端,給予電針刺激(疏密波,3 Hz/15 Hz,強(qiáng)度為1 mA,每次30 min,1次/d,連續(xù)5 d,休息2 d),共持續(xù)6周。對照組、模型組大鼠采用和電針組相同的固定方法,但不進(jìn)行干預(yù)。
1.5 觀察指標(biāo)
1.5.1 大鼠血壓測量 于電針的前1天(T1)及電針第2、4、6周的周六(T2、T3、T4)09:00:00—12:00:00,在大鼠清醒狀態(tài)下應(yīng)用無創(chuàng)血壓測量儀測量尾動脈收縮壓,所有大鼠連續(xù)測3次,取平均值。
1.5.2 大鼠腸道菌群變化檢測 于電針結(jié)束前1天,收集大鼠糞便至無菌EP管中,置于-80 ℃冰箱保存?zhèn)溆谩C拷M隨機(jī)抽取7只大鼠的糞菌送至武漢邁特維爾生物科技有限公司,由該公司對其進(jìn)行基因組DNA的提取和PCR擴(kuò)增、PCR產(chǎn)物的混樣和純化、文庫構(gòu)建和上機(jī)測序及生物信息分析檢測。
1.6 統(tǒng)計(jì)學(xué)方法
1.6.1 生物信息分析 使用Illumina NovaSeq測序得到下機(jī)數(shù)據(jù)(Raw PE),再進(jìn)行拼接、質(zhì)控及嵌合體過濾,得到后續(xù)可用于分析的有效數(shù)據(jù)(Effective Tags)。以97%的一致性(Identity),對每個樣本的Effective Tags進(jìn)行OTUs(Operational Taxonomic Units)聚類,之后對OTUs序列進(jìn)行物種注釋。選擇QIIME 1.9.1軟件和R軟件分析和處理測序結(jié)果,通過Alpha多樣性指數(shù)(Chao1、Shannon和Simpson)分析與基于加權(quán)Unifrac距離(weighted Unifrac)的主坐標(biāo)分析(Principal Co-ordinates Analysis,PCoA),確定各組大鼠腸道菌群的特征。
1.6.2 實(shí)驗(yàn)數(shù)據(jù)分析 采用SPSS 26.0進(jìn)行統(tǒng)計(jì)分析,計(jì)量資料服從正態(tài)分布以(x±s)表示,組間差異比較采用單因素方差分析,方差齊時兩兩比較用LSD法,方差不齊時用Tamhane's T2法;血壓數(shù)據(jù)比較采用重復(fù)測量資料方差分析,符合球形檢驗(yàn)時用主體內(nèi)效應(yīng)檢驗(yàn)(假設(shè)球形度),不符合球形檢驗(yàn)時用多變量檢驗(yàn)(比萊軌跡)。不符合正態(tài)分布的數(shù)據(jù)采用Kruskal-Wallis H檢驗(yàn)。P<0.05為差異有統(tǒng)計(jì)學(xué)意義。
2 結(jié)果
2.1 各組大鼠收縮壓比較 所有大鼠不同時間點(diǎn)收縮壓比較,差異有統(tǒng)計(jì)學(xué)意義(F=56.115,P=0.000),即存在時間效應(yīng)。對照組大鼠收縮壓隨時間推進(jìn)變化不明顯(F=0.811,P=0.499),模型組大鼠收縮壓隨時間推進(jìn)呈現(xiàn)明顯升高趨勢(F=545.691,P=0.000),電針組大鼠收縮壓隨時間推進(jìn)呈現(xiàn)明顯下降趨勢(F=43.200,P=0.000)。3組大鼠收縮壓總體比較,差異有統(tǒng)計(jì)學(xué)意義(F=2 358.157,P=0.000),即存在分組效應(yīng)。干預(yù)前1天電針組大鼠收縮壓與模型組比較,差異無統(tǒng)計(jì)學(xué)意義(P>0.05),其余各時間點(diǎn)電針組大鼠收縮壓均明顯低于模型組(P<0.05),且電針組和模型組大鼠在各時間點(diǎn)的收縮壓均明顯高于對照組(P<0.05)。時間因素與分組因素之間存在交互效應(yīng)(F=27.468,P=0.000),即各組大鼠干預(yù)前后收縮壓變化幅度不一致。上述結(jié)果提示電針干預(yù)可以降低大鼠血壓。(見表1、圖1)
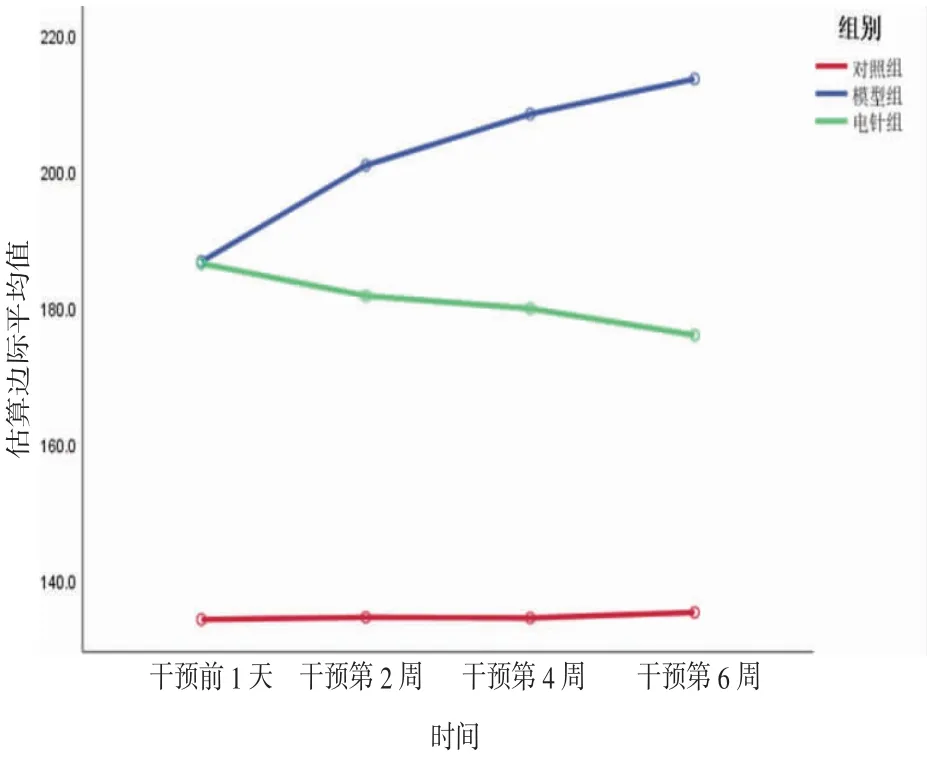
圖1 各組大鼠收縮壓交互效應(yīng)輪廓圖
表1 各組大鼠不同時間點(diǎn)收縮壓比較 (±s,mm Hg)
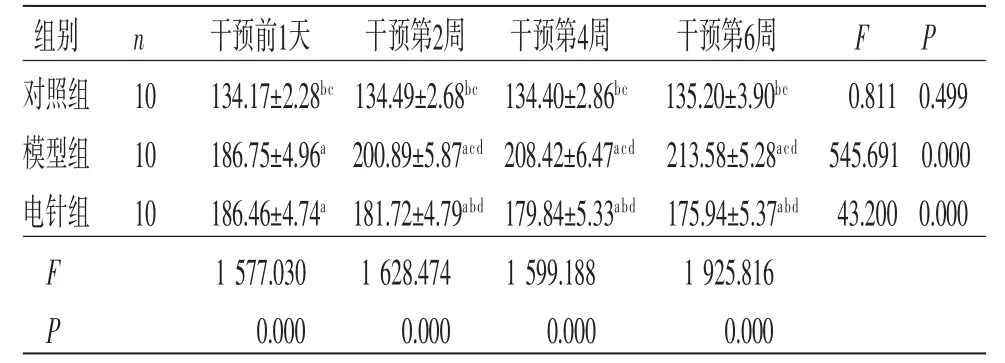
表1 各組大鼠不同時間點(diǎn)收縮壓比較 (±s,mm Hg)
注:與對照組比較,aP<0.05;與模型組比較,bP<0.05;與電針組比較,cP<0.05;與干預(yù)前1天比較,dP<0.05。
?
2.2 物種注釋及測序質(zhì)量分析 由3組樣本聚類得到的OTUs韋恩圖(見圖2)可知,3組共有1 733個相同OTUs,對照組有225個特征OTUs,模型組有511個特征OTUs,電針組出現(xiàn)378個特征OTUs并有491個OTUs發(fā)生了改變。3組樣本的稀釋曲線均趨向平坦,說明實(shí)驗(yàn)測序深度足夠,當(dāng)序列接近50 000時再增加序列只會產(chǎn)生少量新的物種。(見圖3)當(dāng)箱形圖位置隨著樣本量的增加而趨于平緩時,表示此實(shí)驗(yàn)中的物種不會再隨樣本量的增加而明顯增多,提示樣本量充分。(見圖4)
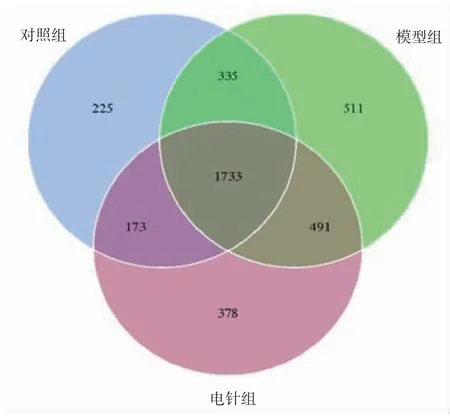
圖2 OTUs 韋恩圖
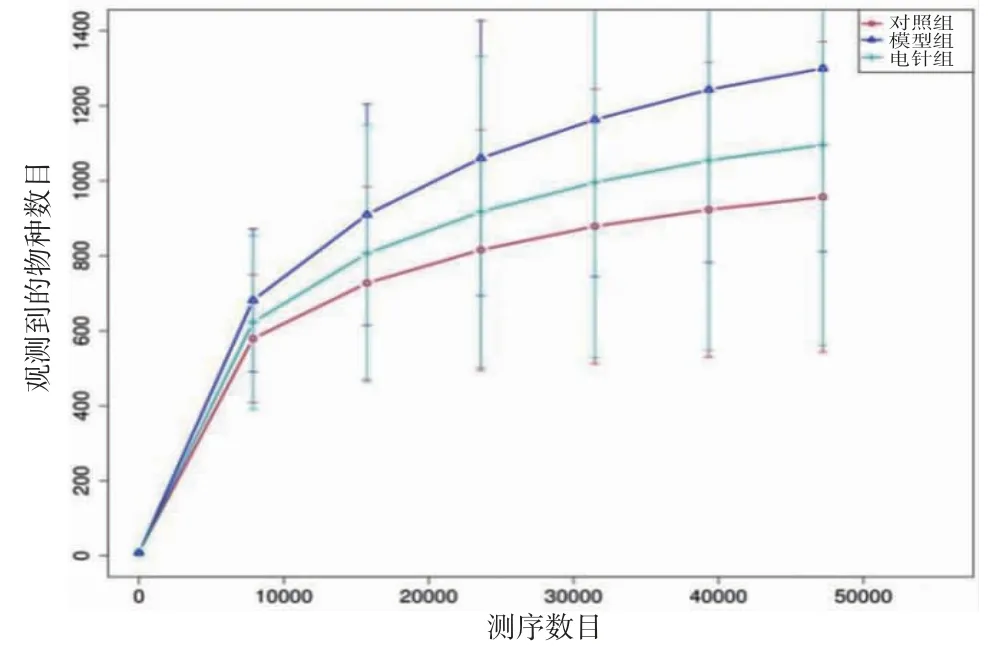
圖3 稀釋曲線圖

圖4 物種累積箱圖
2.3 腸道菌群多樣性分析 本實(shí)驗(yàn)采用Alpha多樣性中的ACE、Shannon和Simpson指數(shù)來分析菌群的豐富度和多樣性。其中,ACE指數(shù)用于估計(jì)群落中OTU數(shù)目,該指數(shù)越大,菌群豐富度越高。Shannon和Simpson指數(shù)用于衡量群落的多樣性和均勻度,群落多樣性越高,物種分布越均勻,Shannon指數(shù)越大,Simpson指數(shù)也越大。由表2知,模型組大鼠菌群ACE指數(shù)高于對照組和電針組,但差異無統(tǒng)計(jì)學(xué)意義(P>0.05)。對照組和電針組大鼠菌群Shannon指數(shù)與模型組比較,差異無統(tǒng)計(jì)學(xué)意義(P>0.05)。對照組和電針組大鼠菌群Simpson指數(shù)高于模型組(P<0.05)。采用基于weighted Unifrac距離的PCoA法,進(jìn)一步比較3組樣本腸道菌群物種構(gòu)成差異程度,結(jié)果發(fā)現(xiàn)對照組與模型組距離較遠(yuǎn),提示與對照組比較,模型組大鼠菌群組成結(jié)構(gòu)發(fā)生了顯著改變(Amova,P=0.002);電針組與模型組距離較遠(yuǎn),但與對照組距離較近,提示與模型組比較,電針干預(yù)后的菌群物種構(gòu)成發(fā)生了明顯變化(Amova,P=0.003)。(見圖5、表3)

圖5 基于weighted unifrac 距離PCoA 分析
表2 3 組大鼠菌群Alpha 多樣性指數(shù)比較 (±s)

表2 3 組大鼠菌群Alpha 多樣性指數(shù)比較 (±s)
注:與對照組比較,aP<0.05;與模型組比較,bP<0.05。
?

表3 Amova 組間差異分析
2.4 腸道菌群結(jié)構(gòu)組成分析 統(tǒng)計(jì)3組大鼠在門水平和屬水平豐度排名前10的物種并繪制成豐度柱狀圖。(見圖6~7)在門水平上,3組大鼠優(yōu)勢菌門均為厚壁菌門(Firmicutes)和擬桿菌門(Bacteroidetes)。其中,與對照組比較,模型組大鼠厚壁菌門相對豐度升高,擬桿菌門相對豐度降低,F(xiàn)/B值明顯升高(P<0.05);與模型組比較,電針組大鼠厚壁菌門相對豐度降低,擬桿菌門相對豐度升高,F(xiàn)/B值顯著降低(P<0.05)。(見表4)在屬水平上,與對照組比較,模型組大鼠Lactobacillus、Treponema、Clostridium_sensu_stricto_1、Blautia、Turicibacter相對豐度明顯升高(P<0.05),Ruminococcus、Prevotellaceae_Ga6A1_group、Anaerostipes相對豐度明顯降低(P<0.05);與模型組比較,電針組大鼠以上菌屬均得到改善,Lactobacillus、Treponema、Clostridium_sensu_stricto_1、Blautia、Turicibacter相對豐度均明顯降低(P<0.05),Ruminococcus和Anaerostipes相對豐度均明顯升高(P<0.05)。(見表5)

圖6 3 組大鼠前10 門水平菌群豐度構(gòu)成圖

圖7 3 組大鼠前10 屬水平菌群豐度構(gòu)成圖
表4 3 組大鼠F/B 值比較 (±s)

表4 3 組大鼠F/B 值比較 (±s)
注:與對照組比較,aP<0.05;與模型組比較,bP<0.05。
?
表5 3 組大鼠前10 屬水平組間差異物種比較 (±s)
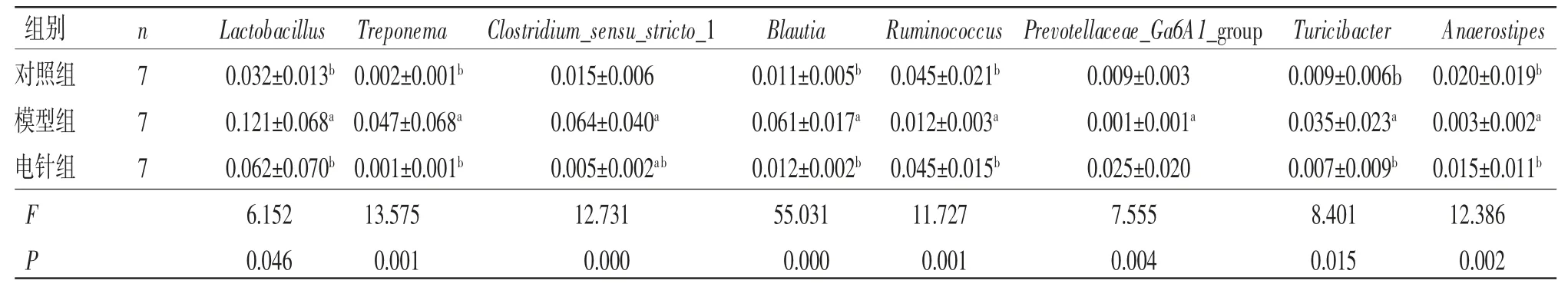
表5 3 組大鼠前10 屬水平組間差異物種比較 (±s)
注:與對照組比較,aP<0.05;與模型組比較,bP<0.05。
?
3 討論
中醫(yī)學(xué)多將高血壓歸屬于“頭痛”“眩暈”等范疇,主要由脾虛痰濕、肝氣不舒、氣血瘀滯引起。足三里穴屬足陽明胃經(jīng)穴,具有健脾和胃、補(bǔ)中益氣、通腑化痰之功效。足陽明胃經(jīng)為多氣多血之經(jīng),因此針刺足三里能夠刺激整條經(jīng)脈,可通經(jīng)活絡(luò),調(diào)和氣血,調(diào)理經(jīng)脈,最終達(dá)到平衡血壓的目的。另外,足陽明胃經(jīng)于頭面部分布密集,且經(jīng)脈循行不僅屬胃,散脾,還上通于心,而心又主血脈,故針刺足三里穴能調(diào)節(jié)機(jī)體血液運(yùn)行,繼而改善由血壓升高引起的頭痛、眩暈等高血壓癥狀[11]。本研究結(jié)果表明,電針雙側(cè)足三里能夠有效降低SHR的血壓,這和王珊珊[12]的研究結(jié)果類似。以往研究顯示,針刺降壓是多靶點(diǎn)的效應(yīng),但具體機(jī)制不明。近年來,腸道菌群在調(diào)節(jié)血壓方面發(fā)揮重要作用,并鑒于足三里穴具有調(diào)節(jié)腸道的作用,因此我們研究了電針雙側(cè)足三里對腸道菌群的影響,以此探索與電針降壓可能相關(guān)的菌群機(jī)制。
腸道菌群被認(rèn)為是維持血壓穩(wěn)態(tài)的關(guān)鍵因素[13-14]。且越來越多的證據(jù)表明,腸道微生物在高血壓患者和高血壓動物模型中發(fā)揮了重要作用[15-17]。有研究[15-16]顯示,與健康對照組比較,高血壓患者及高血壓動物模型的腸道微生物豐度和多樣性均明顯降低。F/B值為評估腸道生理穩(wěn)態(tài)的生物標(biāo)志物。在自發(fā)性高血壓大鼠和血管緊張素Ⅱ誘導(dǎo)的高血壓模型中,F(xiàn)/B值呈現(xiàn)顯著的升高趨勢,而F/B值增加被廣泛認(rèn)為是腸道穩(wěn)態(tài)失調(diào)的特征[16,18]。此外,糞菌移植實(shí)驗(yàn)發(fā)現(xiàn),將WKY的糞便移植給SHR后,SHR的腸道菌群顯著改善,血壓下降;而將SHR的糞便移植給WKY后,WKY的收縮壓和F/B值明顯增加。這進(jìn)一步證實(shí)了腸道菌群失調(diào)是造成高血壓的重要原因[19]。本研究顯示,與對照組比較,模型組大鼠菌群多樣性降低,F(xiàn)/B值顯著升高,而通過電針干預(yù)后菌群多樣性有所增加,F(xiàn)/B值明顯降低,并與對照組水平趨于一致,結(jié)合PCoA分析中3組大鼠的物種構(gòu)成差異,表明電針在一定程度上能夠調(diào)節(jié)腸道菌群的結(jié)構(gòu)和組成,改善高血壓大鼠的腸道菌群紊亂。
進(jìn)一步分析顯示,模型組大鼠腸道微生物中乳酸產(chǎn)生菌(Lactobacillus、Turicibacter)豐度增加,這與以往報(bào)道結(jié)果一致[16,20]。在高血壓動物模型中,乳酸產(chǎn)生菌顯著增加,且血漿乳酸水平與血壓升高有關(guān)[21-22],經(jīng)電針干預(yù)后,乳酸產(chǎn)生菌明顯降低。此外,本研究顯示模型組大鼠Ruminococcus、Anaerostipes及Prevotellaceae_Ga6A1_group的豐度顯著降低,經(jīng)電針干預(yù)后豐度增加。研究表明,Ruminococcus可通過產(chǎn)生羥基類固醇脫氫酶,促進(jìn)次級膽汁酸石膽酸(Lithocholic acid,LCA)和脫氧膽酸(Deoxycholic acid,DCA)的生成[23],而血漿LCA和DCA水平的增加有助于降低血壓[24-25]。Ruminococcus還能夠產(chǎn)生具有抗炎作用的丁酸鹽,為腸道上皮細(xì)胞提供能量,并通過各種機(jī)制維持腸道健康[26-27]。Anaerostipes亦可產(chǎn)生丁酸鹽,并能通過保護(hù)腸道屏障功能及發(fā)揮免疫調(diào)節(jié)和抗炎作用來維持腸道內(nèi)環(huán)境穩(wěn)態(tài),從而改善高血壓[28]。Prevotellaceae_Ga6A1_group能夠產(chǎn)生乙酸鹽。后者可抑制心肌肥大,改善心功能,減少心臟和腎臟纖維化,繼而緩解高血壓[29-30]。
綜上所述,本研究通過對SHR雙側(cè)足三里進(jìn)行電針干預(yù),發(fā)現(xiàn)電針可能是通過改變腸道菌群的結(jié)構(gòu)及組成,重塑腸道的動態(tài)平衡,增加Ruminococcus、Anaerostipes、Prevotellaceae_Ga6A1_group等降壓相關(guān)的短鏈脂肪酸產(chǎn)生菌的豐度,降低Lactobacillus、Turicibacter等乳酸產(chǎn)生菌的豐度,發(fā)揮降壓作用。后期還需對篩選出的可能與降壓相關(guān)的Ruminococcus、Anaerostipes、Prevotellaceae_Ga6A1_group靶菌進(jìn)行研究,并開展相關(guān)糞菌移植實(shí)驗(yàn),進(jìn)一步驗(yàn)證電針改善后的腸道菌群和高血壓之間的因果關(guān)系,為電針降低血壓的腸道菌群機(jī)制提供依據(jù)。

