Notch信號通路介導運動對抑郁的調控機制
——基于整合生物學視角
劉文彬 ,漆正堂 ,劉微娜 *
Notch基因由Morgan(1917)發現,因其功能異常可導致果蠅翅膀的邊緣出現鋸齒狀缺口(notches)而得名(Mohr, 1919)。Notch信號通路主要由Notch受體、Notch配體、細胞內效應分子以及下游靶點等組成(表1)。不同于目前已知的大多數經典信號通路,Notch通路的受體與配體相互作用均通過短時通訊介導,沒有信號級聯放大的過程(喬麗麗,2020)。Notch信號將一個細胞的命運與相鄰細胞的命運聯系在一起,在進化上高度保守,對細胞的增殖、分化和調亡等發揮重要作用(Schwanbeck et al.,2011)。Notch通路異常與多種人類疾病有關,包括發育綜合征和一些復雜疾病,如缺血性損傷(Jin et al., 2019)、癌癥(Aster et al., 2017)、雙相情感障礙(Dmitrzak-Weglarz et al., 2021)、自閉癥(盛飛,2021)和抑郁癥(Wang et al., 2022)等。
Notch信號通路作為細胞命運的重要調控者,對腦區結構和功能的可塑性至關重要,其可能參與了應激條件下的神經可塑性受損與異常行為,如抑郁行為等。而運動作為一種非藥物治療手段,對改善抑郁的有效性已得到廣泛證實,但其潛在機制尚不明確。在運動與腦健康的研究中,整合生物學是關鍵的理論之一。運動整合生物學認為,為應對運動挑戰,多層次的整合和應答為機體建立新的動態平衡,從而提高肌肉能量和氧氣供應,這種對系統穩態的擾亂及重塑不僅惠及骨骼肌本身,還給人體多個器官和系統帶來了積極效應(Hawley et al., 2014)。Tsivitse等(2009)的研究發現,運動可能會調節多個器官組織中的Notch信號,且Notch的受體、配體、效應分子、下游靶點均與抑郁發病或運動調控過程有關。這使得Notch信號通路發揮健康效應,將介導運動對抑郁的調控機制成為可能。運動整合生物學的研究思路可以更直接地解釋運動促進大腦健康的潛在機制(Moon et al., 2014)。基于此,本研究從整合生物學視角對Notch信號通路在運動調控抑郁中可能存在的神經生物學機制進行綜述分析。
1 Notch受體在抑郁和運動干預中的作用機制
Notch受體是1個相對分子量約為300 kDa的I型跨膜蛋白,由胞外區(Notch extracellular domain,NECD)、跨膜區(transmembrane domain,TM)以及胞內區(Notch intracellular domain,NICD)3個結構域組成,具有高度保守性(Fiúza et al., 2007)。目前,哺乳動物中已發現4種同源Notch受體,分別為Notch1、Notch2、Notch3和Notch4,各亞型在生理功能上差別較小,且均在細胞分化、胚胎發育、組織自我更新等多個過程中發揮重要的調控作用(Zanotti et al., 2016)。
臨床研究發現,重度抑郁癥(major depressive disorder,MDD)患者外周血中的Notch1基因表達水平降低(Sun et al., 2016)。部分動物研究發現,慢性不可預見性輕度應激(chronic unpredictable mild stress,CUMS)小鼠(Guo et al., 2009)和卒中后抑郁(post-stroke depression,PSD)大鼠海馬中Notch1的表達水平下調(Shang et al., 2017)。Notch1信號通路也參與了中年雌性大鼠慢性束縛應激(chronic restraint stress,CRS)后的行為變化(Shen et al.,2020)。這些改變可能源自Notch1介導的神經可塑性(李元 等,2011),也可能與Notch1信號在神經元活動的響應中被Arc/Arg3.1(即刻早期基因家族中的一員)動態調節有關(Alberi et al., 2011)。Liao等(2021)的研究發現,慢性社會挫敗應激(chronic social defeat stress, CSDS)小鼠和Wistar Kyoto(WKY)大鼠內側前額葉皮層中Notch2/NFKB信號通路的增加可能會介導抑郁的易感性,相關機制可能與Notch2在海馬區參與了神經發生與凋亡的調節過程(Gruden’ et al., 2017)或發揮了對神經干細胞(neural stem cells, NSCs)靜息狀態的維持作用有關(Zhang et al.,2019)。另有研究證實,Notch3(Eikermann-Haerter et al.,2011)和Notch4(Skol et al., 2003)與抑郁易感性相關。
運動可通過Notch受體調控神經元活動和抗氧化過程,這也可能是運動調控抑郁的關鍵介導機制。Zhang等(2018)的研究發現,Notch1信號通路參與介導了自主跑輪運動增強突觸可塑性和學習記憶等生理過程。在Notch1基因敲除小鼠中,YFP+Type-1 NSCs和瞬時擴增祖細胞的顯著減少會導致YFP+顆粒神經元的產生減少,而30天的跑步運動可以消除這種缺陷(Ables et al., 2010)。成年海馬神經發生是神經干/祖細胞產生新神經元的過程,抑郁癥發病機制涉及成年海馬神經發生障礙。微環境變化(如環境豐富和跑輪運動)會對成年海馬的神經發生產生一定刺激,這可能與Notch3有關(Klein et al., 2017)。部分研究結果表明,Notch2通過下調Notch3的表達調控成肌細胞的分化(Ono et al., 2007),且Notch2的功能異常會引起免疫細胞的轉化(Sakata-Yanagimoto et al., 2012),這都與運動可能引起的氧化應激有關。氧化應激是抑郁發病的重要誘因,而運動可提高機體的抗氧化能力,且Notch1在一定程度上通過PTEN/Akt信號通路介導抗氧化過程(Pei et al., 2013)。Scott等(2015)研究發現,急性運動與高海拔都可能使機體處于缺氧狀態,與血管生成相關的基因Notch4在高原人群中表達較高;Lancaster等(2020)對受試者的抗氧化和神經發育基因常見功能進行多態性基因分型后也發現,Notch4多態性在受試者中顯著升高。提示,運動后升高的Notch受體表達極有可能介導了運動的抗抑郁過程。
2 Notch配體在抑郁和運動干預中的作用機制
與受體相似,Notch配體也是細胞表面的I型跨膜蛋白,具有含N端的DSL結構域,其在進化中高度保守,為激活Notch信號所必需(Dongre et al., 2014)。目前,在哺乳動物中已發現2類同源Notch配體,包括Delta樣配體(分別為 Delta-like1、Delta-like3和Delta-like4)和Serrate樣配體(分別為Jagged1和Jagged2)(Kopan et al., 2009)。Notch配體在線蟲中表現為Lag-2,因此Notch配體也被稱為DSL(Delta/Serrate/Lag-2)蛋白。Notch受體與不同的配體發生作用后參與細胞的增殖和分化,影響突觸可塑性與神經元衰老。
在哺乳動物中,活性的E3泛素連接酶Neuralized(Neur)蛋白有2個同源物,即Neur1和Neur2,它們都能與Notch配體Delta-like1(DLL1)、Delta-like4(DLL4)、Jagged1(JAG1)相互作用,在大腦胚胎發育和成年海馬神經發生中發揮重要作用,因此,Notch配體可能通過影響神經發生而介導抑郁發病機制(Rullinkov et al., 2009)。Suchting等(2007)的研究表明,DLL4可作用于血管內皮生長因子(vascular endothelial growth factor,VEGF)下游,對VEGF修復的血管新生發揮負調控作用。JAG1是一種有效的促血管生成調節劑,可以拮抗DLL4介導的Notch信號在血管生成中的作用(Benedito et al., 2009),提示,抑郁發病機制也可能與Notch配體介導的血管新生有關。另外,Notch/DLL4信號通路也被證實參與機體的巨核細胞終末分化的抑制(Poirault-Chassac et al., 2010)。DLL1依賴性Notch信號傳導和細胞因子可協同促進人類I型常規樹突狀細胞的生成,這對免疫系統啟動起到關鍵作用(Balan et al., 2018)。更重要的是,DLL1、DLL4和JAG1在T細胞受體交聯后會增強或抑制早期T細胞的活化和增殖(Rutz et al., 2005),由于抑郁也被視為一種精神免疫失調疾病,因此Notch配體介導的炎癥免疫可能與抑郁的發生及發展有關。
Notch配體在機體的肌肉和骨骼系統中均發揮著重要的促更新和新生等作用,這可能與運動的抗抑郁機制有關。彭穎(2020)的研究表明,DLL1能夠通過調控肌肉干細胞的穩態維持、自我更新和分化來調控肌肉干細胞庫,并且在這一調控過程中,DLL1以細胞自主的方式來調控自身Notch信號和細胞功能。而骨骼系統中的血管新生和成骨耦合表明,內皮細胞和成骨細胞之間存在分子對話機制,且內皮Notch活性可促進成骨及骨中的血管新生,這與Notch信號及其配體DLL4在其他器官和腫瘤的內皮中已經確立的功能相反(Ramasamy et al., 2014)。Norum等(2016)的研究發現,血清DLL1的水平升高與心臟舒張功能障礙和運動能力降低有關。血管平滑肌細胞在運動過程中主要負責心臟的舒張與收縮功能,而JAG1通過與Notch3的相互作用可維持血管平滑肌的穩態(Mao et al., 2021)。此外,薛香莉等(2019)提出,運動可通過調控腸道微生態平衡來發揮抗抑郁效應,而DLL1和DLL4介導的Notch信號通路也是腸道干細胞穩態所必需的(Pellegrinet et al., 2011),因此Notch配體有可能具備通過調控腸道平衡介導抑郁的病理機制。
3 Notch效應分子在抑郁和運動干預中的作用機制
Notch信號的細胞內效應分子為CSL-DNA結合蛋白,Notch無DNA結合域,需要經過CSL等轉錄因子和MAML(mastermind-like)協同轉錄活化因子才能發揮轉錄調節作用。CSL即CBF1(C-promoter bindingprotein-1)、Su(H)(Suppressor of Hairless)、Lag-1的首字母縮寫,分別為該蛋白在哺乳動物、果蠅、線蟲中的不同名稱。Notch受體與配體相互作用,受體的胞外區被金屬蛋白酶(a disintegrin and metalloproteinase,ADAM)和γ-分泌酶(γ-secretase)切割后,釋放出可溶性NICD(Majumder et al., 2021),其隨后易位至細胞核并與細胞核內CSL蛋白結合,形成NICDCSL-MAML三元轉錄復合物,激活靶基因表達。
轉錄調控因子CBF1(即RBP-Jκ)通過介導經典Notch信號途徑來調控神經細胞的定向和分化,并在特定發育環境中調節神經系統的形態,從而協調神經發生和形態形成2個過程(鄭敏化,2009)。神經可塑性是抑郁發病的重要誘因之一,而轉錄因子RBP-J介導的Notch信號為海馬神經發生過程中所必需,經典Notch/RBP-J信號在海馬突觸可塑性中發揮重要作用,且該作用的一部分由γ-氨基丁酸(Gamma-aminobutyric acid,GABA)轉運蛋白調節(Liu et al., 2015)。在神經發生過程中,Notch/RBP-J信號一直被認為主要參與未分化神經前體的維持,且鑒定了Notch/RBP-J的組織特異性轉錄激活因子,也揭示了RBP-J在促進神經元成熟中的新作用(Tanigaki et al., 2010)。Fujimoto等(2009)的研究發現,RBP-J可促進神經元分化,抑制成年神經發生中的少突膠質細胞發育。小膠質細胞是中樞神經系統的免疫效應細胞,而Notch信號通路是小膠質細胞內與炎癥相關的主要通路之一(吳海歌 等,2014)。劉娟(2016)在敲除Notch信號關鍵分子RBP-J之后,發現Notch信號通路可促使巨噬細胞向M2型極化,并發揮抗炎、促腫瘤的作用。Sun等(2016)還注意到 ,外周血中與Notch相關的微小核糖核酸(MicroRNA,miR)的差異表達可能也與MDD有關。通過探究miR-17~92在白介素-12(interleukin-12,IL-12)介導的免疫反應中發揮的作用,Zhang等(2021)確定了其為巨噬細胞中RBP-J的功能靶點。因此,Notch效應分子介導抑郁發病也可能與表觀遺傳機制有關。
目前,雖然鮮見Notch效應分子CSL-DNA結合蛋白在運動與疾病干預方面的研究,且RBP-J在運動調控抑郁機制中的作用未明,但RBP-J在中樞神經、機體代謝和運動系統之間的聯系依然有跡可循。呂竺蔓(2017)在星形膠質細胞中特異性敲除RBP-J,發現能夠促進小鼠腦缺血損傷后的神經再生,而小鼠腦缺血損傷后的第3~5天正是細胞增殖以及運動功能障礙的高峰期。此外,類固醇激素對于海馬神經發生以及應激調節的影響已被廣泛證實,且睪酮和雌激素水平在抑郁和運動對機體作用的過程中扮演著重要角色(Gheorghe et al., 2019)。運動訓練可提高睪酮和雌激素水平,同時延緩破骨細胞活性,促進骨骼生長和骨密度升高(Robinson et al., 1996)。在破骨細胞的分化及成熟過程中,RBP-J作為負性調控因子抑制破骨細胞的分化及成熟,對于破骨細胞功能異常引發的疾病研究具有重要的臨床意義(馬靜,2012)。另外,RBPJ/miR182介導的調控網絡在腫瘤壞死因子-α(tumor necrosis factor-α,TNF-α)誘導的破骨細胞發生和炎性骨吸收中也發揮著重要作用(Inoue et al., 2020)。綜上所述,RBP-J與神經發生、神經內分泌、炎癥反應、破骨細胞發育均有所關聯,后續可開展研究以明晰其與運動調控抑郁的關系及具體作用機制。
4 Notch下游靶點在抑郁和運動干預中的作用機制
在哺乳動物中,經典Notch信號通路靶基因主要有Hes(hairy/enhancer of split)和Hey(hairy/enhancer-of-split related with YRPW motif family members)兩大家族,包括Hes1、Hes5和Hes7以及Hey1、Hey2等基因。非經典Notch信號通路不依賴RBP-J轉錄復合物,而是與PI3K、AKT、mTOR以及轉錄核因子(nuclear factor κB,NF-κB)等發生相互作用,進而調控細胞分化、代謝和凋亡等生命活動(Jiang et al., 2017)。
一方面,興奮性神經元的Hes1失活可導致杏仁核異常的恐懼和焦慮行為,并伴有更高的神經元興奮性,而抑制性神經元的Hes1失活可導致社交性和持續性傾向的增加(Matsuzaki et al., 2019)。Guo等(2009)的研究表明,Notch1下游靶點Hes1和Hes5可能參與了CUMS對缺血大鼠海馬神經發生的調節。Notch/Hes-1信號通路的激活可能參與了前扣帶回興奮性突觸傳遞的增強,這可能導致周圍神經損傷后的持續性疼痛(Duan et al., 2021)。慢性疼痛是導致抑郁的重要誘因之一,患有慢性神經性疼痛的患者合并抑郁癥的風險較高。Liu等(2016)發現白藜蘆醇對二者共病具有較好的療效,其可改善脂多糖誘導的NF-κB在海馬內的激活,通過增強海馬神經新生來抵消脂多糖誘導的抑郁樣行為,同時上調Sirt1和Hes1水平。研究也發現,電針治療通過抑制慢性輕度應激(chronic mild stress,CMS)小鼠海馬NF-κB炎癥通路來緩解抑郁行為(Wang et al., 2022)。中藥丹梔逍遙散(Liu et al.,2021)和西藥阿戈美拉汀(Fathi et al., 2021)對焦慮改善具有積極影響,治療后二者將增加海馬神經干細胞的增殖分化,促進神經元再生,同時伴隨Hes1等靶基因的表達水平改變。此外,非經典Notch配體DLK2(Delta-like 2)的缺失增加了小鼠的焦慮和抑郁行為,并影響了室旁核、海馬區以及杏仁核中Hes1、Hes5和Hey1的基因表達(Navarrete et al., 2017)。上述研究提示,Notch的下游靶點通過神經發生和炎癥免疫影響抑郁行為。
另一方面,力竭運動與鈍挫傷均可以引起大鼠骨骼肌和血清中的Hes1含量升高,這證實了Notch信號通路可能在骨骼肌衛星細胞激活及損傷修復中發揮正向調節作用(李娜,2016)。Khayrullin等(2016)的研究發現,在具有慢性酒精中毒性肌病的動物模型中,Hey1和Notch1的相關性顯著升高,Notch信號的上調會抑制肌生成并維持肌肉衛星細胞的靜止。此外,Notch下游靶點與運動中發生的能量代謝息息相關,這也可能是其發揮抗抑郁作用的重要中介變量。Mendes-da-Silva等(2015)和Curi等(2021)的研究表明,高脂膳食(high-fat diet,HFD)大鼠的后代表現出快感缺失行為,這可能與Notch1及其下游靶點Hes1、Hes5的蛋白表達增加有關;HFD可誘導與肥胖相關的抑郁發生,并顯著上調海馬NF-κB的表達(Huang et al., 2021)。而Scroyen等(2015)發現,Notch信號靶基因Hey1也具有抑制脂肪生成的作用。劉微娜等(2015)提出,能量代謝的重要調節因子瘦素,可能參與了抑郁癥的運動干預機制,且其可能主要通過增加Hes1的mRNA表達以及對神經祖細胞的維持來促進大腦發育(Udagawa et al., 2006)。綜上所述,Notch下游靶點活躍在神經祖細胞和骨骼肌祖細胞的生長發育及分化進程中,使得Hes1、Hes5及NF-κB在運動調控抑郁過程中發揮積極作用。
5 Notch信號通路在抑郁和運動干預中的作用機制
Notch信號通路介導2個細胞相互靠近接觸之后的活化效應(圖1),Notch通路并非通過激酶磷酸化逐步活化傳遞信號,而是由Notch通過蛋白酶切水解,逐步釋放有轉錄調節活性的Notch蛋白片段NICD來實現活化,該轉導方式無法放大信號,其全通路蛋白不存在任何加工修飾,因此信號傳遞非常迅速且精準(Nowell et al., 2017)。
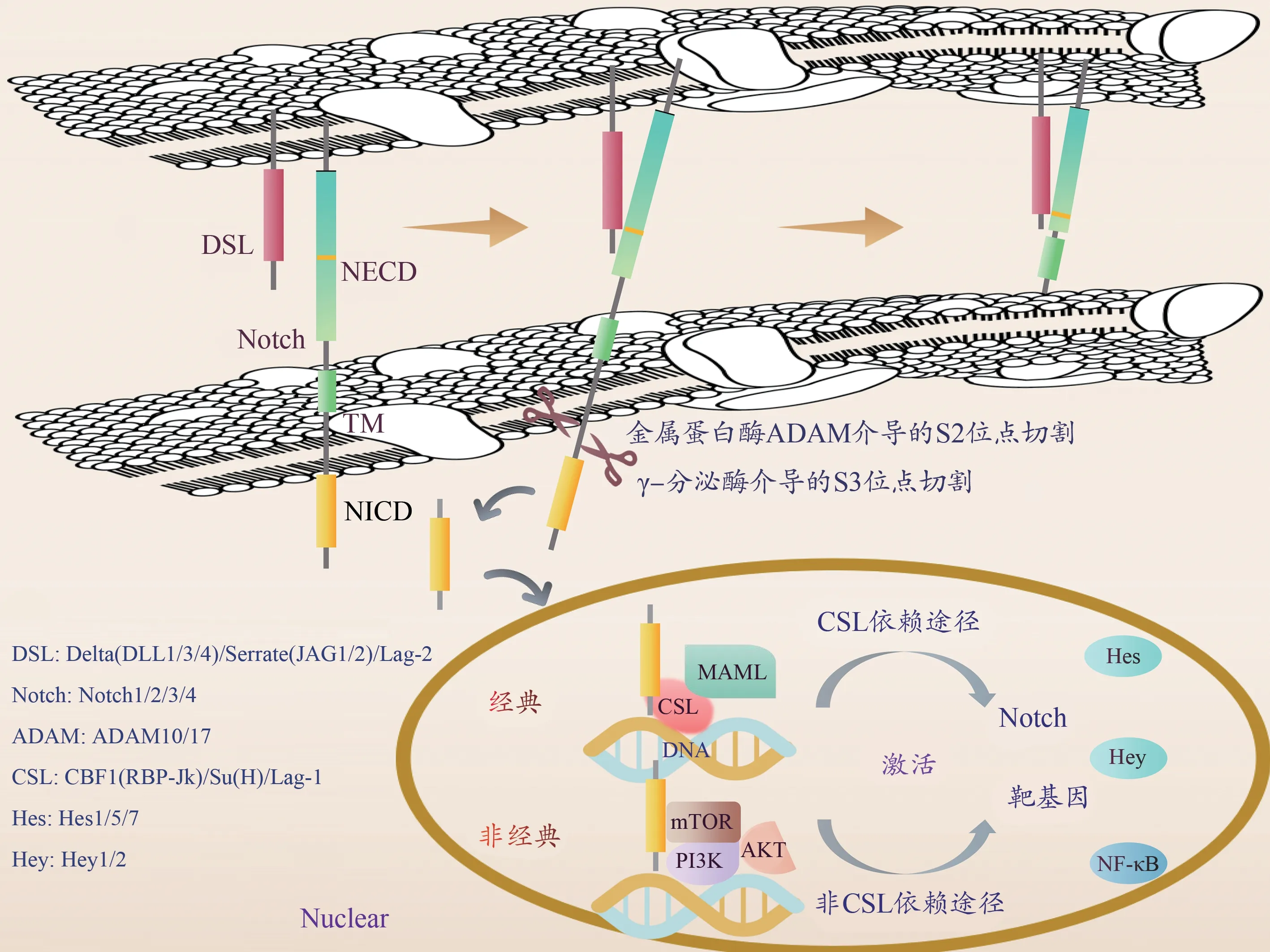
圖1 Notch信號級聯反應Figure 1. Cascade Reaction of the Notch Signaling
在全基因組關聯研究中篩選出與MDD、雙向情感障礙、精神分裂癥相關的差異表達基因富集通路,發現其中包括Notch信號通路(Wang et al., 2022)。雷蕾等(2015)的臨床研究顯示,抑郁癥患者外周血中可能存在Notch信號通路相關因子表達的調控異常。另有尸檢結果證實,大腦特定區域Notch通路的異常表達可能是MDD患者自殺的潛在原因(Monsalve et al., 2014)。Tian等(2018)的動物研究表明,Notch信號通路可以動態調控神經發生,這可能是PSD的一種發病機制。CMS可以誘發缺血大鼠的抑郁行為,并伴有細胞凋亡標志物Bax/Bcl-2的比值升高、神經突觸受損和齒狀回突觸素的表達減少,而阻斷γ-分泌酶介導的Notch信號通路可通過逆轉這些改變來發揮對PSD的治療作用(Wang et al., 2012)。Luo等(2019)認為,血管生成是一個復雜的細胞過程,Notch信號通路在血管新生過程中參與調節內皮細胞的特殊功能和不同命運。如VEGF是與抑郁發病密切相關的神經營養因子之一,Notch信號可以通過其受體直接或間接調控血管生成。Shang等(2016)還提出,在Notch信號與炎癥之間存在一種新的相互調節模式,即炎癥刺激能夠激活Notch信號,并且細胞中的Notch信號也會反過來調節炎癥反應。在抑郁與炎癥之間也存在類似的影響模式,即抑郁會加強炎癥反應,炎癥反應也會誘發抑郁。Orent等(2016)的研究表明,當經典Notch通路被激活后,Notch信號通路可誘導炎癥細胞因子IL-9、IL-17A和γ-干擾素(interferon-γ,IFN-γ)等的表達。Notch信號通路還能夠控制人類CD8(+)T細胞啟動并影響效應T細胞的功能(Kuijk et al., 2013)。目前,與Notch相關的研究主要集中在癌癥研究領域,表明Notch信號通路也極有可能涉及抑郁和癌癥的共病機制。
Notch通路是肌衛星細胞激活的重要信號傳導路徑,通過受體與配體的相互作用傳遞信號,從而調控肌細胞增殖分化或細胞凋亡。鄧桂勇等(2020)發現,運動可激活肌衛星細胞的Notch信號通路。Carey等(2007)在其細胞實驗中發現,在培養人骨骼肌細胞的分化過程中,Notch3、JAG1、Hes1基因轉錄本表達增加。該研究還發現,在規律的抗阻訓練中,Notch1的表達增加,DLL1的表達降低,且在運動訓練后,不同年齡組之間的Notch表達差異不再明顯。陸樂等(2015)的研究表明,8周自主跑輪運動促進了小鼠海馬神經干細胞增殖,可能同樣和Notch信號通路的激活有關。Brandt等(2010)發現,體育鍛煉增加了成年海馬神經發生過程中3型前體細胞的Notch活性、細胞增殖和細胞周期的退出。Kim等(2020)還發現,運動時被激活的低氧誘導因子1α(hypoxia inducible factor-1α,HIF-1α)可以通過Notch信號通路調節參與神經干細胞的存活和分化。另外,有氧運動也可通過Notch信號通路有效緩解慢性腦缺血引起的神經元損傷,促進突觸再生(Mao et al., 2017)。而大腦毛細血管在生理上能夠經歷血管生成的刺激,如運動和5-羥色胺再攝取抑制劑(serotonin selective reuptake inhibitors,SSRIs),因此血管生成可能在抑郁癥的康復中發揮重要作用。此外,Notch信號通路可對免疫細胞的發育進行調控,高強度間歇訓練通過靶向NF-κB和Notch信號通路逆轉HFD誘導的巨噬細胞極化(Shanaki et al., 2020),該反應在運動免疫過程中較為活躍。綜上所述,運動在激活Notch信號通路后,可通過調控神經發生、血管新生、中樞炎癥來發揮改善抑郁等積極的健康效應。
Notch信號通路還可通過調節能量平衡來改善與抑郁相關的能量代謝紊亂。Notch受體類似“代謝傳感器”,表現出對微環境變化(包括葡萄糖和脂質代謝物)極強的反應能力,直接影響相關基因的表達,從而在代謝和轉錄的變化之間建立起重要聯系。Veys等(2020)發現,葡萄糖轉運蛋白GLUT1在靜息期以Notch信號依賴的方式與糖酵解解離,其對中樞神經系統發育性血管生成和成人中樞神經系統穩態至關重要。Notch信號對糖代謝的抑制作用有助于抑制骨髓間充質祖細胞中成骨細胞的形成,具體機制為Notch通過下調糖酵解和線粒體復合物I相關基因的表達水平,減弱線粒體呼吸,減少超氧化物產生,并降低腺苷酸活化蛋白激酶(adenosine 5’-monophosphate-activated protein kinase,AMPK)活性(Lee et al.,2018)。此外,陳祥和等(2021)的研究表明,下坡跑運動可通過激活Notch信號通路改善II型糖尿病(T2DM)小鼠的骨形成代謝紊亂。因此,Notch信號通路被認為是肌骨代謝中的關鍵角色,而肌肉因子中的脂聯素(adiponectin,ADP)和鳶尾素(irisin)也可通過Notch信號發揮中樞保護效應。You等(2021)的研究發現,體育鍛煉可以通過激活Adiponectin-Notch通路(尤其是ADAM10和Notch1 2個關鍵分子)改善慢性應激導致的海馬神經發生和認知功能障礙,而敲除ADP基因或抑制Notch信號通路則會阻斷跑步運動的治療效果。運動誘發的irisin可以調節Notch信號通路,上調Notch1、NICD和Hes1的表達,下調IL-1β和TNF-α的表達,并抑制海馬神經元凋亡,從而緩解全腦形態學損傷,改善大腦神經功能(Jin et al.,2019)。基于整合生物學的視角,這表明運動可調控Notch信號通路,先調節骨骼肌中的生長發育和能量代謝,再通過肌腦對話和骨腦對話重塑大腦能量平衡,發揮中樞保護效應并維持中樞系統穩態,最終參與神經退行性疾病的相關機制。
6 小結與展望
本研究通過綜述相關文獻,總結Notch信號通路介導運動對抑郁調控可能存在的作用機制(圖2)。運動干預激活Notch信號通路(包括Notch受體、配體、效應分子、下游靶點等)后,通過外周-中樞對話機制,整合Notch信號通路對心臟的舒張和收縮、腸道的干細胞穩態、肌肉中的肌代謝、肌肉因子激活、成肌細胞分化、肌肉干細胞、骨骼肌祖細胞和肌肉衛星細胞的穩態、骨骼中的骨代謝、成骨血管新生、成骨細胞形成、破骨細胞活性和炎性骨吸收等產生的影響,進而調控神經祖/干細胞的增殖存活分化、神經發生與凋亡、神經營養與保護、神經可塑性、神經內分泌、血管新生、炎癥免疫、腸道平衡、表觀遺傳、氧化應激和能量代謝以及其他信號轉導等過程,最終完成外周改變后對中樞神經系統的信息遞送,實現機體內環境穩態的調整乃至重塑。在運動整合生物學的研究視角下,多個運動敏感分子(如irisin、ADP、瘦素、IL-6、TNF-α、乳酸、色氨酸等)已被發現是大腦健康效應的介導者(夏杰 等,2017)。基于文獻綜述,Notch信號通路也可能是該介導體系中的重要成員,主要通過參與“肌-腦”“骨-腦”“腸-腦”和“心-腦”對話發揮作用,因此可以進一步推測Notch信號通路是運動調控抑郁機制中的關鍵介導通路之一。然而,目前鮮見相關研究且針對性不足,亟待開展相關實驗及研究。
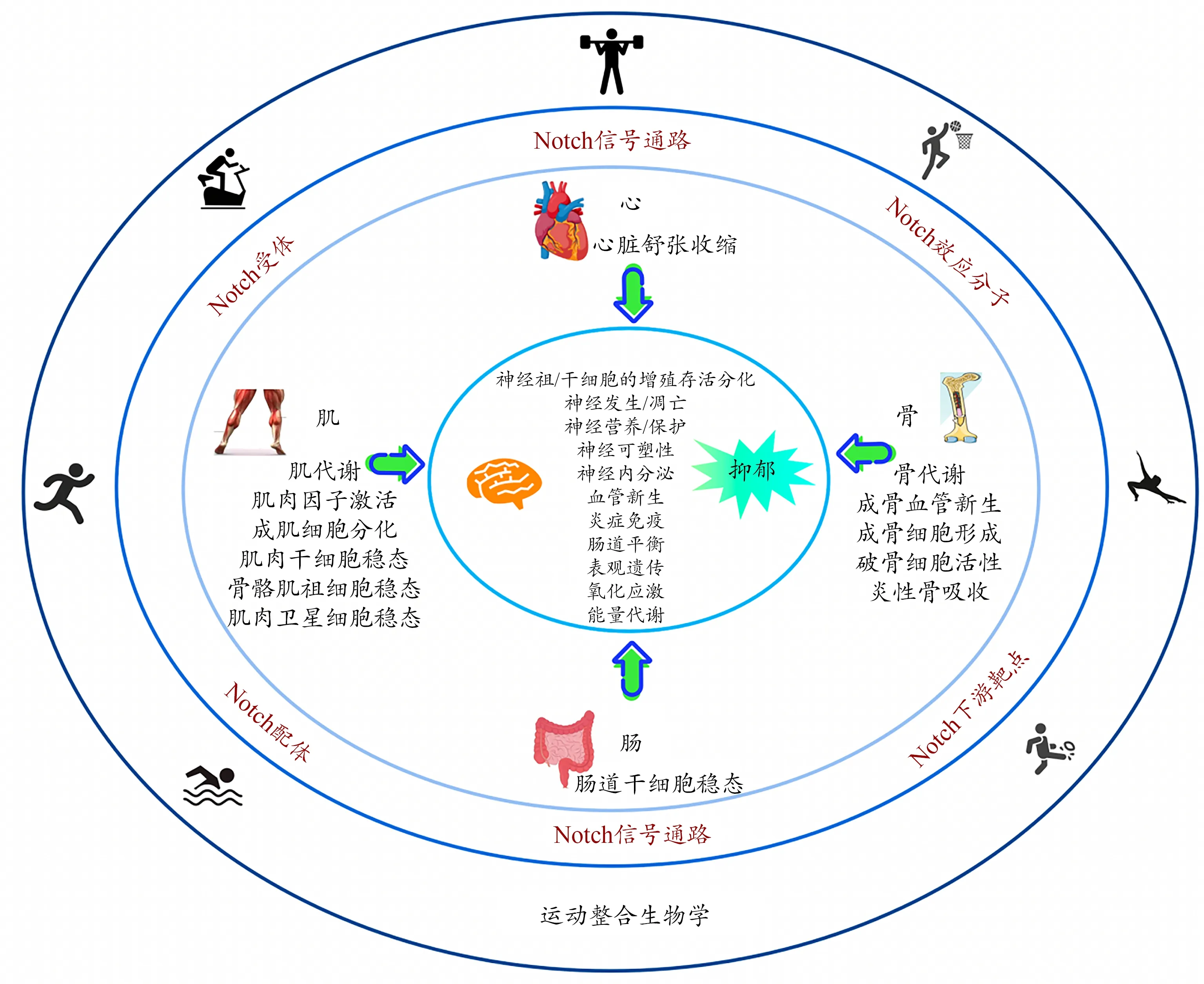
圖2 Notch信號通路介導運動對抑郁的調控機制Figure 2. Regulation Mechanism of Exercise on Depression Mediated by the Notch Signaling Pathway
近年來,Notch信號通路的相關研究多集中于惡性癌癥的生物學機制,且正在開發多種不同靶點的Notch通路抑制劑(靶向Notch配體的單克隆抗體以及靶向Notch受體的抗體)作為治療藥物。運動對癌癥和抑郁的治療在生物學基礎上具有交叉性,因此,探究Notch信號通路在治療抑郁癥等神經系統疾病中所扮演的角色,對惡性癌癥的治療同樣具有重要的臨床意義。
基于目前的研究進展,以下問題仍需被進一步明晰和證實:1)Notch的受體、配體、效應分子及下游靶點等在抑郁發病及運動調控抑郁機制中的分工和協同調控的具體機制,以及其中發揮關鍵作用的分子類型;2)在運動調控抑郁的過程中,Notch信號作為重要的介導通路,其主要介導過程可能發生在肌肉、骨骼、心臟和腸道。除其分別與大腦的對話機制外,是否存在器官組織間的相互對話機制以及其具體的對話方式;3)運動對Notch信號通路的影響是否存在“運動處方特異性”,即不同的運動方式、強度、時間等是否對Notch的受體、配體、效應分子及下游靶點有不同的改變,并對抑郁產生不同影響;4)Notch信號通路已被報道可能參與多種疾病的發生發展機制,其是否與抑郁的共病現象及運動對其他疾病的干預機制有關。以上問題可促進運動對抑郁的干預及抑郁共病調控機制的研究成果轉化。

