穩心顆粒在心功能障礙大鼠中的作用效果研究*
吳煒清,楊代和
(福建省福建中醫藥附屬第二人民醫院麻醉科,福建 福州 350001)
目前國內外對急性肺損傷(acute lung injury,ALI)/急性呼吸窘迫綜合征(acute respiratory distress syndrome,ARDS)相關心功能障礙機制研究不多,對心功能障礙的治療也多為對癥處理,缺乏整體辯證施治方法[1]。而對于心功能障礙的診斷目前還是使用傳統的二維超聲心動圖,通過測量心腔大小,室壁厚度,根據計算值算出射血分數,評估心功能狀態,這種普通二維彩超存在著切面影響大,可重復性差,不能診斷早期心功能下降缺點[2]。除此之外,對于心肌細胞整體功能測定,當前常用方法還是放射核素心肌灌注顯像(myocardial perfusion imaging,MPI),它需要依賴201TlCl、99Tcm-MIBI和131I-BMIPP之一作為心肌灌注顯像示蹤劑,采用單光子發射計算機斷層顯像(Single-PhotonEmissionComputedTomography,SPECT)現最終存活心肌結果[3],存在空間分辨率低、放射核素劑量大、成像時間較長,易受衰減影響缺點。這些都表明臨床需要提供一種新的治療方法,治療藥物來針對這一病癥。除SARS-CoV-2致病因素外,ALI/ARDS也常繼發于膿毒癥、肺炎、胃內容物吸入或重大創傷后,以彌漫性肺泡毛細血管膜損傷為主要病理特征,臨床表現為急性呼吸窘迫和難治性低氧血癥,常伴有多器官功能衰竭[4],通常在初期表現為急性肺損傷(Acute Lung Injury,ALI),初始階段只出現輕度的呼吸功能下降,但如不早期干預,最終會進展為ARDS[5]。據報告美國每年大約有15萬人最終進展為ARDS,死亡率為40%~50%,因此對于ALI/ARDS相關的心功能障礙機制研究是當前臨床急需,也為穩心顆粒的可能作用靶基因提供了方向。穩心顆粒對miRNA調控作用尚未明確,對于可能的miR-106b-25、miR-93調控機制,可以采用熒光探針定量PCR法,測量穩心顆粒治療前后的miRNA水平進行驗證[6]。為此,本研究建立不同濃度脂多糖模擬ALI/ARDS大鼠心功能障礙模型,基于miR-106-b25、miR-93調控的內質網應激-線粒體復合膜穩態機制,檢測相關蛋白,研究穩心顆粒改善ALI/ARDS相關心功能障礙機制,現報道如下。
1 資料與方法
1.1 一般資料
60只健康成年SD大鼠(Sprague-Dawley rats,SD)(200-250g)應用隨機數字表法分為A/B 2組,每組各30只大鼠。
1.2 建模及用藥
(1)A組為模型組。模型制備前禁食水12h;75%酒精消毒實驗器材和實驗臺,腹腔注射10%水合氯醛(300mg/kg)麻醉,使其75度仰臥固定于大鼠操作臺上,頸部外置光源,左手輕輕將大鼠舌頭向外拉出,即可見大鼠聲門隨呼吸開閉;將20號套管針剪短針芯后經口插入氣管,拔出針芯確定套管在氣管內后,滴注按目標劑量配制好的LPS溶液,迅速使大鼠立位旋轉,使LPS溶液在兩肺中均勻分布,拔出套管;待大鼠清醒后,在清潔級動物實驗室常規喂養12h。
(2)B組為模型+用藥組。將30只SD大鼠再分為0.9%生理鹽水(normal saline,NS)+2.7g/kg穩心顆粒對照組(B0組)、LPS 5mg/kg+2.7g/kg穩心顆粒組(B1組)、LPS 10mg/kg+2.7g/kg穩心顆粒組(B2組)、LPS 15mg/kg+2.7g/kg穩心顆粒組(B3組) 、LPS 20mg/kg+2.7g/kg穩心顆粒組(B4組)(n=6)。自由攝食和飲水。按以上方法建立肺損傷模型,12h后,B組大鼠給予2.7g/kg穩心顆粒水溶液灌胃給藥,灌胃體積為5mL/kg,每日給藥1次,持續4周。
1.3 指標及檢測方法
熒光探針定量PCR法測量心肌細胞miR-106b-25和miR-93表達水平:
第一步:提取A組每只大鼠心肌組織miRNA
將大鼠心肌組織從液氮中取出,加入氯仿,無水乙醇,離心,所得的液體為RNA,將RNA樣品用核酸紫外分光光度進行濃度測定,準備反轉錄。
第二步:反轉錄
配制反轉錄液,離心后,輕柔混勻,放在冰上待用。使用TaqMan microRNA探針,加入miR-106b-25和miR-93的特異性引物序列。
第三步:熒光定量PCR反應
設置引物濃度,退火溫度,測試引物,進行PCR反應,B組4周后進行。
1.4 統計學方法
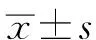
2 結果
2.1 2組大鼠用藥前后miR-106-b25、miR-93水平比較
用藥前,2組大鼠miR-106-b25、miR-93水平差異不顯著,P>0.05;用藥后,B組模型+用藥組miR-106-b25、miR-93水平均顯著優于A組模型組,差異顯著,P<0.05,見表1。

表1 2組大鼠用藥前后miR-106-b25、miR-93水平比較
3 討論
越來越多的證據表明內質網應激與ALI/ARDS的發病機制有關。同時,內質網應激在心肌肥大和心力衰竭的發展中也發揮著關鍵作用。而內質網跨膜相關蛋白又受多種miRNA調控,miRNA其自身雖然不能編碼蛋白質,但能在轉錄后調控靶基因mRNA的表達,從而發揮生物學功能。在臨床上,我們試用了中藥穩心顆粒治療存在心功能障礙患者[7],取得一定療效,但其作用機理未明確。已知穩心顆粒可以調節Ca2+/鈣調蛋白依賴性蛋白激酶Ⅱ(CaMKⅡ)防止心力衰竭[4]。也有報道證實穩心顆粒對心肌梗死的治療和心律失常的防治具有確切臨床療效,同時還證實其具有益氣活血養陰作用。
穩心顆粒是一個優良的心血管類藥方[8,9],其主要由黨參、三七、甘松等組成,現代藥理研究表明,黨參有效成分在心血管系統疾病的治療中發揮著非常重要的作用,能夠抑制鈣內流和細胞凋亡。而三七具有促血管生成,抑制細胞凋亡,減輕氧化應激,抑制炎性反應和內皮依賴性血管舒張作用,同時甘松揮發油可抑制氧化應激誘導的細胞死亡。有研究表明用三七總皂苷(panax notoginsenoside,PNS)處理的缺血再灌注損傷細胞中miR-30c-5p的水平顯著上調。而黨參能使老化模型大鼠282lncRNAs、283mRNAs和19miRNAs上調,這證明了黨參的抗衰老作用[10]。這些各組分的研究一定程度揭示了穩心顆粒分子層面可能機制。但是,眾所周知中藥方劑講究君臣佐使,往往多組分配伍使用。
本次研究結果顯示,用藥前,2組小鼠miR-106-b25、miR-93水平差異不顯著,P>0.05;用藥后,B組模型+用藥組miR-106-b25、miR-93水平均顯著優于A組模型組,差異顯著,P<0.05。提示,穩心顆粒能明顯改善心功能障礙大鼠miR-106-b25、miR-93水平,效果顯著。
綜上所述,穩心顆粒在心功能障礙大鼠中具有較優的作用效果,且有助于miR-106-b25、miR-93基因表達水平的改善。

