艾司洛爾聯合連續血液凈化治療對感染性休克患者組織氧代謝及炎性因子水平的影響
唐燕平,李善敬,蘇鐘東
(廣東醫科大學附屬第二醫院急診科,廣東湛江 524000)
感染性休克為臨床危急重癥,具有進展快、病死率高等特點,早期表現為神志不清、血壓下降等癥狀,若不及時治療,還可誘發多臟器功能衰竭[1-2]。連續血液凈化(continuous blood purification,CBP)是近年來治療感染性休克的重要手段之一,可清除患者體內炎性介質與內毒素,阻止炎癥急性擴散,從而減輕體內器官組織損傷,穩定病情進展[3]。但感染性休克病情復雜,單純CBP治療效果有限。艾司洛爾為β腎上腺素能受體阻滯劑,具有減慢心率、改善心肌血氧供應、增強心功能等多種作用,有利于穩定機體血流動力,在感染性休克治療中具有重要價值[4]。鑒于此,本研究旨在分析艾司洛爾聯合CBP治療感染性休克的臨床效果。
1 資料與方法
1.1 一般資料選取2019年1月—2021年1月廣東醫科大學附屬第二醫院急診科收治的感染性休克患者68例,按隨機數字表將其分為對照組(39例)與觀察組(39例)。研究經醫學倫理委員會批準。對照組男24例,女15例;年齡52~76歲,平均(62.34±4.17)歲;感染類型:15例肺部感染,9例泌尿系統感染,10例腹腔感染,5例其他感染;體重指數18~26 kg/m2,平均(23.54±1.17)kg/m2。觀察組男23例,女16例;年齡52~77歲,平均(62.38±4.19)歲;感染類型:14例肺部感染,10例泌尿系統感染,11例腹腔感染,4例其他感染;體重指數18~26 kg/m2,平均(23.58±1.19)kg/m2。兩組一般資料比較差異無統計學意義(P>0.05),具有可比性。
1.2 納入和排除標準納入標準:符合《中國急診感染性休克臨床實踐指南》[5]中診斷標準;6 h早期液體復蘇及目標導向治療后中心靜脈壓仍≥12 mmHg,并需應用去甲腎上腺素維持心率≥95次/min、平均動脈壓≥65 mmHg者;患者及家屬知情同意。排除標準:入組前使用過β-受體阻滯劑;合并惡性腫瘤;凝血功能障礙。
1.3 治療方法兩組均接受抗感染、呼吸支持、營養支持等綜合治療,并動脈穿刺監測連續心排血量。對照組采用CBP治療,選用Muti Filtrate型血濾機及相關配套設備,CBP治療的模式為連續性靜脈-靜脈血液濾過,自右側頸內靜脈穿刺置管,建立好血管通路后,置換液流速控制在3000~4000 mL/h,并加用低分子量肝素抗凝,其間監測活化部分凝血活酶時間,維持40~60 s,每日治療12 h內,單套濾器及管路應用應小于24 h,視病情治療5~7 d。于對照組基礎上,觀察組加用鹽酸艾司洛爾(廣州萬正藥業有限公司,國藥準字:H20055990)治療,經上腔靜脈導管給藥,初始微量泵入0.05 mg/(kg·min),后期依據心率調整劑量,控制24 h內心率低于100次/min,連續用藥5~7 d。
1.4 觀察指標(1)臨床療效。顯效:治療后收縮壓高于90 mmHg,意識恢復清醒,周圍微循環灌注改善顯著,尿量高于30 mL/h,且48 h內病情穩定;有效:收縮壓為顯效標準,意識恢復清醒,尿量明顯增加,但仍需間斷予以多巴胺等藥維持血壓,且于72 h內病情穩定;無效:未達上述標準。(2)組織氧代謝指標。治療前及治療7 d后,以血氧監護儀監測兩組中心靜脈血氧飽和度(ScvO2)變化,并采集3 mL靜脈血,以分光光度法測定血乳酸(Lac)水平。(3)炎性因子。治療前及治療7 d后,采集兩組5 mL靜脈血,離心取得血清后,以酶聯免疫吸附法測定白介素-1β(IL-1β)水平,并以放射免疫法測定降鈣素原(PCT)水平。(4)心功能指標。治療前及治療7 d后,采集兩組空腹靜脈血,分別采用熒光免疫層析法、膠體金法測定B型鈉尿肽(BNP)、肌鈣蛋白I(cTnI)。
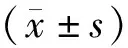
2 結 果
2.1 兩組臨床療效比較觀察組治療總有效率高于對照組,差異有統計學意義(P<0.05)。見表1。
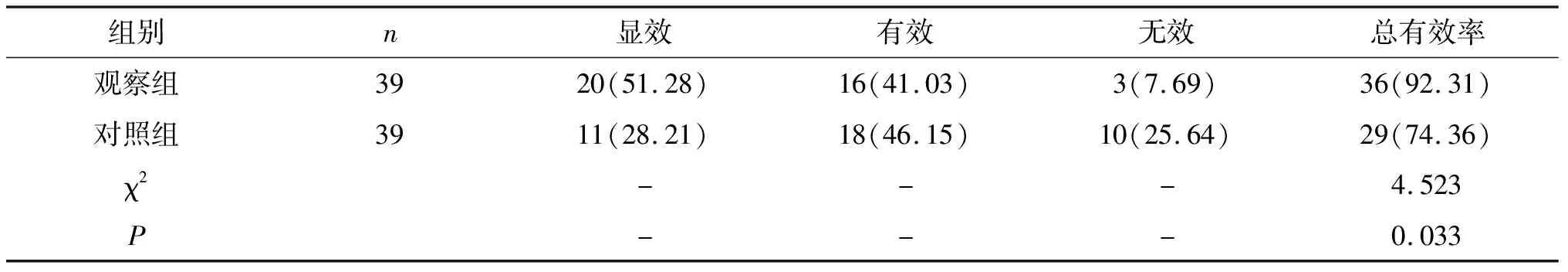
表1 兩組臨床療效對比[n(%)]
2.2 兩組的組織氧代謝指標比較觀察組治療后ScvO2高于對照組,Lac低于對照組,差異有統計學意義(P<0.001)。見表2。
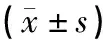
表2 兩組組織氧代謝指標對比
2.3 兩組炎性因子水平比較觀察組治療后IL-1β、PCT水平低于對照組,差異有統計學意義(P<0.001)。見表3。
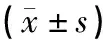
表3 兩組炎性因子水平對比
2.4 兩組心功能指標比較觀察組治療后BNP及cTnI低于對照組,差異有統計學意義(P<0.01)。見表4。
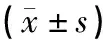
表4 兩組心功能指標對比
3 討 論
感染性休克發病較為復雜,多由各種病原微生物侵襲機體引發全身性炎癥反應,致毛細血管通透性增加及靜脈異常擴張,大量血漿外滲,體內有效循環血量減少,導致心臟代償功能障礙,使得有效循環血量不足進一步加重,最終引起微循環功能障礙[6-7]。感染性休克進展迅速,若未能及時控制,可引起多器官組織缺血缺氧,誘發多器官功能衰竭,威脅生命安全[8]。臨床應及時抑制炎癥蔓延,糾正組織器官缺氧,以改善感染性休克患者預后。
CBP屬于新型血液凈化技術,通過連續性靜脈-靜脈血液濾過,可快速清除體內多種炎性介質及內毒素,阻斷瀑布樣炎癥反應,減輕機體炎性損傷,從而阻止感染性休克患者病情繼續惡化[9-10]。CBP還可清除體內溶質和過多水分,糾正酸堿與水電解質失衡,穩定機體內環境,改善微循環狀態,并能提高組織細胞攝氧能力,緩解組織器官缺氧,以促進病情恢復[11]。但感染性休克發病機制復雜,單純CBP治療雖具有一定療效,但對患者病情整體改善幅度較小。ScvO2、Lac為監測組織氧代謝的重要指標,當機體組織缺氧時,ScvO2降低,Lac分泌增多。IL-1β、PCT為監測炎癥反應的重要指標,其中IL-1β參與免疫應答及組織修復等過程,炎癥加劇時其水平異常升高,可加速感染性休克進展;PCT可反映全身炎癥反應活躍程度,機體受嚴重感染時,可促進PCT大量合成并釋放入血。本研究結果顯示,觀察組治療總有效率高于對照組,治療后ScvO2高于對照組,Lac低于對照組,IL-1β、PCT水平低于對照組,表明艾司洛爾聯合CBP治療感染性休克效果顯著,可控制機體炎癥反應,糾正組織氧代謝異常,以穩定病情進展。艾司洛爾為超短效靜脈β-受體阻滯劑,具有起效快、代謝快、方便調控等特點,通過持續靜脈泵入,可迅速結合β腎上腺素受體,抑制兒茶酚胺及神經遞質對β-受體激動效應,從而阻滯β-受體,穩定控制患者心率,對抗過度代謝狀態,以降低心肌氧耗,增加冠脈供血,糾正外周組織低灌注,進而提高患者生存率[12-13]。同時,艾司洛爾還具有一定抗炎作用,可對兒茶酚胺經β-受體介導的TLR-4及其下游炎性因子表達產生抑制作用,在一定程度上減輕炎癥反應。感染性休克的主要原因為膿毒癥,膿毒癥引發的心肌損傷是導致患者多器官功能障礙及功能衰竭的主要原因[14]。本次研究結果顯示,觀察組治療后BNP及cTnI低于對照組。提示艾司洛爾聯合CBP治療感染性休克有利于降低BNP及cTnI水平,對患者心肌損傷具有保護作用。艾司洛爾在感染性休克治療中,能夠拮抗兒茶酚胺及神經遞質對β受體起到的激動作用,可阻滯β受體,穩定患者的心率,降低心肌耗氧量,且對平均動脈壓無明顯影響,同時可增加冠脈血流灌注,改善心肌氧供及血供,具有明顯的心肌保護作用,有利于改善心功能[15]。艾司洛爾與CBP聯用后可協同增效,從不同作用環節發揮作用,以增強炎癥控制效果,糾正多器官組織缺血缺氧狀態,進而阻止病情惡化,提高預后效果。
綜上所述,艾司洛爾聯合CBP可迅速阻斷感染性休克患者機體炎癥蔓延,改善組織氧代謝狀況及心功能,以穩定病情進展。

