堆疊碳纖維電極在膜電容去離子脫鹽中的應用
陳旭東,李朝霞,馬俊俊,王曉菊,牛建瑞,張 靜,劉 春
(1. 河北省科學院地理科學研究所,河北省地理信息開發應用技術創新中心,河北石家莊 050011;2.石家莊市排水管護中心,河北石家莊 050050;3. 河北科技大學環境科學與工程學院,河北石家莊 050018)
在全球水資源儲量中,可供人類利用的淡水資源只占0.26%,導致淡水資源短缺,為解決這一問題,海水淡化技術應運而生。電容去離子(capacitive deionization,CDI)是一種新型電化學水處理技術,其基本原理是基于雙電層理論,在低電壓電場(<1.2 V)作用下,多孔電極和電解質溶液兩相界面處的過剩電荷會相互吸引,形成雙電層[1]。進水中的離子遷移至電極表面,并儲存在溶液與電極界面形成的雙電層中,從而出水得到淡水;待電極吸附離子飽和后,通過施加反向電壓或將電極短接,吸附的離子被解吸,電極得以再生進入下一循環。經周期性吸附解吸可持續獲得淡水,同時將離子濃縮到少量濃水中。但CDI在運行過程中,同離子效應的存在會降低電荷效率,增加脫鹽能耗。2006年LEE等[2]首次提出將陰/陽離子交換膜分別置于陽極/陰極與進水溶液之間,形成膜電容去離子技術(membrane capacitive deionization,MCDI),由于離子交換膜具有選擇透過性,大大降低了同離子效應,電荷效率可從60%提升至85%以上,脫鹽性能得到顯著提升。MCDI作為一種新型的水處理技術,具有設備簡單、能耗低、高效、無二次污染、電極可再生等優點,在硬水軟化、海水淡化、重金屬離子去除等領域得到廣泛應用[3-5]。
電極作為MCDI中的關鍵組件,對于系統的脫鹽性能起著決定性的作用。碳材料以其來源廣泛、價格低廉、綠色環保等優點被作為電極材料應用在電化學水處理領域。目前,被廣泛使用的碳材料主要包括活性碳纖維、電容性活性炭粉末、碳氣凝膠、納米碳材料等[6]。其中活性碳纖維成本低廉、導電性好、化學性質相對穩定,是廢水處理的理想材料[7]。碳纖維表面相對光滑和均勻,具有三維多級孔結構、孔隙率高,可根據需要通過簡單裁剪制備成所需一體化電極,且無需黏結劑,避免了電極制備時黏結劑對脫鹽性能的影響。但由于一般碳纖維比較薄,將其作為電極材料時,單位面積電極吸附容量有限。為了進一步提升碳布電極的吸附性能,KANG等[8]在活性碳纖維中摻雜TiO2,有效降低了電子傳遞阻力,提高了離子在碳電極表面的遷移和擴散,最高吸附容量可達10.6 mg/g,比未修飾的活性碳纖維電極提高了71.9%。WU等[9]利用6 mol/L HNO3處理活性碳纖維來降低同離子效應,經酸化處理后的活性碳纖維的吸附容量提升至12.8 mg/g。除了對碳纖維進行金屬氧化物摻雜和酸活化以外,QIAN等[10]利用親水性較高的磺化石墨烯修飾碳纖維電極,構成復合電極,通過提高親水性使得吸附容量提高至9.54 mg/g,電荷效率提高了22%。然而,以上摻雜、酸處理等修飾方式操作復雜。
尋求經濟簡便的制備電極方法對于MCDI工程化應用具有更加重要的意義。在碳纖維有效應用面積確定的前提下,通過增加碳纖維的層數即電極厚度來增加電極的吸附容量是一種操作簡單的制備電極方式。考慮到堆疊碳纖維之間存在空隙,單純堆疊碳纖維增加厚度,會增加電極中離子遷移距離。因此本文通過在碳纖維層間增加高導電性的鈦網構建碳纖維-鈦網復合電極。本文構建了不同堆疊層數的碳纖維電極(carbon fiber,CB),以及碳纖維-鈦網復合堆疊電極(carbon fiber-titanium mesh,CB-Ti),首先研究了碳纖維電極在不同進水質量濃度下的脫鹽效果,采用循環伏安法(cyclic voltammetry,CV)和電化學阻抗譜(electrochemical impedance spectroscopy,EIS)對不同堆疊電極進行了電化學表征,探究碳纖維電極厚度以及增加鈦網作為導電材料對脫鹽性能的影響,并利用熱力學、動力學對其吸附過程進行了深入討論,以期為MCDI規模化應用提供技術支持。
1 材料與方法
1.1 試劑和儀器
主要試劑:氯化鈉(分析純),天津市永大化學試劑有限公司;實驗所用水由Milli-Q超純水機制得(18.2 MΩ·cm)。
主要儀器:電子分析天平(JB/T5374,梅特勒-托利多儀器有限公司);磁力攪拌器(Color squid S000,艾卡儀器設備有限公司);蠕動泵(BT100-1L,保定蘭格恒流源有限公司);電導率儀(S475-UMIX,梅特勒SevenExcellence);電化學工作站(MAC90589,瑞士萬通中國有限公司)。
1.2 電極材料預處理
活性碳纖維購自萬興碳素有限公司;鈦網、鈦絲購自晨屹絲網制品有限公司。鈦網具有厚度薄、編織網絡可進行調節的特點,其良好的導電性,可為片層CB電極提供大量電子傳遞通道。實驗所用鈦網厚度為0.37 mm,將活性碳纖維和鈦網裁剪為45 mm×50 mm的規格,并于超純水中充分浸泡,以去除表面及內部的雜質離子;用鈦絲將活性碳纖維與鈦網進行固定,分別準備不同層數的CB電極以及增加相應Ti層數的CB-Ti復合電極進行試驗。
1.3 MCDI脫鹽系統組裝
MCDI脫鹽系統由低壓直流電源、蠕動泵、MCDI裝置、NaCl溶液儲存瓶組成,其中MCDI裝置由亞克力板(100 mm×100 mm)、硅膠墊片、鈦片、陰離子交換膜(anoion exchange membrane, AEM)、陽離子交換膜(cation exchange membrane, CEM)和電極構成,亞克力板起到固定裝置的作用,硅膠墊片在密封裝置的同時使得電極之間有一定的空間,用塑料隔網做成中間腔室,裝置有效容積為1 125 mm3,鈦網置于2層活性碳布(activated carbon cloth, ACC)或離子交換膜與活性碳布之間,如圖1和圖2所示。
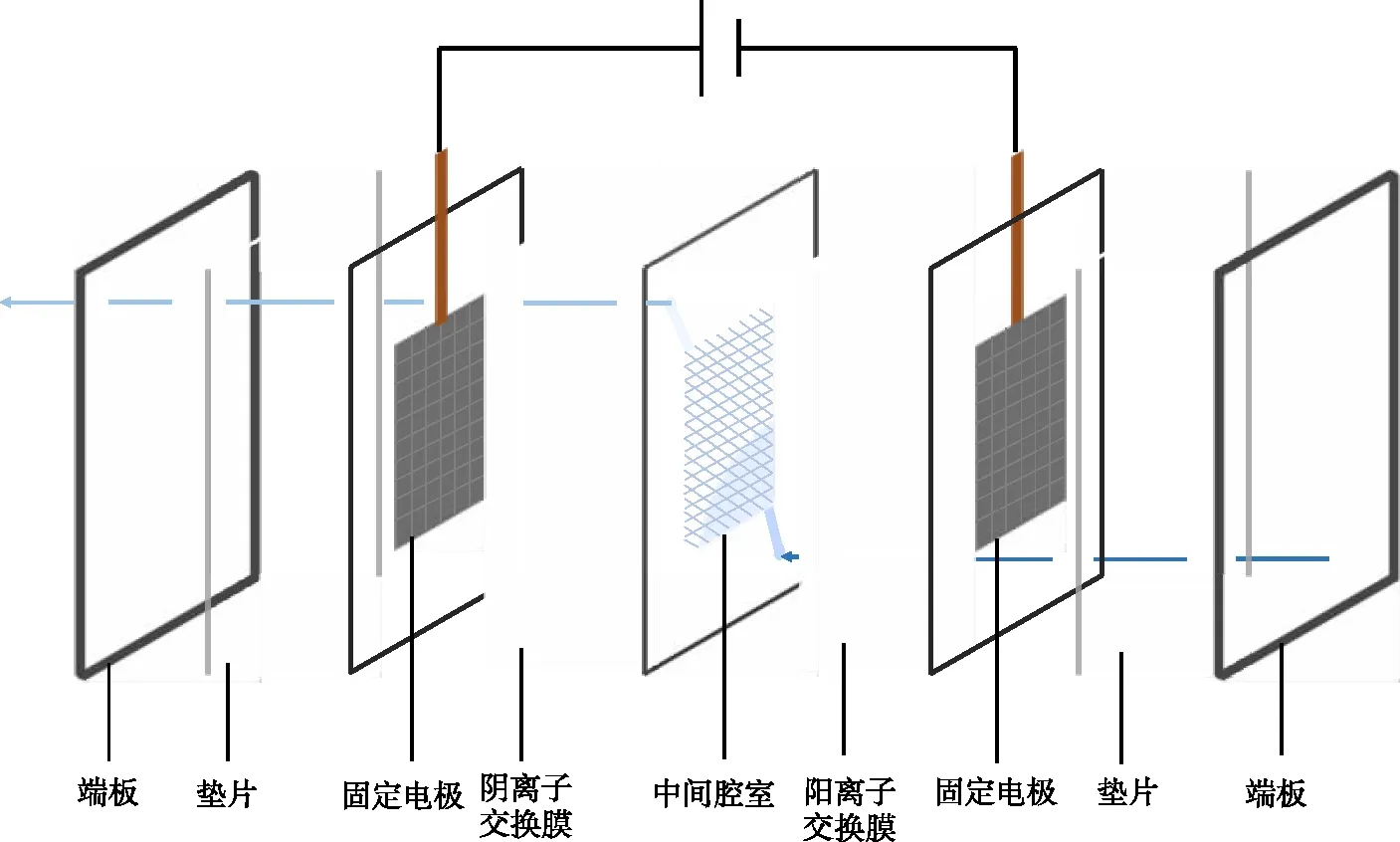
圖1 試驗裝置示意圖Fig.1 Schematic of the experimental device
1.4 MCDI脫鹽試驗
1) 脫鹽性能測試。本試驗以NaCl溶液質量濃度(0.2,0.4,0.6 g/L)、CB電極厚度、CB-Ti復合電極厚度為單因素進行脫鹽試驗,分別命名為CB-厚度,CB-Ti-厚度,并堆疊3層鈦網作為電極與CB-Ti-2.40復合電極進行比較,命名為Ti-厚度,不同電極類型詳細參數見表1。試驗采用間歇進水模式,取40 mL NaCl溶液于錐形瓶中,電導率儀探頭浸入液面下,用磁力攪拌器持續攪拌,由蠕動泵以4 mL/min勻速泵入MCDI裝置,施加電壓1.2 V,脫鹽15 min后,將電壓反向即-1.2 V用于電極解吸,NaCl溶液電導率和電流變化在線監測并實時記錄。由于在一定濃度范圍內,NaCl溶液濃度與電導率呈正比關系,因此由溶液電導率即可實時換算得到相應的NaCl溶液的質量濃度,所有試驗至少重復3次以上。
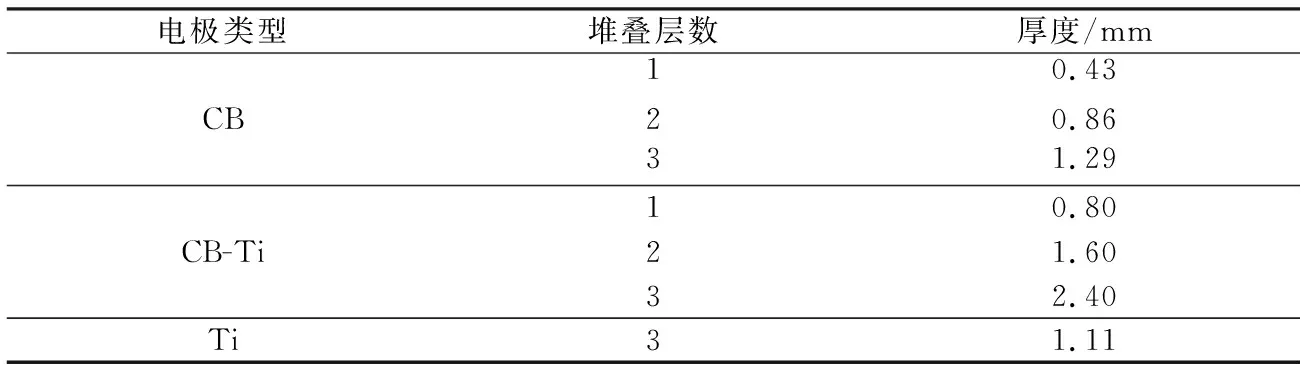
表1 不同電極類型詳細參數Tab.1 Detailed parameters of different electrode types
2) 相關計算公式。MCDI脫鹽性能采用關鍵指標進行分析評價,如脫鹽率、吸附容量、平均脫鹽速度、電荷效率、單位能量脫鹽量等,計算公式見式(1)—式(5)。
脫鹽一定時間后去除離子占總離子的濃度百分比,可以反映電極在一定時間內的脫鹽性能,脫鹽率根據式(1)進行計算。
(1)
式中:η為脫鹽率,%;C0為初始濃度,mol/L;Ct為t時刻NaCl濃度,mol/L。
單位質量電極可吸附的鹽的質量為吸附容量,根據式(2)進行計算。
(2)
式中:Qe為吸附容量,mg/g;V為溶液體積,L;m為電極質量,g。
單位時間單位電極面積的脫鹽量由平均脫鹽速度表示,根據式(3)進行計算。
(3)
式中:ASAR為平均脫鹽速度,μmol/(cm2·min);S為電極面積,cm2;t為時間,min。
實際脫鹽電荷占總消耗電荷量的百分比即電荷效率,根據式(4)進行計算。
(4)
式中:CE為電荷效率,%;n為陰陽離子所帶電荷,Na+和Cl-均為1;F為法拉第常數,(F=96 485 C/mol);I為電流,A。
去除單位質量的鹽所需要消耗的能量可由單位能量脫鹽量表示,根據式(5)進行計算。
(5)
式中:ENRS為單位能量脫鹽量,μmol/J;U為電壓,V。
1.5 吸附熱力學和動力學
采用Langmuir與Freundlich 2種等溫模型來擬合CB電極除鹽的平衡吸附量,等溫線模型分別見式(6)、式(7),準一級和準二級動力學模型可用式(8)和式(9)表示[11]。
(6)
式中:Ce為吸附平衡濃度,mg/g;qe為平衡吸附量,mg/g;qm為最大吸附容量,mg/g;KL為親和常數。
(7)
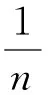
ln(qe-qt)=lnqe-K1×t,
(8)
式中:qe為平衡吸附量,mg/g;qt為時間為t時的吸附量,mg/g;K1為準一級吸附速率常數。
(9)
式中:K2為準二級吸附速率常數。
1.6 CB/CB-Ti電極電化學表征測試
為了表征CB電極與CB-Ti電極的電化學特性,采用三電極體系對其進行了CV和EIS測試。CB或CB-Ti電極作為工作電極,鉑片作為對電極,飽和甘汞電極作為參比電極,1 mol/L NaCl作為電解液(高濃度NaCl溶液可有效避免測試過程中離子缺乏的問題[12])。比電容測試中,施加(-1.2~+1.2) V電壓,設定掃速為10 mV/s,記錄響應電流的變化。
(10)
式中:C為比電容,F/g;I為響應電流,A;m為電極質量,g;v為掃描速率,V/s。
EIS用以研究電極的動態電容和電阻,分析電極的導電性,EIS設置測試頻率為0.01~105 Hz,由計算機自動進行測試記錄,根據實驗繪制電化學阻抗圖譜。
2 結果與討論
2.1 CB電極
1) 進水濃度。為考察初始進水濃度對吸附過程的影響,配制不同初始濃度的NaCl溶液,圖3 a)為出水電導率隨時間變化曲線,3種初始進水濃度下均表現出先下降后上升的趨勢。在施加1.2 V電壓進行吸附時,電導率下降;隨后施加-1.2 V電壓進行解吸時電導率回升至初始水平。由電導率變化曲線進一步得到了在不同初始濃度下脫鹽率、吸附容量、脫鹽速度的變化。由圖3 b)可以看出在初始進水濃度為0.2,0.4,0.6 g/L時,吸附容量分別為6.08,8.00,9.74 mg/g,脫鹽速度分別為0.25,0.33,0.40 μmol/(cm2·min)。

圖3 不同進水質量濃度時裝置的脫鹽性能Fig.3 Desalination performance of the device at different influent concentrations
隨著初始進水濃度的增加,吸附容量和脫鹽速度均逐漸增大,其原因可能是較高的初始進水濃度提供克服傳質阻力的驅動力,在較高進水濃度下,雙電層被壓縮,重疊效應減小,從而為離子提供了更大的吸附可用表面積[13-14],隨著進水濃度的增加,雙電層可以更有效地在碳電極的多孔界面上形成,為離子吸附提供更有利的條件[15];其次,單位體積溶液中的離子數量增多,溶液-電極微孔界面處進水與電極孔中的離子濃度差增大,靜電相互作用增強[16],致使電極整體歐姆阻力減小,離子的傳質速率得到提高,因此脫鹽速度和吸附容量均得以提升。
2) CB電極厚度。電極厚度直接影響電極的結構,對機械穩定性以及電荷傳質特性有較大影響[17],因此本文詳細探究了電極厚度對脫鹽性能的影響。由圖4可知,CB厚度增加后吸附容量下降,CB-0.86每層CB的吸附容量為2.86 mg/g,CB-1.29每層CB的吸附容量為3.21 mg/g。其原因可能是多層CB的疊加會導致電極厚度增加,離子在CB表面及其內部擴散存在的阻力增大,同時離子遷移距離變長,因此堆疊電極中每層CB的吸附容量呈下降趨勢。此外,導致這種現象的原因也可能為活性碳纖維層與層之間留有空隙,接觸不夠緊密,離子傳質阻力大。吸附容量略微上升的原因可能是CB疊加導致鹽溶液與電極間的接觸面積變大,CB電極能夠吸附更多的離子。
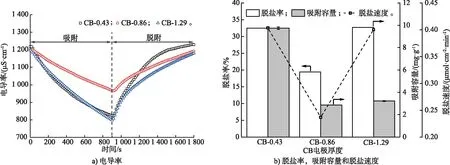
圖4 不同堆疊CB電極的脫鹽性能(試驗條件:NaCl初始質量濃度0.6 g/L)Fig.4 Desalination performance of different stacked CB electrodes (Experimental conditions: initial NaCl concentration of 0.6 g/L)
2.2 CB-Ti復合電極
為了解決堆疊CB電極層與層之間空隙導致較大電極電阻的問題,在CB電極間增加鈦網提高堆疊電極的導電性,穿過離子交換膜的離子被CB電極立即吸附,顯著提升脫鹽效率。從圖5 a)中可以看出,隨著鈦網層數的增加,電導率下降幅度逐漸增加。相關脫鹽數據根據式(1)—式(5)計算后如圖5 b)所示,脫鹽率和脫鹽速度隨之增加,脫鹽速度分別為0.07,0.17,0.22 μmol/(cm2·min)。因此CB之間增加鈦網作為導電體,CB電極上的電荷分布更加均勻,電荷的傳輸距離明顯縮短,吸附離子速度加快,在長期運行中可以克服電子傳遞和吸附能力之間的平衡問題[18]。但是CB-Ti-2.40單位電極吸附容量有所下降,可能是由于鈦網與鈦網以及鈦網與第2層的碳纖維電極之間形成了等勢體,導致中間CB電極的電勢發生變化,靜電平衡后電場內部電勢為零,因此吸附容量受到影響。
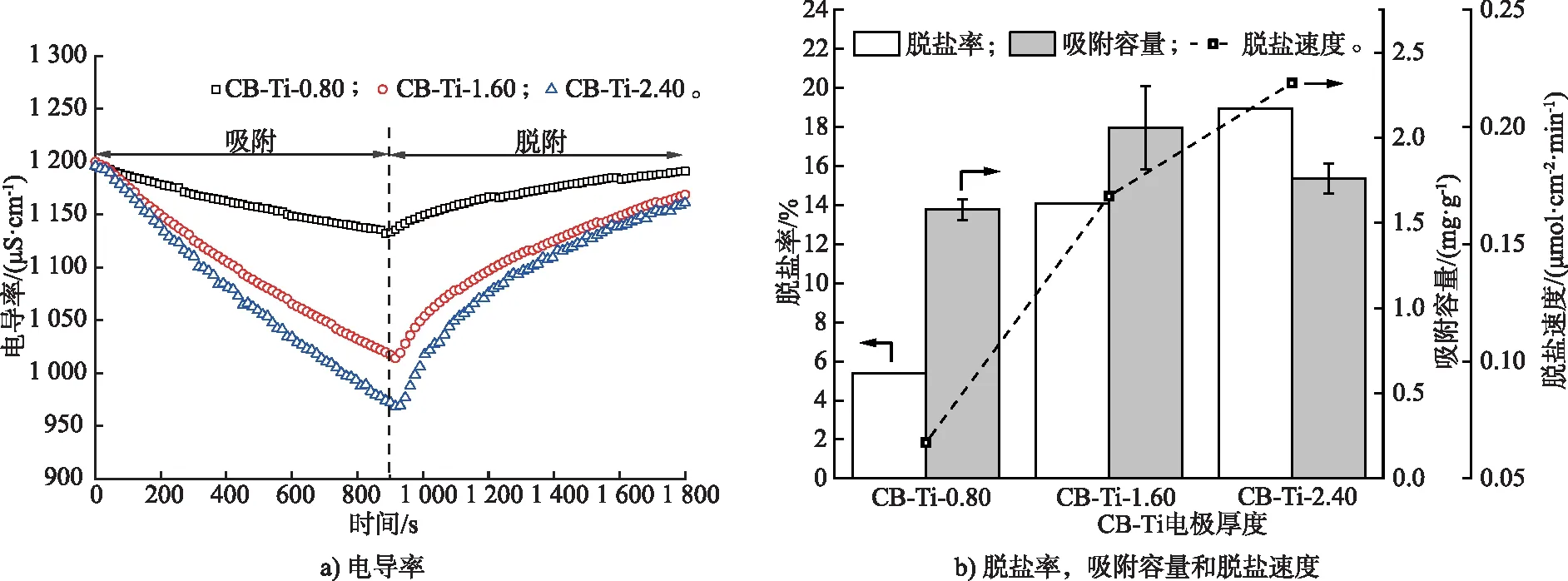
圖5 不同堆疊CB-Ti電極的脫鹽性能 (試驗條件:NaCl初始質量濃度0.6 g/L)Fig.5 Desalination performance of different stacked CB-Ti electrodes (Experimental condition: initial NaCl concentration of 0.6 g/L)
2.3 鈦網在脫鹽過程中的作用機制
為了排除電滲析對試驗的影響,研究了單純鈦網堆疊3層的脫鹽效果,由圖6可以看出,堆疊鈦網作為電極時電導率變化微小,脫鹽率僅為0.44%,與CB-Ti-2.40復合電極的脫鹽率相比差異顯著。在本試驗中主要起吸附作用的為CB電極,而鈦網主要起增強導電性、降低電子傳遞阻力的作用,因此可以忽略電滲析的影響。
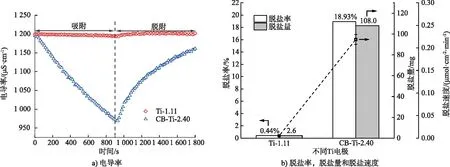
圖6 Ti-1.11和CB-Ti-2.40電極的脫鹽性能對比Fig.6 Comparison of desalination performance of Ti-1.11 and CB-Ti-2.40 electrodes
2.4 吸附過程機制
1) 吸附熱力學過程模擬。在一定溫度下,吸附達到平衡時,可以使用吸附等溫線來表示電極的吸附量和溶液中離子平衡濃度的關系[19]。利用2種模型對CB電極的吸附熱力學過程進行擬合,擬合曲線如圖7所示。2種模型的相關擬合參數如表2所示,可知Langmuir模型的擬合相關系數大于Freundlich模型,結果表明CB電極的熱力學吸附過程適合用Langmuir模型。由此可以得出活性碳纖維的吸附形式為單層吸附,吸附位點與被吸附離子數量一致,具有均勻的表面吸附,各位置有相同的吸附強度,被吸附離子之間的相互作用可忽略不計[20-21]。
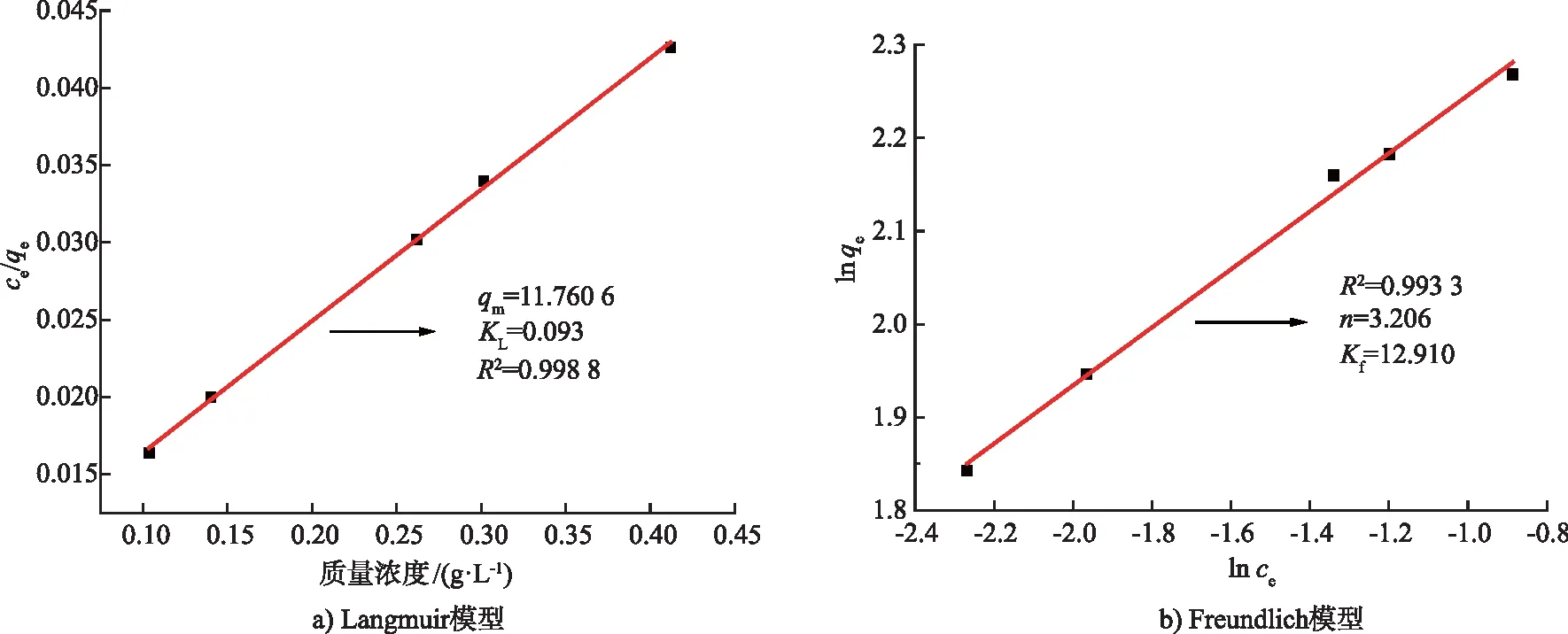
圖7 吸附熱力學及其擬合圖Fig.7 Adsorption thermodynamics and its fitting diagram
2) 吸附動力學模擬。采用準一級動力學和準二級動力學方程分別擬合不同條件下的電吸附行為,以研究CB電極對離子的吸附動力學過程。準一級動力學模型可以反映存在于固相與液相界面的吸附反應的速度快慢[22];準二級動力學模型假定吸附速率受化學吸附機理的控制,涉及到吸附劑與吸附質之間電子共用或者電子轉移,研究達到平衡過程中反應速率與反應物濃度之間的關系[23]。
由圖8可知,在不同初始進水濃度以及不同碳氈厚度的條件下,更符合準二級動力學。但如圖8 e)和圖8 f)所示,在增加不同鈦網層數的條件下,對比擬合后的相關系數,電吸附過程經過準一級動力學擬合后線性關系較好,更符合準一級動力學,表明脫鹽電吸附主要為物理吸附,離子的吸附速率與剩余吸附容量成正比,初始進水濃度的增加促使離子外擴散增強,因此導致平衡吸附容量增加,吸附容量上升速率隨之加快[16];也說明CB電極的吸附速率受到離子濃度的影響。
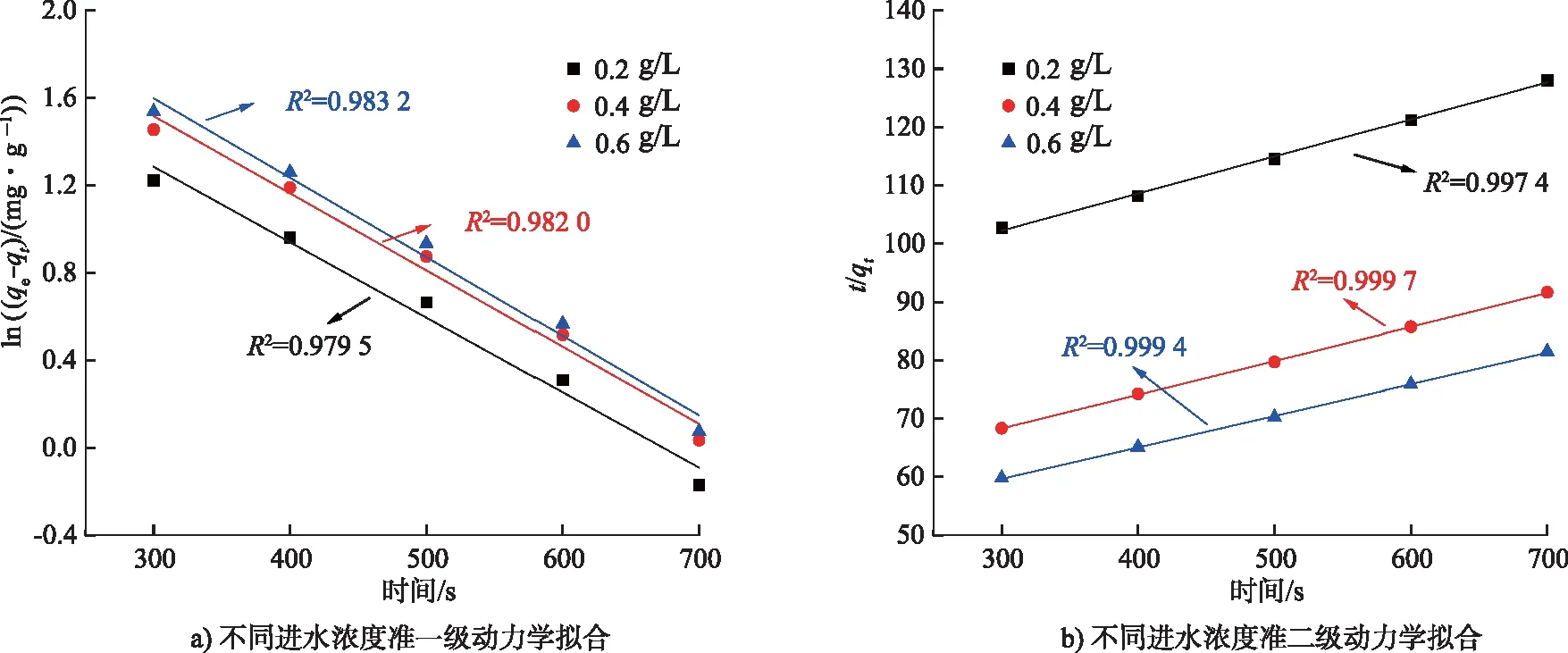
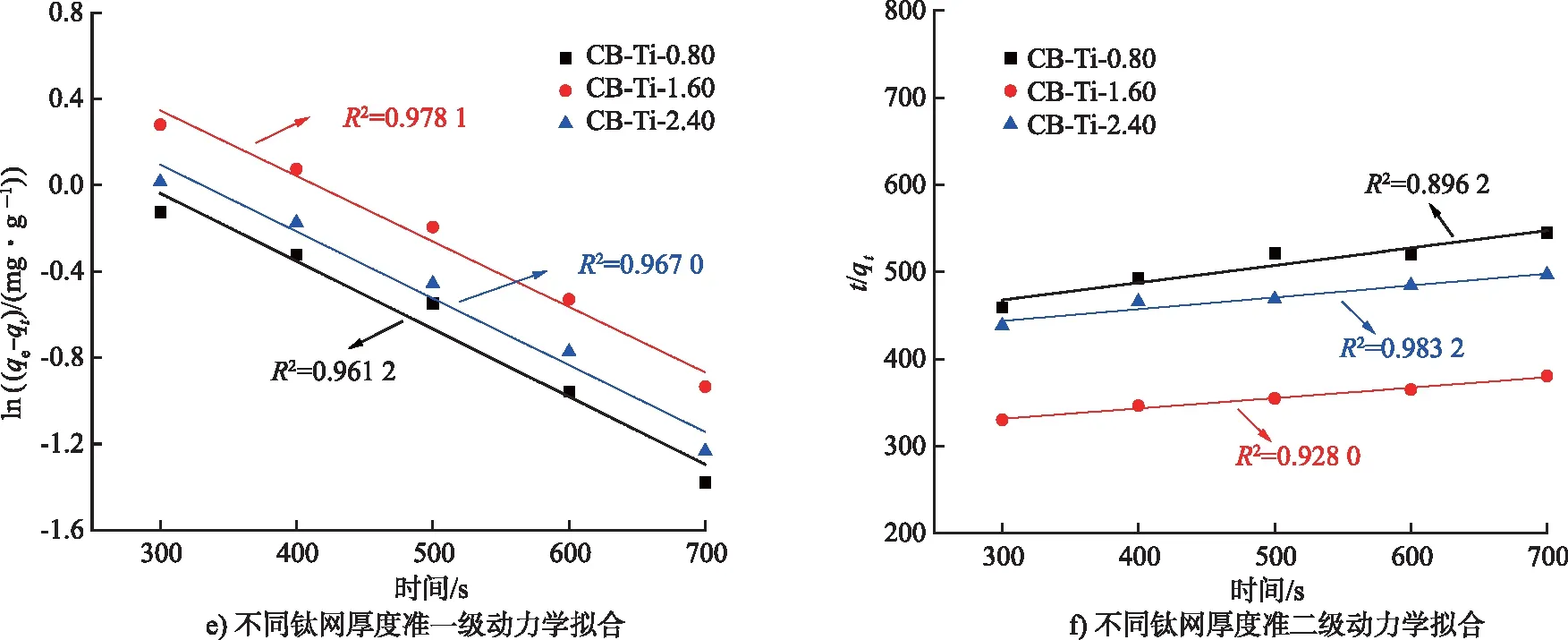
圖8 不同條件下一級和二級動力學模型擬合Fig.8 Fitting of first-order and second-order kinetic models under different conditions
2.5 電化學表征
1) CV測試。利用循環伏安測試可以有效評價電極材料的比電容,通過循環伏安曲線的形狀和積分面積等可以判斷材料的電化學性能,評價電極材料的電荷儲存能力。按照式(10)計算可得CB的比電容為10.19 F/g。如圖9所示,在整個電位窗口范圍內,電流隨電勢穩定地增加或減少,沒有出現氧化還原峰,表明電極沒有法拉第反應發生,離子通過形成雙電層被吸附在電極表面。本研究中選擇的CB具有良好的雙電層電容特性。
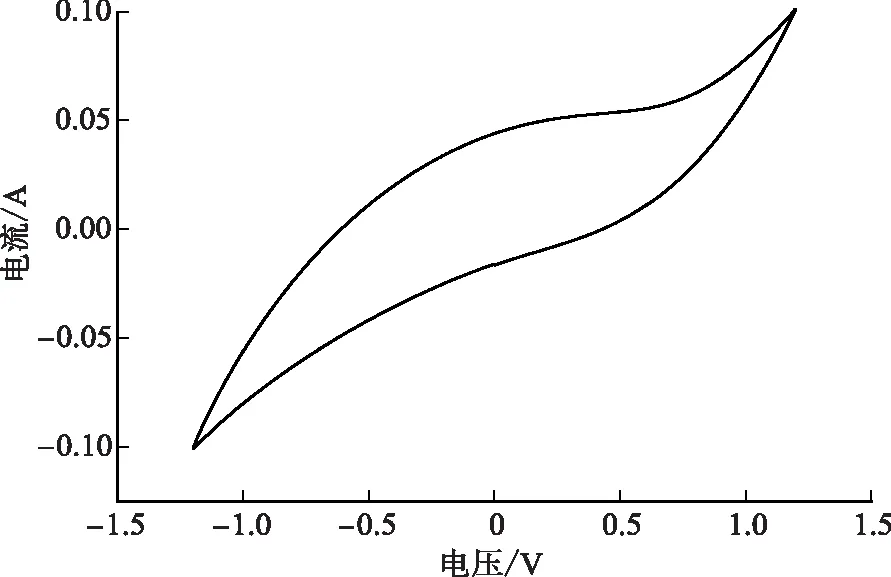
圖9 掃描速率為10 mV/s時單層CB電極的CV曲線Fig.9 CV curve of single-layer CB electrode at a scanning rate of 10 mV/s
2) EIS分析。圖10為不同電極的EIS圖,不同電極的阻抗譜均由高頻段的2段圓弧和低頻段直線2部分組成,與實軸的第一個交點表示裝置整體電阻,即歐姆電阻,主要包括中間腔室進水、離子交換膜、集電體以及所有導線的電阻;高頻區圓弧部分的直徑可以用來表征電子傳遞阻力,低接觸阻抗有利于電極和電解質界面的電荷傳遞[24]。
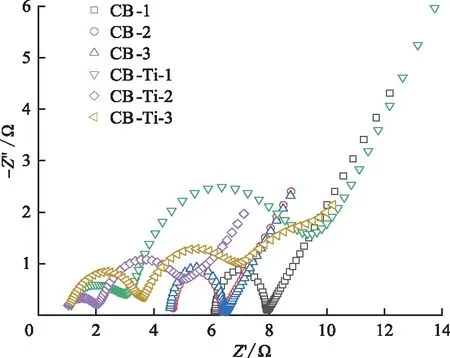
圖10 堆疊CB電極的EIS圖Fig.10 EIS diagram of stacked CB electrodes
由圖10可以看出,增加電極厚度可以降低整體歐姆阻力以及電子、電荷傳遞阻力,增加鈦網后,高頻區與x軸的交點左移,整體電阻大幅減小,即增加鈦網可以提高堆疊CB電極的導電性,同時離子以及電子傳遞阻力也相應下降[25]。
3 結 論
本文通過堆疊碳氈增加電容去離子電極的吸附容量,進一步通過在電極片層間加入多層鈦網提升堆疊電極的導電性。堆疊碳纖維電極可導致脫鹽效率有所下降,但通過增加多層鈦網作為導電體可以有效提升脫鹽速度,當間隔增加3層鈦網時,吸附速度較單層提高了2.1倍。增加初始進水濃度有利于提升脫鹽速度,進水質量濃度為0.6 g/L時,脫鹽速度最高可達0.4 μmol/(cm2·min),吸附容量達9.74 mg/g。吸附過程符合準一級動力學,并隨著堆疊層數的增加,脫鹽率由5.4%提升至18.9%,脫鹽速度由0.07 μmol/(cm2·min)提升至0.22 μmol/(cm2·min)。本文突破傳統通過電極修飾、添加電極導電劑等提升電極導電性的方法,具有簡便、無污染等優勢,尤其便于工程化應用。但也存在著鈦網成本較高的問題,需要進一步開發價廉且性能優異的導電材料。

