帕金森病患者腸易激綜合征臨床分析
馬宇敏 張玲玲 沈麗華 劉肇修 陳偉觀
[摘 ? 要] ? 目的:分析帕金森病(Parkinsons disease,PD)患者腸易激綜合征(intestinal bowel syndrome,IBS)的發(fā)生率及相關影響因素。方法:PD患者83例,根據(jù)羅馬Ⅳ診斷標準,分為IBS組21例(25.3%)和非IBS組62例(74.7%)。比較兩組患者一般資料、相關量表評分及每日左旋多巴等效劑量,分析發(fā)生IBS的相關因素。結果:IBS組非運動癥狀評估量表(non-motor symptoms scale,NMSS)評分、匹茲堡睡眠質量指數(shù)(Pittsburgh sleep quality index,PSQI)評分、漢密爾頓抑郁量表(Hamilton depression scale,HAMD)-17評分、漢密爾頓焦慮量表(Hamilton anxiety scale,HAMA)-14評分高于非IBS組,差異均具有統(tǒng)計學意義(P<0.05)。焦慮是PD患者發(fā)生IBS的獨立危險因素(P<0.001)。IBS組中9例IBS出現(xiàn)在運動癥狀前,12例出現(xiàn)在運動癥狀后。IBS出現(xiàn)在運動癥狀前患者NMSS評分高于IBS出現(xiàn)在運動癥狀后患者,差異具有統(tǒng)計學意義(P=0.034)。結論:IBS是PD患者的常見癥狀,合并IBS的PD患者睡眠障礙、焦慮及抑郁等非運動癥狀更嚴重,焦慮與PD患者發(fā)生IBS相關,IBS發(fā)生在運動癥狀前的PD患者焦慮癥狀更嚴重。
[關鍵詞] ? 帕金森病;腸易激綜合征;風險因素;焦慮
[中圖分類號] ? R742.5 [文獻標志碼] ? B [DOI] ? 10.19767/j.cnki.32-1412.2023.03.010
帕金森病(Parkinsons disease,PD)作為常見的神經(jīng)系統(tǒng)變性疾病,以運動功能障礙為主要表現(xiàn),而胃腸道癥狀作為PD患者最常見的非運動癥狀之一逐步受到重視[1]。胃腸道功能障礙可以出現(xiàn)在PD病程各個階段,甚至是PD首發(fā)癥狀[2],可能引起患者體重下降、腹痛、吸入性肺炎甚至腸梗阻等一系列并發(fā)癥,嚴重影響生活質量[1]。腸易激綜合征(intestinal bowel syndrome,IBS)是以腹痛或腹部不適、排便習慣改變?yōu)橹饕Y狀的臨床綜合征,在PD患者病程中往往被忽視。本研究選擇南通市第二人民醫(yī)院及南通大學附屬醫(yī)院神經(jīng)內(nèi)科和消化內(nèi)科2019年1月—2021年12月就診的PD患者83例,通過問卷調查形式,分析PD患者IBS發(fā)生率及相關影響因素,為及時診斷及治療PD患者IBS提供依據(jù)。
1 ? 資料與方法
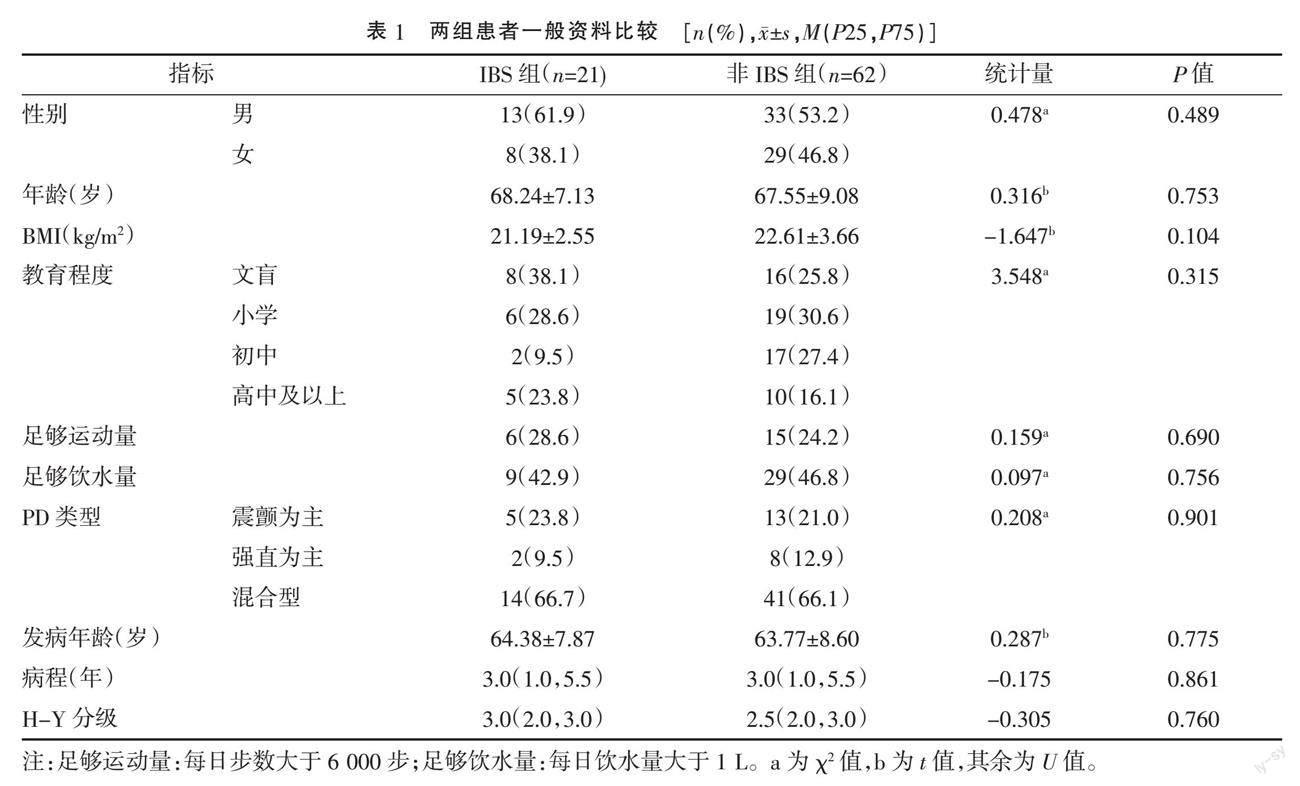
1.1 ? 一般資料 ? PD患者83例,分為IBS組21例(25.3%)和非IBS組62例(74.7%)。兩組性別、年齡、體質量指數(shù)(body mass index,BMI)、受教育程度、運動量、飲水量、PD類型、發(fā)病年齡、病程、Hoehn-Yahr(H-Y)分級比較,差異均無統(tǒng)計學意義(P>0.05)。見表1。納入標準:(1)符合2016年中華醫(yī)學會神經(jīng)病學分會帕金森病及運動障礙學組制定的帕金森病臨床診斷標準[3];(2)IBS符合羅馬IV診斷標準[4],即診斷前癥狀至少出現(xiàn)6個月,近3個月反復發(fā)作的腹痛平均每周至少1次,腸道習慣的改變;(3)患者和(或)家屬簽署知情同意書。排除標準:(1)繼發(fā)性帕金森綜合征、帕金森疊加綜合征、遺傳性帕金森綜合征;(2)嚴重心肺疾病或肝腎功能明顯異常;(3)消化道器質性疾病。本研究通過南通市第二人民醫(yī)院和南通大學附屬醫(yī)院倫理委員會批準。
1.2 ? 觀察指標 ? (1)患者一般資料:包括人口學資料、生活習慣、PD類型、病程、H-Y分級。(2)相關量表評分:統(tǒng)一帕金森病運動評分(unified Parkinson disease rating scale,UPDRS)Ⅲ量表:每項亞癥狀0~4分,總分為各項亞癥狀之和。非運動癥狀評估量表(non-motor symptoms scale,NMSS):每項亞癥狀按嚴重程度分為0~3分,發(fā)生頻率1~4分,計算每項亞癥狀得分(嚴重程度×發(fā)生頻率),總分為各項亞癥狀得分之和。自主神經(jīng)癥狀量表(scale for outcomes in PD for autonomic symptoms,SCOPE-AUT):共6個維度23個項目,按嚴重程度分為0~3分,總分為各項之和。匹茲堡睡眠質量指數(shù)(Pittsburgh sleep quality index,PSQI):總分21分,分值越高,睡眠質量越差。漢密爾頓抑郁量表(Hamilton depression scale,HAMD)-17:總共17項,每項按嚴重程度分為5個等級,其中0分為無,4分為極重度,總分為各項之和。漢密爾頓焦慮量表(Hamilton anxiety scale,HAMA)-14:共14項,每項按嚴重程度分為5個等級,其中0分為無,4分為極重度,總分為各項之和。帕金森病生活質量問卷(Parkinson disease quality of life questionnaire,PDQ)-39:包括8個維度39個項目,每項按嚴重程度分為5個等級,其中0分為從不,4分為根本無法做,總分為各項之和。(3)嗅覺減退:通過回答NMSS中“是否存在嗅覺減退”對患者進行嗅覺評估。(4)每日左旋多巴等效劑量(Levodopa equivalent dose,LED):左旋多巴標準片×l+左旋多巴控釋片×0.75+(左旋多巴標準片×1+左旋多巴控釋片×0.75)×0.25(同時服用恩他卡朋片)+吡貝地爾緩釋片×1+鹽酸普拉克索片×100+鹽酸司來吉蘭片×10。
1.3 ? 統(tǒng)計學處理 ? 應用SPSS 22.0統(tǒng)計學軟件對數(shù)據(jù)進行統(tǒng)計分析。符合正態(tài)分布的計量資料以■±s表示,組間比較采用t檢驗;不符合正態(tài)分布的計量資料以M(P25,P75)表示,組間比較采用Wilcoxon秩和檢驗;計數(shù)資料以頻數(shù)和率表示,組間比較采用χ2檢驗;采用二分類Logistic回歸分析模型進行影響因素的多因素分析。P<0.05為差異有統(tǒng)計學意義。
2 ? 結 ? ? ?果
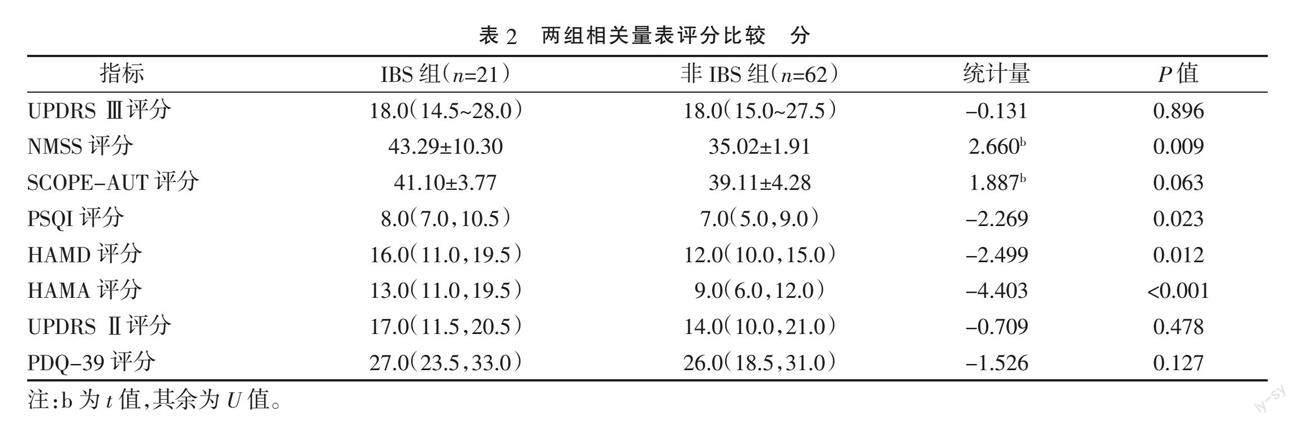
2.1 ? 兩組嗅覺減退、LED及各量表評分比較 ? IBS組嗅覺減退15例(71.4%),LED 285.0(200.0,350.0)mg/d,非IBS組嗅覺減退31例(50.0%),LED 300.0(250.0,362.3)mg/d,兩組差異均無統(tǒng)計學意義(P>0.05)。IBS組NMSS評分(P=0.009)、PSQI評分(P=0.023)、HAMD評分(P=0.012)、HAMA評分(P<0.001)高于非IBS組,差異均具有統(tǒng)計學意義(P<0.05)。兩組UPDRS Ⅲ評分、SCOPE-AUT評分、UPDRS Ⅱ評分及PDQ-39評分比較,差異均無統(tǒng)計學意義(P>0.05)。見表2。
2.2 ? 影響PD患者發(fā)生IBS相關因素分析 ? 以NMSS評分、PSQI評分、HAMD評分、HAMA評分為自變量,IBS為因變量,應用有序Logistic回歸進行分析,結果顯示焦慮是PD患者發(fā)生IBS的獨立危險因素(OR 1.284,95%CI 1.130~1.459,P<0.001)。
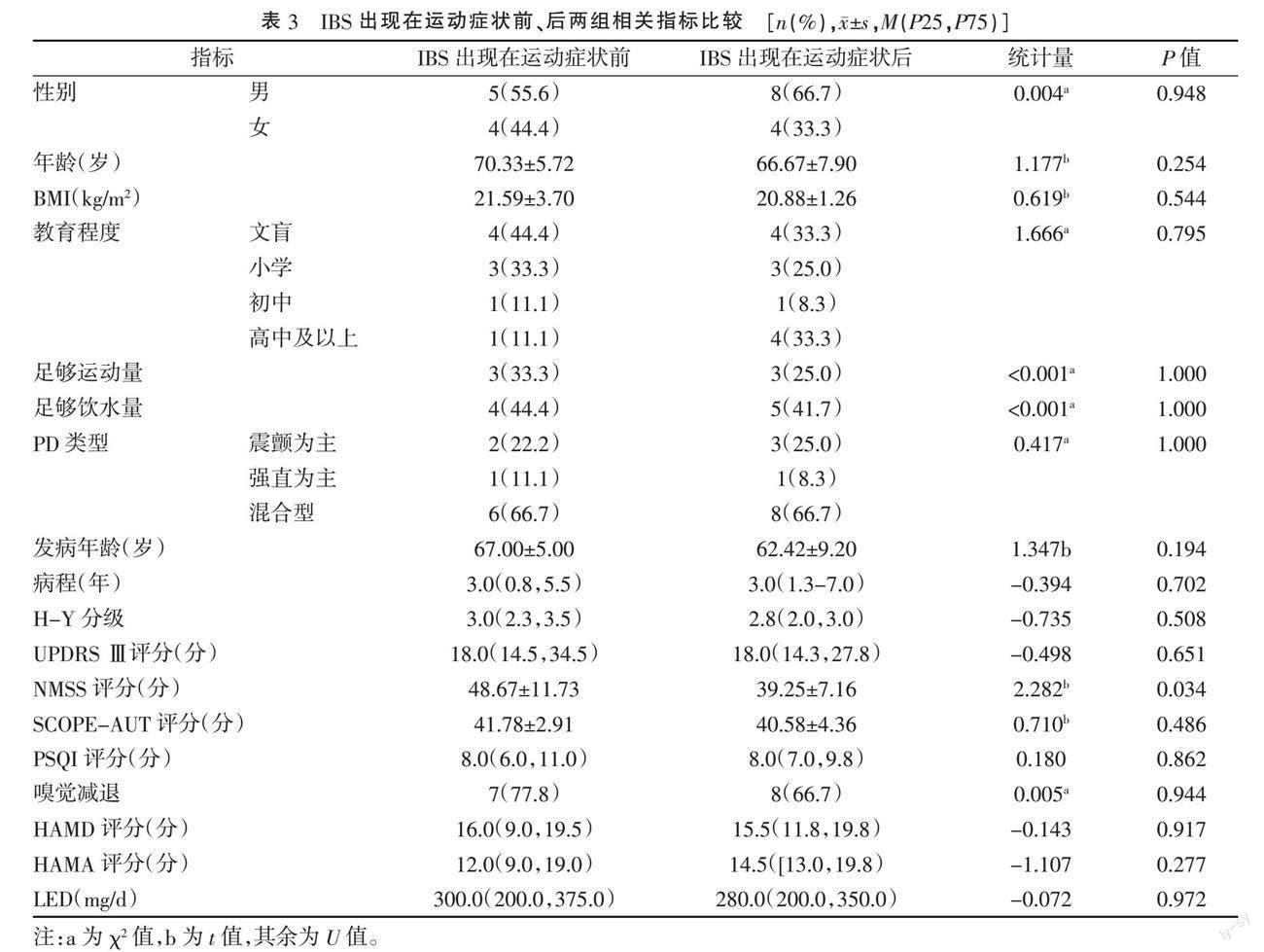
2.3 ? IBS出現(xiàn)在運動癥狀前、后兩組相關指標比較 ? IBS組中9例IBS出現(xiàn)在運動癥狀前,12例IBS出現(xiàn)在運動癥狀后。IBS出現(xiàn)在運動癥狀前患者NMSS評分高于IBS出現(xiàn)在運動癥狀后患者,差異具有統(tǒng)計學意義(P=0.034)。見表3。
3 ? 討 ? ? ?論
本研究根據(jù)目前診斷IBS公認的羅馬Ⅳ診斷標準,納入的PD患者IBS患病率為25.3%,明顯高于中國普通人群6.5%[5],與MISHIMA等[6]報道的17.0%相仿。PD患者IBS發(fā)生率高可能與患者疼痛閾值下降、腸道功能障礙及腦-腸軸異常有關[7]。
本文研究結果顯示,IBS組非運動癥狀NMSS評分、睡眠質量PSQI評分、抑郁HAMD評分、焦慮HAMA評分高于非IBS組,差異均具有統(tǒng)計學意義(P<0.05),提示IBS組患者睡眠障礙、焦慮及抑郁等非運動癥狀更嚴重。有研究指出PD合并便秘患者非運動癥狀更嚴重[8]。隨著PD病情進展,黑質損害加重,多巴胺水平降低,運動功能受到影響,同時也加重胃腸道功能障礙。α-突觸核蛋白沉積在與腸道功能相關大腦區(qū)域的同時,也廣泛沉積在與運動癥狀、非運動癥狀相關的其他大腦區(qū)域。睡眠障礙是PD常見的非運動癥狀,明顯影響患者日常生活能力和生活質量。IBS組PSQI評分高于非IBS組,表明伴有IBS患者睡眠障礙更加嚴重。一方面腹痛、腹脹等癥狀影響患者睡眠,另一方面睡眠障礙又會加重腸道功能紊亂[9]。本研究IBS組抑郁及焦慮評分高于非IBS組,差異均具有統(tǒng)計學意義(P<0.05);Logistic回歸分析結果顯示,焦慮是PD患者發(fā)生IBS的獨立危險因素(OR 1.284,95%CI 1.130~1.459,P<0.001)。提示焦慮與IBS的發(fā)生密切相關。有研究表明IBS患者焦慮及抑郁的發(fā)病率為正常人的2倍,而25%~30%抑郁癥患者、10%~45%焦慮患者合并有IBS[10-11]。IBS與焦慮、抑郁互為因果,相互影響。隨著PD病程進展,與情緒相關腦區(qū)(如邊緣系統(tǒng)和新皮質)出現(xiàn)路易小體,這可能是PD患者發(fā)生情緒障礙的病理機理之一。5-羥色胺(5-HT)是與情緒維持密切相關的神經(jīng)遞質,5-HT缺乏可引起患者發(fā)生抑郁和焦慮,同時5-HT也具有增強胃腸動力作用[12]。因此,PD患者IBS和情緒障礙可能與5-HT功能受損有關。此外,焦慮、抑郁與IBS的密切關系可能與微生物-腸-腦軸有關,認為腸道微生物通過免疫和自主神經(jīng)途徑與中樞神經(jīng)系統(tǒng)聯(lián)系,調節(jié)胃腸道功能和大腦活動[13]。腸道微生物群失調引起黏膜免疫細胞功能障礙,腸道通透性增加,導致患者發(fā)生情緒障礙和腸道功能紊亂[14]。也有研究認為PD的發(fā)生與腸道微生物群失調引起的腸道炎癥有關[15]。
本研究中21例IBS患者中有9例IBS出現(xiàn)在運動癥狀之前,提示除了嗅覺減退外,IBS也可能是PD前驅癥狀,早期識別非運動癥狀有助于診斷PD。IBS出現(xiàn)在運動癥狀前患者NMSS評分高于IBS出現(xiàn)在運動癥狀后患者,差異有統(tǒng)計學意義(P=0.034),提示前者非運動功能障礙更嚴重。BRAAK等[16]提出PD最早病理改變出現(xiàn)在腸道自主神經(jīng)系統(tǒng),迷走神經(jīng)背核中可見病理性路易小體,隨著病情進展,病理改變通過腦干延伸到黑質,從而出現(xiàn)運動功能障礙。研究發(fā)現(xiàn),在PD患者整個腸道系統(tǒng)中均可發(fā)現(xiàn)α-突觸核蛋白,毒素可能通過腸黏膜屏障以逆行方式向迷走神經(jīng)核運輸,最終累及中樞神經(jīng)系統(tǒng)導致運動癥狀[17]。之前有研究提出便秘及IBS可以作為PD前驅癥狀[7],但診斷PD的特異性不強[18]。RODR?魱GUEZ-VIOLANTE等[19]提出將IBS與便秘、焦慮抑郁與睡眠障礙作為PD前驅期癥狀,共同預測PD的發(fā)生,但預測效果需要進一步驗證。
綜上所述,IBS是PD患者的常見癥狀,合并IBS的PD患者睡眠障礙、焦慮及抑郁等非運動癥狀更嚴重,焦慮與PD患者發(fā)生IBS相關,IBS發(fā)生在運動癥狀前的PD患者焦慮癥狀更嚴重。
[參考文獻]
[1] BLOEM B R,OKUN M S,KLEIN C. Parkinsons disease[J]. Lancet,2021,397(10291):2284-2303.
[2] WARNECKE T,SCH?魧FER K H,CLAUS I,et al. Gastrointestinal involvement in Parkinsons disease: pathophysiology,diagnosis,and management[J]. NPJ Park Dis,2022,8(1):31.
[3] 中華醫(yī)學會神經(jīng)病學分會帕金森病及運動障礙學組,中國醫(yī)師協(xié)會神經(jīng)內(nèi)科醫(yī)師分會帕金森病及運動障礙專業(yè). 中國帕金森病的診斷標準(2016版)[J]. 中華神經(jīng)科雜志,2016,49(4):268-271.
[4] DROSSMAN D A. Functional gastrointestinal disorders: history,pathophysiology,clinical features and Rome IV[J]. Gastroenterology,2016,150(6):1262-1279.
[5] 張璐,段麗萍,劉懿萱,等 中國人群腸易激綜合征患病率和相關危險因素的Meta分析[J]. 中華內(nèi)科雜志,2014,
53(12):969-975.
[6] MISHIMA T,F(xiàn)UKAE J,F(xiàn)UJIOKA S,et al. The Prevalence of Constipation and Irritable Bowel Syndrome in Parkinsons Disease Patients According to Rome III Diagnostic Criteria[J]. J Parkinsons Dis,2017,7(2):353-357.
[7] FU P,GAO M,YUNG K. Association of intestinal disorders with Parkinsons disease and Alzheimers ?disease: a systematic review and meta-analysis[J]. ACS Chem Neurosci,2020,11(3):395-405.
[8] YU Q J,YU S Y,ZUO L J,et al. Parkinson disease with constipation: clinical features and relevant factors[J]. Sci Rep,2018,8(1):567.
[9] CREMONINI F,CAMILLERI M,ZINSMEISTER A R,et al. Sleep disturbances are linked to both upper and lower gastrointestinal symptoms in the general population[J]. Neurogastroenterol Motil,2009,21(2):128-135.
[10] LEE Y T,HU L Y,SHEN C C,et al. Risk of psychiatric disorders following irritable bowel syndrome: a nationwide population-based cohort study[J]. PLoS One,2015,10(7):e0133283.
[11] PINTO-SANCHEZ M I,F(xiàn)ORD A C,AVILA C A,et al. Anxiety and depression increase in a stepwise manner in parallel with multiple FGIDs and symptom severity and frequency[J]. Am J Gastroenterol,2015,110(7):1038-1048.
[12] ROBERTS A,GRAFTON G,POWELL A D,et al. CSTI-300(SMP-100); a novel 5-HT3 receptor partial agonist with potential to treat patients with irritable bowel syndrome or carcinoid syndrome[J]. J Pharmacol Exp Ther,2020,
373(1):122-134.
[13] TANG H,CHEN X,HUANG S,et al. Targeting the gut-microbiota-brain axis in irritable bowel disease to improve ?cognitive function-recent knowledge and emerging therapeutic opportunities[J]. Rev Neurosci,2023,doi:10.1515/revneuro-2022-0155.
[14] POZUELO M,PANDA S,SANTIAGO A,et al. Reduction of butyrate-and methane-producing microorganisms in patients with irritable bowel syndrome[J]. Sci Rep,2015,5:12693.
[15] LI Y,CHEN Y,JIANG L,et al. Intestinal inflammation and parkinsons disease[J]. Aging Dis,2021,12(8):2052-2068.
[16] BRAAK H,DEL TREDICI K,R?譈B U,et al. Staging of brain pathology related to sporadic Parkinsons disease[J]. Neurobiol Aging,2003,24(2):197-211.
[17] CHEN Q Q,HAIKAL C,LI W,et al. Gut inflammation in association with pathogenesis of parkinsons disease[J]. Front Mol Neurosci,2019,12:218.
[18] ZHANG X,SVN Z,LIV M,et al. Association between irritable bowel syndrome and risk of parkinsons disease: a systematic review and meta-analysis[J]. Front Neurol,2021,12:720958.
[19] RODR?魱GUEZ-VIOLANTE M,ZER?魷N-MART?魱NEZ R,CERVANTES-ARRIAGA A,et al. Who can diagnose Parkinsons disease first? role of pre-motor symptoms[J]. Arch Med Res,2017,48(3):221-227.
[收稿日期] 2022-11-03
(本文編輯 ? 趙喜)

