長鏈非編碼RNA UCA1促進人骨髓間充質干細胞成骨分化研究
盧倩倩,張澤兵,王景云
(吉林大學白求恩口腔醫學院,吉林 長春130021)
骨質疏松癥、外傷和發育異常等常導致頜面部牙槽骨缺損和骨量不足[1]。一方面,限制了口腔修復方案的選擇,臨床上多數情況只能選擇活動義齒來恢復缺失的牙槽骨,大大降低了咀嚼效率和固位力。另一方面,降低了口腔種植手術的成功率,通過植骨手術來增加骨量,給患者帶來了更多的創傷和經濟負擔[2-4]。因此亟需尋求更加高效增加骨量的方法。人骨髓間充質干細胞(human bone marrow mesenchymal stem cells,hBMSCs)大量存在于頜骨骨髓腔中,能夠成骨、成軟骨向分化,其分化過程受很多分子調控[5-7]。
多種RNA分子調控著人骨髓間充質干細胞的成骨分化以維持骨穩態[8-10]。研究表明其中一些長鏈非編碼RNA(long noncoding RNA,lncRNA) 通過與miRNA分子相互作用調控hBMSCs基因表達的信號通路,干預其成骨分化方向[11-13]。UCA1(urothelial cancer associated 1,UCA1)是一種高度特異化的lncRNA。作為一種大于200個核苷酸的非編碼基因[14],UCA1幾乎不編碼蛋白質。基因芯片分析結果表明lncRNA UCA1在骨質疏松癥患者的血漿中,和健康人相比明顯升高[15],提示UCA1很可能在調控骨代謝平衡中發揮關鍵作用。其有一短一長兩種主要形式,在本研究中分別記為UCA1a和UCA1b[16]。UCA1是否參與hBMSCs的成骨分化而影響骨代謝仍然未知。
本研究通過構建過表達lncRNA UCA1的慢病毒載體UCA1a和UCA1b及空載體感染hBMSCs,探究體外兩種不同結構的UCA1是否調控hBMSCs的成骨分化,對利用分子干預干細胞的基因表達從而促進骨形成修復頜面部骨缺損具有深遠意義。
1 材料與方法
1.1 細胞培養
實驗采用人骨髓間充質干細胞在含10%胎牛血清的DMEM培養基中于37℃含5%CO2培養箱中培養,每3天換液1次,細胞融合度達到80%~90%時用Accutase細胞消化液以1∶2的比例傳代。每次傳代前凍存一定比例的傳代細胞。后續實驗使用第3至6代細胞。
1.2 感染和實驗分組
UCA1的兩種變體(UCA1a和UCA1b)的cDNA分別被亞克隆到慢病毒載體質粒CSII-CMV-MCS位于Nhe I和Xho I之間獨特的限制酶酶切位點,并設立空載體慢病毒顆粒為對照組。實驗分為4組:對照組1組為干細胞對照組;對照組2組為空載體對照組;UCA1a組為高表達UCA1a的實驗組;UCA1b組為高表達UCA1b的實驗組。感染HEK293T細胞72 h時采用Real-Time RT-PCR檢測各組UCA1的表達水平。成功高表達UCA1后,依次感染各組hBMSCs。
1.3 實時熒光定量逆轉錄聚合酶鏈式反應Real-Time RT-PCR
感染72 h的細胞和誘導培養7 d、14 d和21 d的細胞,采用PureLink RNA Mini kit提取和純化總RNA。Nanodrop2000測量所提取的RNA的濃度,使用iScript cDNA Synthesis Kit反轉錄得到第1鏈cDNA,第1鏈cDNA與特異引物當成模板完成Real-Time RT-PCR。擴增程序:95℃變性 30 s,39 個擴增循環,反應溫度為 95℃ 3 s、60℃ 30 s。采用2-ΔΔCt方法計算目標基因相對于內參基因S29的表達量,所用引物序列如表1。

表1 PCR所用引物的核苷酸序列
1.4 茜素紅染色
UCA1成功高表達后,更換成骨誘導培養基,每3 d半量換液1次,共誘導21 d。成骨誘導7 d、14 d和21 d時,完成茜素紅染色。室溫下,首先用100 ml蒸餾水溶解1 g茜素紅,并用稀釋氨水將pH值調至6.4,配制好茜素紅染液。室溫下每孔用4%PFA 1 ml固定10 min后,蒸餾水洗滌,加入1 ml剛配制的染液染色20 min,最后蒸餾水洗滌、放置干燥。
1.5 Real-Time RT-PCR測定成骨相關標志物的表達
按照上述方法測定成骨特異性基質蛋白堿性磷酸酶ALP、骨橋蛋白OPN、I型膠原COL1和成骨相關轉錄因子SP7和成脂分化關鍵轉錄因子PPARγ及脂類合成酶的關鍵基因LPL的mRNA表達水平。
1.6 統計學分析
每組3個樣本量,操作驗證3次。數據進行正態性檢驗并以平均值±標準差表示,采用SPSS 26處理分析,組間數據采用單因素方差分析,Tukey多重檢驗進行比較,P<0.05為差異有統計學意義。
2 結果
2.1 構建UCA1穩定過表達的hBMSCs細胞系
UCA1a組和UCA1b組在21 d內相比于對照組維持穩定顯著高表達UCA1,兩對照組間無顯著差異,模型構建成功(P<0.01),見圖1。
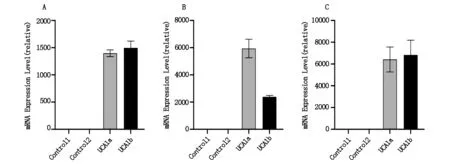
圖1 lncRNA UCA1基因高表達的檢測
2.2 茜素紅染色結果及分析
人骨髓間充質干細胞成骨誘導后7 d、14 d和21 d,分別進行油紅O染色。成骨誘導7 d后各組無陽性結果。14 d和21 d后,染色面積加大,21 d相較于14 d各組人骨髓間充質干細胞染色顏色加深加厚,表明礦化結節增多,鈣鹽沉積量增多,見圖2。
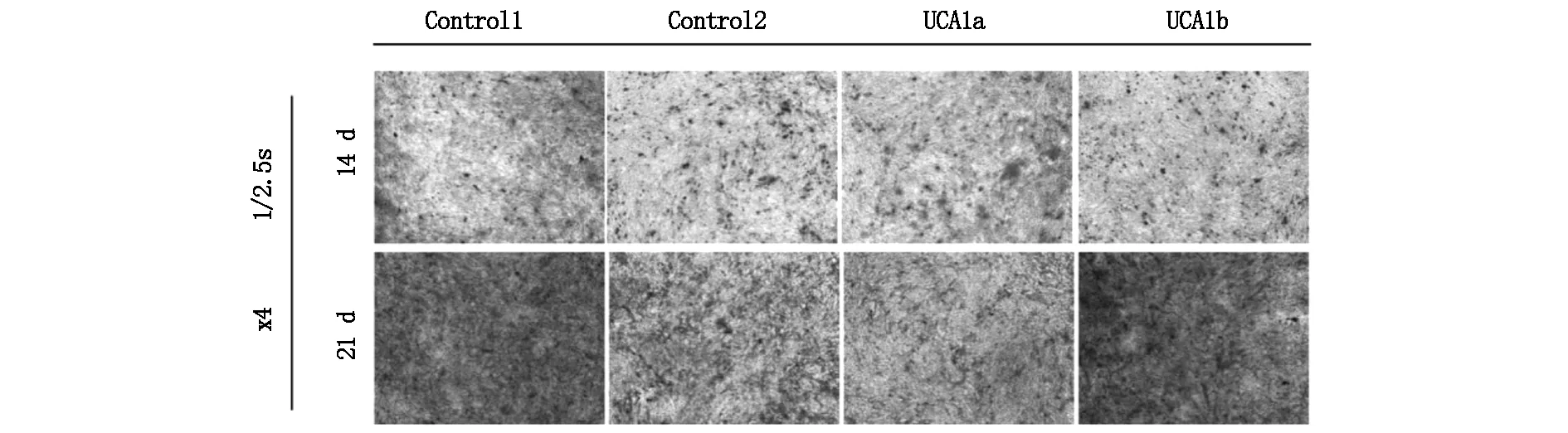
圖2 成骨誘導14 d、21 d時茜素紅染色結果
2.3 成骨關鍵基因的Real-Time RT-PCR結果及分析
COL1I型膠原,作為成骨細胞分化成熟的早期標志,兩組實驗組7 d和14 d時相對于對照組表達水平均明顯上調,差異有統計學意義。在21 d時,Col1在4組中的表達量相較于7 d和14 d時均減低。ALP作為成骨細胞分化成熟的早期標志,mRNA的表達水平在兩組實驗組UCA1a組和UCA1b組中14 d和21 d時,相對于兩組對照組均明顯上調,且相較于7 d時明顯增加見圖3。另外,14 d時,實驗組OPN和SP7的表達均高于對照組,P<0.05,差異有統計學意義。綜上結果表明UCA1高表達組細胞成骨分化能力明顯增強,骨形成增強。
3 討論
UCA1作為成骨分化的正調控分子,在骨代謝中扮演重要角色。LI等[16]發現骨質疏松癥患者血漿UCA1表達明顯升高。SHU等[17]的研究表明,UCA1通過miRNA-145-5p/SMAD5和miRNA-124-3p/SMAD4軸促進BMSCs向軟骨分化。ISHIKAWA等[18]發現UCA1在成軟骨分化過程中呈明顯高表達趨勢。然而,UCA1是否通過參與BMSCs 的成脂分化和成骨分化平衡而影響骨質疏松癥的發生發展仍然未知[19-20]。本研究探討了UCA1對hBMSCs成骨分化的影響,結果表明隨著兩種結構的UCA1持續高表達,細胞在14 d時成骨分化能力均明顯增強,骨形成增強,但在21 d時,成骨關鍵基因的mRNA水平相比于14 d均顯著減低。結合實驗結果和前人的實驗發現,UCA1在成骨功能減弱的骨質疏松癥患者血漿中上調,卻在體外實驗中有一定促進骨形成的功能。骨質疏松癥患者還有脂肪大量堆積對成骨功能的影響[21-22],有可能是患者體內成脂相關分子競爭抑制UCA1相關靶點的成骨信號通路,加強脂肪堆積。有研究表明未來有望在種植體周圍釋放適量的某種藥物通過上下游干預UCA1的基因表達,進而調控hBMSCs的分化,從而增強促骨形成功能。
值得注意的是,縱向觀察實驗7 d、14 d和21 d的成骨基因表達水平變化,發現在21 d時兩種過表達UCA1的實驗組細胞相關基因的mRNA水平相對于14 d時均減低。有可能是因為在21 d時UCA1的表達量過高,通過某種機制對相關基因的調控產生了不同作用。也有可能是UCA1對hBMSCs相關分化的不同階段作用方式和強度不同,具體機制仍需深入研究。另一方面,關于UCA1促成骨方面的作用,采用不同的研究模型得出的結果并不一致。ISHIKAWA等[18]通過構建穩定敲除UCA1的小鼠成骨細胞MC3T3-e1細胞系,發現沉默UCA1能顯著促進成骨細胞MC3T3-e1的增殖和分化。最后Western blotting分析骨形態發生蛋白2(BMP-2)/(SMAD5/8)信號通路的表達,顯示UCA1的作用可能是通過成骨細胞BMP-2/(SMAD5/8)信號通路介導。下調UCA1可通過激活成骨細胞BMP-2/(SMAD5/8)信號通路促進成骨細胞增殖和分化。本實驗結果表明 UCA1過表達在hBMSCs成骨誘導14 d時成骨關鍵基因ALP、Col1、OPN及SP7的表達均增強,且形態學染色觀察到相同結果,但其體內實驗作用結果尚不可知。
近期熱點分子lncRNA調控hBMSCs 分化的研究大量涌現[23],但是大部分 lncRNA 僅被確定為 BMSCs 成骨分化的促進或抑制因子。本研究的結果表明UCA1過表達在體外細胞水平能夠促進hBMSCs的成骨分化,可為后續深入研究修復骨缺損疾病的分子治療提供一定的參考價值。

